Журнал «Почки» Том 14, №4, 2025
Вернуться к номеру
Порівняльне дослідження N-ацетилцистеїну та L-карнітину в лікуванні чоловічого безпліддя (плацебо-контрольоване дослідження)
Авторы: Mohanned Hussam Mohammed Saeed1, Zainab Abdul Hammed Ibrahim2
(1) - College of Medicine, University of Tikrit, Iraq
(2) - College of Pharmacy, University of Tikrit, Iraq
Рубрики: Нефрология
Разделы: Клинические исследования
Версия для печати
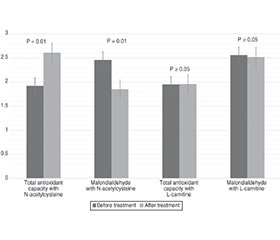
Актуальність. Чоловічe безпліддя — це всесвітньо визнаний стан здоров’я, який спостерігається переважно у віковому діапазоні 35–39 років. У глобальному масштабі чоловіки щонайменше з трьох із шести пар страждають від безпліддя. Дослідницькі дані показують терапевтичні переваги L-карнітину та N-ацетилцистеїну в безплідних чоловіків, однак наявні дані обмежені високою гетерогенністю сучасних досліджень. Тому метою було вивчити вплив цих методів лікування на параметри сперми, рівень малонового діальдегіду в ній та загальну антиоксидантну здатність. Матеріали та методи. У цьому рандомізованому плацебо-контрольованому клінічному дослідженні з січня 2021 року по грудень 2024 року взяли участь 180 пацієнтів чоловічої статі з нормальним жіночим фактором та ідіопатичною олігоастенотератозооспермією. Особи вікової групи 25–40 років були рандомізовані для лікування L-карнітином (1000 мг перорально), N-ацетилцистеїном (перорально) та плацебо (цукрові пакетики). Базові дані включали вік пацієнта та параметри сперми (рухливість, концентрацію, морфологію сперматозоїдів та об’єм сперми). Параметри сперми в групах були повторно вивчені через шість місяців дослідження. Крім того, загальну антиоксидантну здатність та рівень малонового діальдегіду в спермі оцінювали до та після лікування. Результати. Шестимісячний аналіз показав, що параметри сперми, включаючи рухливість сперматозоїдів (38 та 38 проти 4 %), їхню морфологію (30 і 29 проти 7 %) та концентрацію (25 і 24 проти 2 %), значно поліпшилися при застосуванні відповідно N-ацетилцистеїну та L-карнітину порівняно з плацебо. Однак об’єм сперми (6 та 5 проти 4 %) не зазнав впливу жодного з методів лікування й суттєво не відрізнявся від групи плацебо (p > 0,05). Порівняно з попереднім лікуванням монотерапія N-ацетилцистеїном поліпшила загальну антиоксидантну здатність (1,92 ± 0,12 проти 2,61 ± 0,12; p = 0,01) та знизила рівень малонового діальдегіду (2,46 ± 0,11 проти 1,85 ± 0,10; p = 0,01) у спермі. Однак порівняно з плацебо ці поліпшення не спостерігалися при монотерапії L-карнітином. Висновки. Пероральне лікування L-карнітином та N-ацетилцистеїном ефективно поліпшувало концентрацію, морфологію та рухливість сперматозоїдів у чоловіків із безпліддям. Однак при використанні N-ацетилцистеїну та L-карнітину як монотерапії статистично значущих відмінностей не було. Крім того, N-ацетилцистеїн виявився кращим за L-карнітин у зниженні оксидативного стресу та рівня малонового діальдегіду в плазмі сперми. Проспективні дослідження повинні визначити механізми, що лежать в основі ефективності L-карнітину/N-ацетилцистеїну, та оцінити безпеку й ефективність комбінованого антиоксидантного лікування чоловічого безпліддя.
Background. Male infertility is a globally recognised health condition, which is mainly reported in the age range of 35–39 years. Males from at least three in six couples are impacted by infertility on a global scale. Research evidence reveals the therapeutic benefits of L-carnitine and N-acetylcysteine for infertile males; however, the current evidence is limited by high heterogeneity in contemporary studies. Therefore, this study aimed to investigate the influence of these treatments on sperm parameters and the semen’s malondialdehyde level and total antioxidant capacity. Materials and methods. This randomised placebo-controlled clinical trial deployed 180 male patients with normal female factor and idiopathic oligoasthenoteratozoospermia from January 2021 to December 2024. The patients in the age group of 25–40 years were randomised into L-carnitine (1000 mg oral dose), N-acetylcysteine (oral dose), and placebo (sugar sachets) treatments. The baseline data included the patient’s age and sperm parameters (including sperm motility, sperm concentration, sperm morphology, and semen volume). The semen parameters in the study groups were re-investigated after six months of the study intervention. Additionally, total antioxidant capacity and malondialdehyde levels in the semen were evaluated before and after the treatment administration. Results. The six-monthly analysis revealed that the sperm parameters, including sperm motility (38 and 38 vs. 4 %), morphology (30 vs. 29 vs. 7 %), and concentration (25 and 24 vs. 2 %), significantly improved with the administration of N-acetylcysteine and L-carnitine, respectively, in comparison to the placebo. However, semen volume (6 and 5 vs. 4 %) was not impacted by either treatment and did not differ significantly from the placebo group (p > 0.05). Compared to pretreatment, N-acetylcysteine monotherapy improved the total antioxidant capacity (1.92 ± 0.12 vs. 2.61 ± 0.12; p = 0.01) and reduced the level of malondialdehyde (2.46 ± 0.11 vs. 1.85 ± 0.10; p = 0.01) in the semen. However, in comparison to the placebo, these improvements were not observed with L-carnitine monotherapy. Conclusions. The oral L-carnitine and N-acetylcysteine treatments effectively improved sperm concentration, morphology, and motility in male patients with infertility. However, as a single-agent therapy, no statistically significant differences were observed between the outcomes of N-acetylcysteine and L-carnitine. In addition, N-acetylcysteine appeared superior to L-carnitine in reducing the oxidative stress and malondialdehyde levels in the seminal plasma. Prospective studies should identify the mechanisms underlying the efficacy of L-carnitine/N-acetylcysteine and evaluate the safety and effectiveness of combination antioxidant treatments against male infertility.
чоловіче безпліддя; N-ацетилцистеїн; L-карнітин; рухливість; морфологія; загальна антиоксидантна здатність; малоновий діальдегід; сперматозоїди; сперма
male infertility; N-acetylcysteine; L-carnitine; motility; morphology; total antioxidant capacity; malondialdehyde; sperm; semen
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Shan Z, Chen S, Zhou W, Yang Y, Zhang G, Zhao J. Analysis of the burden of disease for male infertility globally and in China from 1990 to 2021. Translational Andrology and Urology. 2025;14(5):1363-1378.
- Leslie SW, Soon-Sutton TL, Khan MAB. Male infertility. StatPearls. Treasure Island (FL); 2025.
- Huang B, Wang Z, Kong Y, Jin M, Ma L. Global, regional and national burden of male infertility in 204 countries and territories between 1990 and 2019: An analysis of the global burden of disease study. BMC Public Health. 2023;23(1).
- Biggs SN, Halliday J, Hammarberg K. Psychological consequences of a diagnosis of infertility in men: A systematic analysis. Asian Journal of Andrology. 2024;26(1):10-19.
- Tesarik J. Lifestyle and environmental factors affecting male fertility, individual predisposition, prevention, and intervention. International Journal of Molecular Sciences. 2025;26(6).
- De Vries CEJ, Veerman-Verweij EM, van den Hoogen A, de Man-van Ginkel JM, Ockhuijsen HDL. The psychosocial impact of male infertility on men undergoing ICSI treatment: A qualitative study. Reproductive Health. 2024;21(1).
- García-Baquero R, Fernández-Ávila CM, Álvarez-Ossorio JL. Empiric therapy for idiopathic oligoasthenoteratozoospermia. Actas Urológicas Españolas (English Edition). 2020;44(5):281-288.
- Cavallini G. Male idiopathic oligoasthenoteratozoospermia. Asian Journal of Andrology. 2006;8(2):143-157.
- Imamovic Kumalic S, Pinter B. Review of clinical trials on effects of oral antioxidants on basic semen and other parameters in idiopathic oligoasthenoteratozoospermia. BioMed Research International. 2014;2014:1-11.
- Rahimi Darehbagh R, Khalafi B, Allahveisi A, Habiby M. Effects of the mitochondrial genome on germ cell fertility: A review of the literature. Int J Fertil Steril. 2022;16(2):70-75.
- Mannucci A, Argento FR, Fini E, Coccia ME, Taddei N, Becatti M, et al. The impact of oxidative stress on male infertility. Frontiers in Molecular Biosciences. 2022;8.
- Kaltsas A. Oxidative stress and male infertility: The protective role of antioxidants. Medicina. 2023;59(10).
- Vahedi Raad M, Firouzabadi AM, Tofighi Niaki M, Henkel R, Fesahat F. The impact of mitochondrial impairments on sperm function and male fertility: A systematic review. Reproductive Biology and Endocrinology. 2024;22(1).
- Wang Y, Fu X, Li H. Mechanisms of oxidative stress-induced sperm dysfunction. Frontiers in Endocrinology. 2025;16.
- Walczak-Jedrzejowska R, Wolski JK, Slowikowska-Hil–czer J. The role of oxidative stress and antioxidants in male fertility. Central European Journal of Urology. 2013;65:60-67.
- Caroppo E, Dattilo M. Sperm redox biology challenges the role of antioxidants as a treatment for male factor infertility. F&S Reviews. 2022;3(1):90-104.
- Sudhakaran G, Kesavan D, Kandaswamy K, Guru A, Arockiaraj J. Unravelling the epigenetic impact: Oxidative stress and its role in male infertility-associated sperm dysfunction. Reproductive Toxicology. 2024;124.
- Silva R, Carrageta DF, Alves MG, Silva BM, Oliveira PF. Antioxidants and male infertility. Antioxidants. 2022;11(6).
- Pedre B, Barayeu U, Ezeriņa D, Dick TP. The mechanism of action of N-acetylcysteine (NAC): The emerging role of H2S and sulfane sulfur species. Pharmacology & Therapeutics. 2021;228.
- Sahasrabudhe SA, Terluk MR, Kartha RV. N-acetylcysteine pharmacology and applications in rare diseases: Repurposing an old antioxidant. Antioxidants. 2023;12(7).
- Zhou Z, Cui Y, Zhang X, Zhang Y. The role of N-acetyl-cysteine (NAC) orally daily on the sperm parameters and serum hormones in idiopathic infertile men: A systematic review and meta-analysis of randomised controlled trials. Andrologia. 2021;53(2).
- Jannatifar R, Parivar K, Roodbari NH, Nasr-Esfahani MH. Effects of N-acetyl-cysteine supplementation on sperm quality, chromatin integrity and level of oxidative stress in infertile men. Reproductive Biology and Endocrinology. 2019;17(1).
- Mateus FG, Moreira S, Martins AD, Oliveira PF, Alves MG, de Lourdes Pereira M. L-carnitine and male fertility: Is supplementation beneficial? Journal of Clinical Medicine. 2023;12(18).
- Ahmed MM, Ibrahim ZS, Alkafafy M, El-Shazly SA. –L-carnitine protects against testicular dysfunction caused by gamma irradiation in mice. Acta Histochemica. 2014;116(6):1046-1055.
- Oner G, Oner C, Junejo NN. L-carnitine supplementation before assisted reproduction for male infertility. Reproductive BioMedicine Online. 2024;49.
- Shaikh J, More A, Anjankar N, Nair N, Mahajan SS, Nawale N. Enhancing male fertility through nutrition: The role of L-carnitine in asthenozoospermic patients. Journal of Pharmacy and Bioallied Sciences. 2025;17(Suppl 1):S1019-S1022.
- Wei G, Zhou Z, Cui Y, Huang Y, Wan Z, Che X, et al. A meta-analysis of the efficacy of L-carnitine/L-acetyl-carnitine or –N-acetyl-cysteine in men with idiopathic asthenozoospermia. American Journal of Men’s Health. 2021;15(2).
- Khaw SC, Wong ZZ, Anderson R, Martins da Silva S. –L-carnitine and L-acetylcarnitine supplementation for idiopathic male infertility. Reproduction and Fertility. 2020;1(1):67-81.
- Ranneh Y, Hamsho M, Fadel A, Ali Osman HM, Ali EW, Mohammed Kambal NH. Therapeutic potential of carnitine and –N-acetyl-cysteine supplementation on sperm parameters and pregnancy outcomes in idiopathic male infertility: A systematic review and meta-analysis of randomised control trials. Reproduction and Bree–ding. 2025;5(1):74-83.
- Boeri L, Fallara G, Pozzi E, Belladelli F, Corsini C, Raffo M, et al. The impact of different WHO reference criteria for semen analysis in clinical practice: Who will benefit from the new 2021 thresholds for normal semen parameters? Andrology. 2022;10(6):1134-1142.
- Wald G, Punjani N, Hayden R, Feliciano M, Dudley V, Goldstein M. Assessing the clinical value of the Kruger strict morpho–logy criteria over the World Health Organisation fourth edition criteria. F&S Reports. 2021;2(2):176-180.
- Ranganathan P. An introduction to statistics: Choosing the correct statistical test. Indian Journal of Critical Care Medicine. 2021;25(S2):S184-S186.
- Kwak S. Are only p-values less than 0.05 significant? A –p-value greater than 0.05 is also significant. Journal of Lipid and –Atherosclerosis. 2023;12(2).
- Safarinejad MR, Safarinejad S. Efficacy of selenium and/or N-acetyl-cysteine for improving semen parameters in infertile men: A double-blind, placebo-controlled, randomised study. Journal of Uro–logy. 2009;181(2):741-751.
- Ghafarizadeh A, Malmir M, Naderi Noreini S, Faraji T. Antioxidant effects of N-acetylcysteine on the male reproductive system: A systematic review. Andrologia. 2020;53(1).
- Baetas J, Rabaça A, Gonçalves A, Barros A, Sousa M, Sá R. Protective role of N-acetylcysteine (NAC) on human sperm exposed to etoposide. Basic and Clinical Andrology. 2019;29(1).
- Nazari L, Salehpour S, Hosseini S, Allameh F, Jahanmardi F, Azizi E, et al. Effect of antioxidant supplementation containing L-carnitine on semen parameters: A prospective interventional study. JBRA Assisted Reproduction. 2020.
- Lahimer M, Gherissi O, Ben Salem N, Ben Mustapha H, Bach V, Khorsi-Cauet H, et al. Effect of micronutrients and L-carnitine as antioxidants on sperm parameters, genome integrity, and ICSI outcomes: Randomised, double-blind, and placebo-controlled clinical trial. Antioxidants. 2023;12(11).
- Kooshesh L, Nateghian Z, Aliabadi E. Evaluation of L-carnitine potential in the improvement of male fertility. Journal of Reproduction & Infertility. 2023.
- Micic S, Lalic N, Djordjevic D, Bojanic N, Bogavac-Stanojevic N, Busetto GM, et al. Double-blind, randomised, placebo-controlled trial on the effect of L-carnitine and L-acetylcarnitine on sperm parameters in men with idiopathic oligoasthenozoospermia. Andrologia. 2019;51(6).
- Ahmadi S, Bashiri R, Ghadiri-Anari A, Nadjarzadeh A. Antioxidant supplements and semen parameters: An evidence-based review. Int J Reprod Biomed. 2016;14(12):729-736.
- Li K-P, Yang X-S, Wu T. The effect of antioxidants on sperm quality parameters and pregnancy rates for idiopathic male infertility: A network meta-analysis of randomised controlled trials. Frontiers in Endocrinology. 2022;13.
- Dimitriadis F, Borgmann H, Struck J, Salem J, Kuru T. Antioxidant supplementation on male fertility: A systematic review. Antioxidants. 2023;12(4).
- Jannatifar R, Parivar K, Hayati Roodbari N, Nasr-Esfahani MH. The effect of N-acetyl-cysteine on Nrf2 antioxidant gene expression in asthenoteratozoospermia men: A clinical trial study. Int J Fertil Steril. 2020;14(3):171-175.
- Zahaki Nosrat F, Yari S, Mahmoodi B, Hasanein P. Effects of N-acetylcysteine on rat sperm treated with hydrogen peroxide in in-vitro conditions. Biotechnic & Histochemistry. 2025;100(5):1-9.
- Chang D, Kong F, Jiang W, Li F, Zhang C, Ding H, et al. Effects of L-carnitine administration on sperm and sex hormone le–vels in a male Wistar rat reproductive system injury model in a high-altitude hypobaric hypoxic environment. Reproductive Sciences. 2023;30(7):2231-2247.
- Jabarineitapeh M, Naderi N, Tavalaee M, Nasr-Esfa–hani MH. Effects of L-carnitine over-supplementation on spermatogenesis and sperm function in healthy NMRI mice. Tissue and Cell. 2025;96.
- Ghorbani F, Nasiri Z, Koohestanidehaghi Y, Lorian K. The antioxidant roles of L-carnitine and N-acetyl cysteine against oxidative stress on human sperm functional parameters during vitrification. Clinical and Experimental Reproductive Medicine. 2021;48(4):316-321.
- Virmani MA, Cirulli M. The role of L-carnitine in mitochondria, prevention of metabolic inflexibility, and disease initiation. International Journal of Molecular Sciences. 2022;23(5).
- Lee YCG, Chou H-C, Chen Y-T, Tung S-Y, Ko T-L, Buyandelger B, et al. L-carnitine reduces reactive oxygen species/endoplasmic reticulum stress and maintains mitochondrial function during autophagy-mediated cell apoptosis in perfluorooctanesulfo–nate-trea–ted renal tubular cells. Scientific Reports. 2022;12(1).
- Padwal LP, More A, Choudhary N, Kalasakar GL, Wadhe T. L-carnitine and acetyl-L-carnitine: A novel approach to treating male infertility with abnormal sperm morphology. Journal of Pharmacy and Bioallied Sciences. 2025;17(Suppl 1):S1038-S1041.
- Meta-analysis of the efficacy and safety of L-carnitine and N-acetylcysteine monotherapy for male idiopathic infertility. Revista Internacional de Andrología. 2025;23(1).
- Iliceto M, Stensen MH, Andersen JM, Haugen TB, Wit–czak O. Levels of L-carnitine in human seminal plasma are associated with sperm fatty acid composition. Asian Journal of Andrology. 2022;24(5):451-457.
- Adeoye O, Olawumi J, Opeyemi A, Christiania O. Review on the role of glutathione on oxidative stress and infertility. JBRA Assisted Reproduction. 2017.
- Agarwal A, Sengupta P, Durairajanayagam D. Role of L-carnitine in female infertility. Reproductive Biology and Endocrinology. 2018;16(1).
- Yang K, Wang N, Guo H-T, Wang J-R, Sun H-H, Sun L-Z, et al. Effect of L-carnitine on sperm quality during liquid sto–rage of boar semen. Asian-Australasian Journal of Animal Sciences. 2020;33(11):1763-1769.