Архив офтальмологии Украины Том 13, №2, 2025
Вернуться к номеру
Модель прогнозування діабетичної ретинопатії на підставі визначення трансформуючого фактора росту бета 1 і поліморфізму rs1800470 гена TGFB
Авторы: Кудриль І.В.
ДНП «Львівський національний медичний університет імені Данила Галицького», м. Львів, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
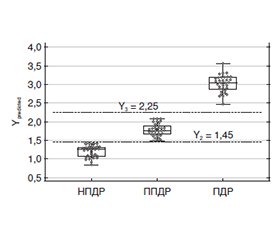
Актуальність. Наявність зв’язку трансформуючого фактора росту бета 1 (TGF-β1) з розвитком та прогресуванням діабетичної ретинопатії (ДР) зумовила спробу створення відповідної математичної моделі прогнозу ДР. Мета: встановити можливість прогнозування стадії ДР на підставі визначення вмісту TGF-β1 у крові та внутрішньоочній рідині (ВОР), а також генотипу поліморфізму rs1800470 гена TGFB1. Матеріали та методи. Обстежено 102 особи з цукровим діабетом 2-го типу, яких за стадіями ДР розділили на 3 групи: 1-ша — з непроліферативною ДР (35 осіб), 2-га — з препроліферативною (34 особи) і 3-тя — з проліферативною (33 особи). До контрольної групи увійшла 61 особа. У пацієнтів проводили стандартні офтальмологічні обстеження. Визначення TGF-β1 у сироватці крові і ВОР проводили методом імуноферментного аналізу (Invitrogen Thermo Fisher Sci., США). Алелі rs1800470 визначали методом полімеразної ланцюгової реакції у реальному часі (TaqMan Mutation Detection Assays Life-Technology, США). Для аналізу зв’язку стадії ДР з факторами ризику проводили кореляційний аналіз та будували моделі узагальненої лінійної регресії (GLM). Результати. Позитивну кореляцію з прогресуванням ДР (p < 0,05) мали тривалість діабету, вміст TGF-β1 у крові та ВОР, центральна товщина та об’єм сітківки. Зв’язок з ДР було показано і з компенсацією діабету (р = 0,002) — при некомпенсованому діабеті прогресування ДР було вірогідно вищим. Відбір сукупності незалежних факторів, пов’язаних зі стадією ДР, виділив 5 факторних ознак: компенсація діабету, вміст у крові глікованого гемоглобіну і TGF-β1, вміст у ВОР TGF-β1, а також генотип поліморфізму rs1800470. Модель прогнозувала стадію ДР із 100% точністю (p < 0,001). У розробленій моделі найбільше значення мали 3 ознаки: компенсація діабету, генотип rs1800470 та вміст у ВОР TGF-β1. Модель, побудована на цих трьох ознаках, адекватна (p < 0,0001) та мала точність 97,0 %. Висновки. Доведена важливість порушення шляху TGF-β1, збільшення вмісту якого відповідало тяжкості ДР. Отримана GLM дозволяла чітко диференціювати стадії ДР та кількісно відображала її тяжкість.
Background. The existence of a connection between transforming growth factor beta 1 (TGF-β1) and the development and progression of diabetic retinopathy (DR) led to an attempt to create an appropriate mathematical model for DR prognosis. Aim: to establish the possibility of predicting the stage of DR based on the determination of the content of TGF-β1 in the blood and intraocular fluid (IOF), as well as the genotype of the rs1800470 polymorphism of the TGFB1 gene. Materials and methods. 102 people with type 2 diabetes were examined and divided into 3 groups according to the stages of DR: 1st — non-proliferative DR (35 people), 2nd — preproliferative (34 people) and 3rd — proliferative (33 people). The control group consisted of 61 people. The patients underwent standard ophthalmic examinations. Evaluation of TGF-β1 in blood serum and IOF was performed by enzyme immunoassay (Invitrogen Thermo Fisher Scientific, USA). Alleles rs1800470 were determined by real-time polymerase chain reaction (TaqMan Mutation Detection Assays, Life Technologies, USA). To analyze the relationship between the DR stage and risk factors, correlation analysis was performed and generalized linear models were built. Results. The duration of diabetes, content of TGF-β1 in the blood and IOF, central retinal thickness and volume had a positive correlation with the progression of DR (p < 0.05). The connection with DR was also shown with the compensation of diabetes (p = 0.002): in uncompensated diabetes, the progression of DR was significantly higher. The selection of a set of independent factors associated with the DR stage identified 5 factorial features: compensation of diabetes, the content of glycated hemoglobin and TGF-β1 in the blood, the content of TGF-β1 in IOF, as well as the rs1800470 genotype. The model predicted the DR stage with 100 % accuracy (p < 0.001). In the developed model, 3 features were of the greatest importance: compensation of diabetes, the rs1800470 genotype and the content of TGF-β1 in IOF. The model built on these three features is adequate (p < 0.0001) and had an accuracy of 97.0 %. Conclusions. The importance of TGF-β1 pathway disruption has been proven, an increase in its content corresponded to the severity of DR. The resulting generalized linear model allowed to clearly differentiate the stages of DR and quantitatively reflect its severity.
діабетична ретинопатія; цукровий діабет 2-го типу; TGF-β1; rs1800470; TGFB1; компенсація діабету; прогностична модель
diabetic retinopathy; type 2 diabetes; transforming growth factor beta 1; rs1800470; TGFB1; diabetes compensation; prognostic model
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Abramoff MD, Fort PE, Han IC, Jayasundera KT, Sohn EH, Gardner TW. Approach for a Clinically Useful Comprehensive Classification of Vascular and Neural Aspects of Diabetic Retinal Disease. Invest Ophthalmol Vis Sci. 2018;59(1):519-27. doi: 10.1167/iovs.17-21873.
- Baltă F, Cristescu IE, Mirescu AE, Baltă G, Zemba M, Tofolean IT. Investigation of retinal microcirculation in diabe–tic patients using adaptive optics ophthalmoscopy and optical coherence angiography. J Diabetes Res. 2022;2022:1516668. doi: 10.1155/2022/1516668.
- Wang W, Lo ACY. Diabetic Retinopathy: Pathophysiology and Treatments. Int J Mol Sci. 2018 Jun 20;19(6):1816. doi: 10.3390/ijms19061816.
- Natrus LV, Mogilevskyy SYu, Panova TI, Rykov SO, Bykhovets MIu. A novel concept of differences in pathogenetic mechanism of diabetic retinopathy progression between type 2 diabetes mellitus patients differing in the PPARγ genotype. J. ophthalmol (Ukraine). 2020;5:36-42. doi: 10.31288/oftalmolzh202053642.
- Uemura A, Fruttiger M, D’Amore PA, De Falco S, Joussen AM, Sennlaub F, et al. VEGFR1 signaling in retinal angiogenesis and microinflammation. Prog Retin Eye Res. 2021;84:100954. doi: 10.1016/j.preteyeres.2021.100954.
- Majidova SR. Evaluation of Hypoxia and Microcirculation Factors in the Progression of Diabetic Retinopathy. Invest Ophthalmol Vis Sci. 2024 Jan 2;65(1):35. doi: 10.1167/iovs.65.1.35.
- Llorián-Salvador M, Cabeza-Fernández S, Gomez-Sanchez JA, de la Fuente AG. Glial cell alterations in diabetes-induced neurodegeneration. Cell Mol Life Sci. 2024;81(1):47. doi: 10.1007/s00018-023-05024-y.
- Wu D, Kanda A, Liu Y, Noda K, Murata M, Ishida S. Involvement of Müller Glial Autoinduction of TGF-β in Diabetic Fibrovascular Proliferation Via Glial-Mesenchymal Transition. Invest Ophthalmol Vis Sci. 2020 Dec 1;61(14):29. doi: 10.1167/iovs.61.14.29.
- Wheeler SE, Lee NY. Emerging roles of transforming growth factor β signaling in diabetic retinopathy. J Cell Physiol. 2017;232(3):486-9. doi: 10.1002/jcp.25506.
- Wang X, Hui Q, Jin Z, Rao F, Jin L, Yu B, et al. Roles of growth factors in eye development and ophthalmic diseases. 2022;51(5):613-25. doi: 10.3724/zdxbyxb-2022-0603.
- Hachana S, Larrivée B. TGF-β superfamily signaling in the eye: implications for ocular pathologies. Cells. 2022;11(15):2336. doi: 10.3390/cells11152336.
- Liu H, Chen YG. The interplay between TGF-β signaling and cell metabolism. Front Cell Dev Biol. 2022;10:846723. doi: 10.3389/fcell.2022.846723.
- Mesquida M, Drawnel F, Fauser S. The role of inflammation in diabetic eye disease. Semin Immunopathol. 2019;41(4):427-45. doi: 10.1007/s00281-019-00750-7.
- Mason RH, Minaker SA, Luna GL, Bapat P, Farahvash A, Garg A, et al. Changes in aqueous and vitreous inflammatory cytokine levels in nonproliferative diabetic retinopathy: a systematic review and meta-analysis. Can J. ophthalmol. 2025 Feb;60(1):e100-e116. doi: 10.1016/j.jcjo.2024.05.031.
- Zhou D, Mou X, Liu K, Liu W, Xu Y, Zhou D. Association Between Transforming Growth Factor-β1 T869C Gene Polymorphism and Diabetic Nephropathy: A Meta-Analysis in the Chinese Population. Clin Lab. 2019 Jul 1;65(7). doi: 10.7754/Clin.Lab.2019.181238.
- Rodrigues KF, Pietrani NT, Sandrim VC, et al. Association of a Large Panel of Cytokine Gene Polymorphisms with Complications and Comorbidities in Type 2 Diabetes Patients. J Diabetes Res. 2015;2015:605965. doi: 10.1155/2015/605965.
- Paine SK, Basu A, Mondal LK, et al. Association of vascular endothelial growth factor, transforming growth factor beta, and interferon gamma gene polymorphisms with proliferative diabetic retinopathy in patients with type 2 diabetes. Mol Vis. 2012;18:2749-57. PMID: 23213275; PMCID: PMC3513186.
- Order of the Ministry of Health of Ukraine of 21.12.2012 № 1118 “On the approval and implementation of medical and technological documents on the standardization of medical care for type 2 diabetes mellitus” Verkhovna Rada of Ukraine. [in Ukrainian]. Available on: https://zakon.rada.gov.ua/rada/show/v1118282-12#Text.
- Gur’yanov VG, Lyakh YuE, Parii VD, Korotky OV, Chalyy OV, Chalyy KO, Tsekhmister YaV. Handbook of biostatistics. Analysis of the results of medical research in the EZR (R-statistics) package. Kyiv: Vistka. 2018. 208 p. [Ukrainain]
- Madsen H, Thyregod P. Introduction to General and Generalized Linear Models. Publisher: Chapman & Hall/CRC, 2011. doi: 10.1201/9781439891148.
- Hudz AS, Kudryl IV. Role of growth factors (transforming growth factor β1 and connective tissue growth factor) in the progression of diabetic retinopathy. Archive of Ukrainian Ophthalmology. 2024;12(3):143-148. doi: 10.22141/2309-8147.12.3.2024.384. [Ukrainian]
- Hudz AS, Sergiienko VO, Kudryl IV, Mogilevskyy SIu, Gulida AO, Ziablitsev SV. Relationship of rs1800470 polymorphism of TGFB1 gene with diabetic retinopathy in type 2 diabetes. Journal of Ophthalmology (Ukraine). 2025;(523):3-8. https://doi.org/10.31288/oftalmolzh2025238.
- Gujarati DN, Porter DC. Basic Econometrics. 5th Edition, McGraw-Hill Irwin, 2009. 922 p.
- Chung WK, Erion K, Florez JC, at al. Precision medicine in diabetes: a Consensus Report from the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia. 2020 Sep;63(9):1671-1693. doi: 10.1007/s00125-020-05181-w.
- Schiborn C, Schulze MB. Precision prognostics for the development of complications in diabetes. Diabetologia. 2022 Nov;65(11):1867-1882. doi: 10.1007/s00125-022-05731-4.
- Al Zabadi H, Taha I, Zagha R. Clinical and Molecular Characteristics of Diabetic Retinopathy and Its Severity Complications among Diabetic Patients: A Multicenter Cross-Sectional Study. J Clin Med. 2022 Jul 7;11(14):3945. doi: 10.3390/jcm11143945.
- Mogilevskyy SIu, Bushuieva OV. Predicting the development of diabetic retinopathy based on identification of rs759853 and rs9640883 in the AKR1B1 gene. J. ophthalmol. (Ukraine). 2017;4:3-8. https://doi.org/10.31288/oftalmolzh2017438.
- Hudz AS, Zakharevich GE, Petrenko OV, Lunova HH. Diabetic retinopathy development and progressing prediction in diabetes mellitus type 2. Archive of Ukrainian Ophthalmology. 2018;6(1):23-30. https://doi.org/10.22141/2309-8147.6.1.2018.172266. [Ukrainian]
- Mogilevskyy SIu, Serdiuk AV, Ziablitsev SV. Prognostic biomarkers of non-proliferative diabetic retinopathy progression in type 2 diabetes mellitus. Oftalmologicheskii Zhurnal. 2024;4:38-45. doi: 10.31288/oftalmolzh202443845.
- Tzavlaki K, Moustakas A. TGF-β signaling. Biomolecules. 2020;10(3):487. doi: 10.3390/biom10030487.
- Chen PY, Qin L, Simons M. TGFβ signaling pathways in human health and disease. Front. Mol. Biosci. 2023;10. doi.org/10.3389/fmolb.2023.1113061.
- Callan A, Jha S, Valdez L, Baldado L, Tsin A. TGF-β signa–ling pathways in the development of diabetic retinopathy. International Journal of Molecular Sciences. 2024;25(5):3052. doi.org/10.3390/ijms25053052.
- Bonfiglio V, Platania CBM, Lazzara F, et al. TGF-β Serum Levels in Diabetic Retinopathy Patients and the Role of Anti-VEGF Therapy. Int J Mol Sci. 2020 Dec 15;21(24):9558. doi: 10.3390/ijms21249558.
- Wang Z, Zhang N, Lin P, Xing Y, Yang N. Recent advances in the treatment and delivery system of diabetic retinopathy. Front Endocrinol (Lausanne). 2024 Feb 15;15:1347864. doi: 10.3389/fendo.2024.1347864.
- Striglia E, Caccioppo A, Castellino N, Reibaldi M, Porta M. Emerging drugs for the treatment of diabetic retino–pathy. Expert Opin Emerg Drugs. 2020 Sep;25(3):261-271. doi: 10.1080/14728214.2020.1801631.
- Early Treatment Diabetic Retinopathy Study Research Group. Grading Diabetic Retinopathy from Stereoscopic Color Fundus Photographs — An Extension of the Modified Airlie House Classification: ETDRS Report Number 10. Ophthalmology. 2020;127(4S):99-119. doi: 10.1016/j.ophtha.2020.01.030.