Архив офтальмологии Украины Том 12, №1, 2024
Вернуться к номеру
Порівняльний аналіз волюмометричних характеристик м’якотканинного вмісту орбіти у пацієнтів з ендокринною орбітопатією методами комп’ютерного моделювання
Авторы: Слободянюк А.С., Прусак О.І.
Інститут післядипломної освіти, Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
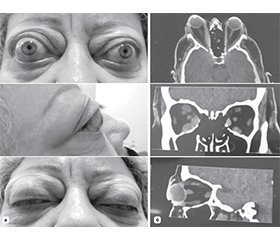
Актуальність. За даними літератури, збільшення об’єму м’яких тканин за очним яблуком через збільшення об’єму екстраокулярних м’язів (ЕОМ) та/або орбітальної жирової клітковини є причиною екзофтальму, обмеження рухливості очей, двоїння та в окремих випадках може призвести до оптичної нейропатії, яка є тяжким ускладненням ендокринної орбітопатії (ЕО). Таким чином, оптимізація діагностики ендокринної орбітопатії, зокрема в аспекті оцінки різних її форм та вибору методу декомпресії орбіти як основного методу лікування, є актуальною міждисциплінарною проблемою. Мета. Провести порівняльний аналіз загального об’єму м’якотканинного вмісту орбіти та окремих об’ємів екстраокулярних м’язів, жирової клітковини орбіти та зорового нерва методом комп’ютерного моделювання у пацієнтів з ендокринною орбітопатією та без орбітальної патології. Матеріали та методи. У цьому ретроспективному когортному дослідженні проаналізовано дані комп’ютерної томографії 114 пацієнтів з ендокринною орбітопатією та без орбітальної патології, яких було поділено на 2 групи. Об’єми м’якотканинного вмісту орбіти було розраховано в програмному забезпеченні Mimics Medical 23.0 (Materialise, Бельгія). Отримані дані оцінювали методами змінної статистики з використанням критерію Шапіро — Вілка та критерію Манна — Вітні для незалежних вибірок. Результати. Середній об’єм орбіти в основній групі становив 26 196,39 ± 3117,50 мм3, а в контрольній — 26 980,49 ± 3765,82 мм3 і вірогідно не відрізнявся (р = 0,1283). Середній об’єм екстраокулярних м’язів в основній групі 7650,77 ± 3047,96 мм3, а в групі контролю — 2871,73 ± 644,99 мм3 (р = 0,0001). Середній об’єм жирової клітковини орбіти в основній групі дорівнював 17 956,38 ± 3273,53 мм3, а в контрольній групі — 23 695,76 ± 3791,63 (р = 0,0001). Висновки. Дослідження показало відсутність кореляції в об’ємі орбіти і наявність її між об’ємом екстраокулярних м’язів та жирової клітковини орбіти у пацієнтів з ЕО та в контрольній групі. Співвідношення середнього об’єму жирової клітковини та середнього об’єму ЕОМ в основній групі становило 2,79 : 1, а в групі контролю 8,73 : 1. Цей показник є важливим аргументом при прийнятті рішення щодо вибору методу декомпресії орбіти — при переважаючому збільшенні середнього об’єму ЕОМ показана кісткова декомпресія орбіти, при переважаючому збільшенні середнього об’єму жирової клітковини — жирова декомпресія орбіти, а при рівномірному збільшенні середнього об’єму ЕОМ та середнього об’єму жирової клітковини оптимальним буде проведення комбінованої декомпресії орбіти. Використання такого підходу може стати перспективним методом у диференційній діагностиці ЕО, зокрема в аспекті оцінки різних її форм та при плануванні декомпресії орбіти як основного методу її лікування.
Background. According to the literature, an increase in the volume of soft tissues behind the eyeball due to an increase in the volume of the extraocular muscles (EOM) and/or orbital adipose tissue is the cause of exophthalmos, limited eye movement, diplopia, and in some cases can lead to optic neuropathy, which is a severe complication of endocrine orbitopathy. Thus, the optimization of the diagnosis of endocrine orbitopathy, in particular in the aspect of evaluating its various forms and choosing the method of orbital decompression as the main method of treatment, is an urgent interdisciplinary problem. The purpose of the work is to conduct a comparative analysis of the total volume of soft tissue contents of the orbit and individual volumes of extraocular muscles, orbital adipose tissue, and optic nerve by computer modeling in patients with endocrine orbitopathy and without orbital pathology. Materials and methods. Іn this retrospective cohort study, computed tomography data of 114 patients with and without endocrine orbitopathy, who were divided into 2 groups, were analyzed. Orbital soft tissue volumes were calculated in Mimics Medical 23.0 software (Materialise, Belgium). The obtained data were evaluated by methods of variable statistics using the Shapiro-Wilk test and the Mann-Whitney test for independent samples. Results. The average volume of the orbit in the main group was 26,196.39 ± 3,117.50 mm3, in the control group — 26,980.49 ± 3,765.82 mm3 and did not differ significantly (р = 0.405). The average volume of extraocular muscles in the main group is 7,650.77 ± 3,047.96 mm3, and in the control group — 2,871.73 ± 644.99 mm3 (р = 0.0001). The average volume of the orbital adipose tissue in the main group was equal to 17,956.38 ± 3,273.53 mm3, and in the control group — 23,695.76 ± 3,791.63 (р = 0.0001). Conclusions. The study showed the absence of correlation in the volume of the orbit, and its presence between the volume of extraocular muscles and orbital adipose tissue in patients with endocrine orbitopathy and in the control group. The ratio of the average volume of adipose tissue to the average volume of the EOM in the main group was 2.79 : 1, and in the control group, 8.73 : 1. This indicator is an important argument when deciding on the method of orbital decompression — with a predominant increase in the average volume of the EOM, bony orbital decompression is indicated, with a predominant increase in the average volume of adipose tissue — fat orbital decompression, and with a uniform increase in the average volume of the EOM and the average volume of adipose tissue, combined orbital decompression will be optimal. The use of this approach can become a promising method in the differential diagnosis of endocrine orbitopathy, in particular in the aspect of evaluating its various forms and when planning orbital decompression as the main method of its treatment.
ендокринна орбітопатія (офтальмопатія); орбіта; екстраокулярні м’язи; орбітальна жирова клітковина; оптична нейропатія; комп’ютерне моделювання; персоналізоване лікування; щитоподібна залоза; хвороба Грейвса
endocrine orbitopathy (ophthalmopathy); orbit; extraocular muscles; orbital adipose tissue; optic neuropathy; computer modeling; personalized treatment; thyroid; Graves’ disease
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Kahaly et al. 2018 European Thyroid Association Guideline for the Management of Graves’ Hyperthyroidism. Eur Thyroid J. 2018;7:167-186. https://doi.org/10.1159/000490384.
- Bartalena L, Baldeschi L, Boboridis K, Eckstein A, Kahaly GJ, Marcocci C, et al. The 2016 European Thyroid Association/European Group on Graves’ Orbitopathy guidelines for the management of Graves’ orbitopathy. Eur Thyroid J. 2016 Mar;5(1):9-26. doi: 10.1159/000443828.
- Tsui S, Naik V, Hoa N, et al. Evidence for an association between thyroid-stimulating hormone and insulin-like growth factor 1 receptors: a tale of two antigens implicated in Graves’ disease. J Immunol. 2008;181:4397-4405.
- Smith TJ, Janssen JAMJL. Insulin-like growth factor-I receptor and thyroid-associated ophthalmopathy. Endocr Rev. 2019;40:236-267.
- Smith, Terry J., Neil Hoa. Immunoglobulins from patients with Graves’ disease induce hyaluronan synthesis in their orbital fibroblasts through the self-antigen, insulin-like growth factor-I receptor. The Journal of Clinical Endocrinology & Metabolism. 2004;89.10:5076-5080.
- Forbes G, Gorman CA, Brennan MD, Gehring DG, Ilstrup DM, Earnest F 4th. Ophthalmopathy of Graves’ disease: computerized volume measurements of the orbital fat and muscle. AJNR Am J Neuroradiol. 1986 Jul-Aug;7(4):651-6. PMID: 3088943; PMCID: PMC8334661.
- Rubin PA, Watkins LM, Rumelt S, Sutula FC, Dallow RL. Orbital computed tomographic characteristics of globe subluxation in thyroid orbitopathy. Ophthalmology. 1998 Nov;105(11):2061-4. doi: 10.1016/S0161-6420(98)91125-3. PMID: 9818606.
- Garrity JA, Bahn RS. Pathogenesis of graves ophthalmopathy: implications for prediction, prevention, and treatment. Am J Ophthalmol. 2006 Jul;142(1):147-153. doi: 10.1016/j.ajo.2006.02.047. PMID: 16815265; PMCID: PMC3960010.
- Wiersinga WM, Regensburg NI, Mourits MP. Differential involvement of orbital fat and extraocular muscles in graves’ ophthalmo–pathy. Eur Thyroid J. 2013 Mar;2(1):14-21. doi: 10.1159/000348246. Epub 2013 Feb 26. PMID: 24783034; PMCID: PMC3821503.
- Anderson RL, Tweeten JP, Patrinely JR, Garland PE, Thiese SM. Dysthyroid optic neuropathy without extraocular muscle involvement. Ophthalmic Surg. 1989;20(8):568-74.
- Neigel JM, Rootman J, Belkin RI, Nugent RA, Drance SM, Beattie CW, et al. Dysthyroid optic neuropathy. The crowded orbital apex syndrome. Ophthalmology. 1988;95(11):1515-21.
- Goncalves AC, Silva LN, Gebrim EM, Monteiro ML. Quantification of Orbital Apex Crowding for Screening of Dysthyroid Optic Neuropathy Using Multidetector CT. AJNR Am J Neuroradiol. 2012.
- Barrett L, Glatt HJ, Burde RM, Gado MH. Optic nerve dysfunction in thyroid eye disease: CT. Radiology. 1988 May;167(2):503-7. doi: 10.1148/radiology.167.2.3357962. PMID: 3357962.
- Wiersinga, Wilmar M., Noortje I. Regensburg, Maarten P. Mourits. Differential involvement of orbital fat and extraocular muscles in Graves’ ophthalmopathy. European thyroid journal. 2013;2.1:14-21.
- Noortje I. Regensburg, Pauline H.B. Kok, Frans W. Zonneveld, Lelio Baldeschi, Peerooz Saeed, Wilmar M. Wiersinga, Maarten P. Mourits. A New and Validated CT-Based Method for the Calculation of Orbital Soft Tissue Volumes. Invest. Ophthalmol. Vis. Sci. 2008;49(5):1758-1762. https://doi.org/10.1167/iovs.07-1030.
- Paniagua L, Bande MF, Abalo-Lojo JM, Gonzalez F. Computer aided volumetric assessment of orbital structures in patients with Graves’ orbitopathy: correlation with serum thyroid antiperoxidase antibodies and disease activity. Int Ophthalmol. 2023 Sep;43(9):3377-3384. doi: 10.1007/s10792-023-02745-8. Epub 2023 Jun 20. PMID: 37338774; PMCID: PMC10400667.
- Comerci M, Elefante A, Strianese D, Senese R, Bonavolontà P, Alfano B, Bonavolontà B, Brunetti A. Semiautomatic regional segmentation to measure orbital fat volumes in thyroid-associated ophthalmo–pathy. A validation study. Neuroradiol J. 2013 Aug;26(4):373-9. doi: 10.1177/197140091302600402. Epub 2013 Aug 27. PMID: 24007725; PMCID: PMC4202813.
- Regensburg NI, Wiersinga WM, Berendschot TT, Potgieser P, Mourits MP. Do subtypes of graves’ orbitopathy exist? Ophthalmology. 2011 Jan;118(1):191-6. doi: 10.1016/j.ophtha.2010.04.004. Epub 2010 Jul 29. PMID: 20673587.