Архив офтальмологии Украины Том 11, №2, 2023
Вернуться к номеру
Зв’язок розвитку макулярного набряку при діабетичній ретинопатії і цукровому діабеті 2-го типу з вмістом у крові Р-селектину
Авторы: Риков С.О., Чугаєв Д.І.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
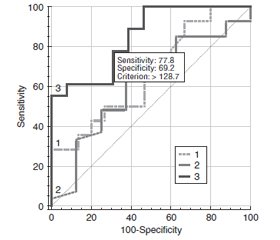
Актуальність. При діабетичній ретинопатії (ДР), що ускладнена діабетичним макулярним набряком (ДМН) за умов цукрового діабету 2-го типу (ЦД2), встановлено важливе значення запальних і протромбогенних змін, серед яких найбільше значення мають посилення експресії молекул ендотеліальної адгезії, у тому числі P-селектину. Мета дослідження: встановити зв’язок розвитку ДМН при ДР різного ступеня та ЦД2 з вмістом у крові Р-селектину. Матеріали та методи. Дослідження включало 124 пацієнти (124 ока) із ЦД 2-го типу, у яких за класифікацією ETDRS виявлена легка (29 очей, 1-ша група), помірна або тяжка (35 очей, 2-га група) непроліферативна ДР та проліферативна ДР (31 око, 3-тя група); контрольну групу становили 29 очей без ЦД. Всім пацієнтам були виконані загальноприйняті офтальмологічні дослідження, спектрально-доменна оптична когерентна томографія (ОКТ) з визначенням центральної товщини сітківки (ЦТС, мкм). ДМН встановлювали при збільшенні ЦТС вище від значень нормативної бази даних по полях ETDRS програмного забезпечення спектрально-доменної ОКT. Вміст Р-селектину у крові визначали імуноферментним методом (Invitrogen ThermoFisher Scientific, USA). Для статистичних досліджень використано програмні пакети MedStat і MedCalc v.15.1 (MedCalc Software bvba). Результати. Вміст у крові Р-селектину при ДР та ЦД2 був вірогідно збільшеним порівняно з контролем (у 1,3 раза; p < 0,001), що при розподілі за стадіями зберігалося тільки для проліферативної ДР. Збільшення вмісту Р-селектину прямо корелювало з рівнем глікованого гемоглобіну та ЦТС. Тільки у пацієнтів з проліферативною ДР вміст Р-селектину за наявності ДМН був вищим, ніж без такого (у 1,2 раза; p < 0,001). При непроліферативній ДР вміст Р-селектину за наявності або відсутності ДМН не відрізнявся. Зв’язок збільшення вмісту Р-селектину з розвитком ДМН було підтверджено у регресійному аналізі (ВШ = 1,02; 95% ВІ 1,01–1,03). ROC-аналіз показав, що ця модель мала задовільні критерії тільки при проліферативній ДР (AUC = 0,85; 95% ВІ 0,68–0,95), що дозволило розрахувати межовий рівень прогнозу, який дорівнював 128,7 нг/мл (чутливість тесту 77,8 % і специфічність 69,2 %). Висновки. Результати дослідження підтвердили зв’язок між збільшенням у крові Р-селектину та розвитком ДМН при проліферативній ДР.
Background. In diabetic retinopathy (DR) complicated by diabetic macular edema (DME) in type 2 diabetes mellitus (T2DM), the importance of inflammatory and prothrombogenic changes has been identified, among which increased expression of endothelial adhesion molecules, including P-selectin, is the most significant one. The purpose: to specify the relationship of DME in DR of various degrees and T2DM with the content of P-selectin in the blood. Materials and methods. The study included 124 patients (124 eyes) with T2DM who had mild (29 eyes, group 1), moderate or severe (35 eyes, group 2) non-proliferative DR and proliferative DR (31 eyes, group 3); the control group consisted of 29 eyes without diabetes. All patients underwent standard ophthalmological examinations, spectral domain optical coherence tomography with determination of central retinal thickness (CRT, μm). DME was detected at CRT greater than the values of the normative database on the ETDRS fields of the spectral domain optical coherence tomography software. The content of P-selectin in the blood was determined by the immunoenzymatic method (Invitrogen Thermo Fisher Scientific, USA). MedStat and MedCalc v.15.1 software packages (MedCalc Software bvba) were used for statistical research. Results. The blood content of P-selectin in DR and T2DM was significantly increased compared to the controls (by 1.3 times; p < 0.001), which was preserved only for proliferative DR when divided by stages. An increase in the content of P-selectin directly correlated with the level of glycated hemoglobin and CRT. Only in patients with proliferative DR, P-selectin was higher in the presence of DME than that without it (by 1.2 times; p < 0.001). In non-proliferative DR, the content of P-selectin did not differ depending on the presence or absence of DME. The relationship between increased P-selectin content and the development of DME was confirmed in regression analysis (OR = 1.02; 95% CI 1.01–1.03). ROC analysis showed that this model had satisfactory criteria only in proliferative DR (AUC = 0.85; 95% CI 0.68–0.95), which allowed to calculate a threshold prediction level that was equal to 128.7 ng/ml (sensitivity of the test is 77.8 % and specificity is 69.2 %). Conclusions. The results of the study confirmed the connection between increased blood P-selectin and the development of DME in proliferative DR.
Р-селектин; проліферативна діабетична ретинопатія; регресія; прогноз
P-selectin; proliferative diabetic retinopathy; regression; prognosis
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Ogurtsova K., da Rocha Fernandes J.D., Huang Y., Linnenkamp U., Guariguata L., Cho N.H., et al. IDF Diabetes Atlas: Global estimates for the prevalence of diabetes for 2015 and 2040. Diabetes Res. Clin. Pract. 2017 Jun. 128. 40-50. http://doi.org/10.1016/j.diabres.2017.03.024.
- Saeedi P., Petersohn I., Salpea P., Malanda B., Karuranga S., Unwin N., et al.; IDF Diabetes Atlas Committee. Global and regional diabetes prevalence estimates for 2019 and projections for 2030 and 2045: Results from the International Diabetes Federation Diabetes Atlas, 9th edition. Diabetes Res. Clin. Pract. 2019 Nov. 157. 107843. http://doi.org/10.1016/j.diabres.2019.107843.
- DeFronzo R.A., Ferrannini E., Groop L., Henry R.R., Herman W.H., Holst J.J., et al. Type 2 diabetes mellitus. Nat. Rev. Dis. Primers. 2015 Jul 23. 1. 15019. http://doi.org/10.1038/nrdp.2015.19.
- Wong T.Y., Sabanayagam C. Strategies to tackle the glo–bal burden of diabetic retinopathy: from epidemiology to artificial intelligence. Ophthalmologica. 2020. 243(1). 9-20. http://doi.org/10.1159/000502387.
- Teo Z.L., Tham Y.C., Yu M., Chee M.L., Rim T.H., Cheung N., et al. Global prevalence of diabetic retinopathy and Projection of Burden through 2045: systematic review and meta-ana–lysis. Ophthalmology. 2021 Nov. 128(11). 1580-1591. http://doi.org/10.1016/j.ophtha.2021.04.027.
- Sun H., Saeedi P., Karuranga S., Pinkepank M., Ogurtsova K., Duncan B.B., et al. IDF Diabetes Atlas: Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045. Diabetes Res. Clin. Pract. 2022 Jan. 183. 109119. http://doi.org/10.1016/j.diabres.2021.109119.
- Rossino M.G., Dal Monte M., Casini G. Relationships between neurodegeneration and vascular damage in diabetic retinopathy. Front. Neurosci. 2019 Nov 8. 13. 1172. http://doi.org/10.3389/fnins.2019.01172.
- Mogilevskyy S.Iu., Panchenko Iu.O., Ziablytsev S.V. Predicting the risk of diabetic retinopathy-assosiated macular edema in patients with type 2 diabetes mellitus. Journal of Ophthalmology (Ukraine). 2019. 3(488). 3-8. http://doi.org/10.31288/oftalmolzh2019338.
- Lin K.Y., Hsih W.H., Lin Y.B., Wen C.Y., Chang T.J. Update in the epidemiology, risk factors, screening, and treatment of diabetic retinopathy. J. Diabetes Investig. 2021 Aug. 12(8). 1322-1325. http://doi.org/10.1111/jdi.13480.
- Mogilevskyy S.Yu., Panchenko Iu.O., Ziablitsev S.V. New risk factors for post-surgical recurrent diabetic maculopathy in type 2 diabetes mellitus. J. Оphthalmol. (Ukraine). 2019. 5. 9-17. http://doi.org/10.31288/oftalmolzh20195917.
- Rangasamy S., McGuire P.G., Das A. Diabetic retinopathy and inflammation: novel therapeutic targets. Middle East Afr. J. Ophthalmol. 2012 Jan. 19(1). 52-9. http://doi.org/10.4103/0974-9233.92116.
- Nomura S., Omoto S., Yokoi T., Fujita S., Ozasa R., Eguchi N., Shouzu A. Effects of miglitol in platelet-derived microparticle, adiponectin, and selectin level in patients with type 2 diabetes mellitus. Int. J. Gen. Med. 2011. 4. 539-45. http://doi.org/10.2147/IJGM.S22115.
- Cappenberg A., Kardell M., Zarbock A. Selectin-Mediated Signaling-Shedding Light on the Regulation of Integrin Activity in Neutrophils. Cells. 2022 Apr 12. 11(8). 1310. http://doi.org/10.3390/cells11081310.
- Kutlar A., Embury S.H. Cellular adhesion and the endothelium: P-selectin. Hematol. Oncol. Clin. North Am. 2014 Apr. 28(2). 323-39. http://doi.org/10.1016/j.hoc.2013.11.007.
- Liu Z., Miner J.J., Yago T., Yao L., Lupu F., Xia L., Mc–Ever R.P. Differential regulation of human and murine P-selectin expression and function in vivo. J. Exp. Med. 2010 Dec 20. 207(13). 2975-87. http://doi.org/10.1084/jem.20101545.
- Ogata N., Nomura S., Shouzu A., Imaizumi M., Arichi M., Matsumura M. Elevation of monocyte-derived microparticles in patients with diabetic retinopathy. Diabetes Res. Clin. Pract. 2006 Sep. 73(3). 241-8. http://doi.org/10.1016/j.diabres.2006.01.014.
- Early Treatment Diabetic Retinopathy Study Research Group. Grading diabetic retinopathy from stereoscopic color fundus photographs — an extension of the modified Airlie house classification: ETDRS report № 10. Ophthalmology. 2020 Apr. 127(4S). 99-119. http://doi.org/10.1016/j.ophtha.2020.01.030.
- Guryanov V.G., Lyakh Yu.E., Pariy V.D., Korotkyi O.V., Chalyi O.V., Chalyi K.O., Tsekhmister Ya.V. Posibnyk z biostatystyky. Analiz rezul’tativ medychnykh doslidzhen’ u paketi EZR (R–statistics) [Handbook of Biostatistics. Analysis of the results of medical research in the package EZR (R-statistics)]. Kyiv: News, 2018. 208. (Ukrainian).
- Dan-Brezis I., Zahavi A., Axer-Siegel R., Nisgav Y., Dah–bash M., Weinberger D., et al. Inflammation, angiogenesis and coagulation interplay in a variety of retinal diseases. Acta Ophthalmol. 2020 Aug. 98(5). e559-e562. http://doi.org/10.1111/aos.14331.
- Limb G.A., Chignell A.H., Green W., LeRoy F., Dumon–de D.C. Distribution of TNF alpha and its reactive vascular adhesion molecules in fibrovascular membranes of proliferative diabetic retinopathy. Br. J. Ophthalmol. 1996 Feb. 80(2). 168-73. http://doi.org/10.1136/bjo.80.2.168.
- Bavbek N., Kargili A., Kaftan O., Karakurt F., Kosar A., Akcay A. Elevated concentrations of soluble adhesion molecules and large platelets in diabetic patients: are they markers of vascular disease and diabetic nephropathy? Clin. Appl. Thromb. Hemost. 2007 Oct. 13(4). 391-7. http://doi.org/10.1177/1076029607303615.
- Siddiqui K., George T.P., Nawaz S.S., Joy S.S. VCAM-1, ICAM-1 and selectins in gestational diabetes mellitus and the risk for vascular disorders. Future Cardiol. 2019 Sep. 15(5). 339-346. http://doi.org/10.2217/fca-2018-0042.
- Penman A., Hoadley S., Wilson J.G., Taylor H.A., Chen C.J., Sobrin L. P-selectin Plasma Levels and Genetic Variant Associated with Diabetic Retinopathy in African Americans. Am. J. Ophthalmol. 2015 Jun. 159(6). 1152-1160.e2. http://doi.org/10.1016/j.ajo.2015.03.008.