Кома — це найбільш значний ступінь патологічного гальмування центральної нервової системи, що характеризується глибокою втратою свідомості, відсутністю рефлексів на зовнішні подразники і розладом регуляції життєво важливих функцій організму [1]. Найчастіше причинами коми є гострі порушення мозкового кровообігу і травматичні ураження головного мозку.
Пошкодження мозку травматичного і нетравматичного (судинного) походження мають високі показники смертності та інвалідизації, перш за все серед осіб працездатного віку, що обумовлює актуальність цієї проблеми. Згідно з даними епідеміологічних досліджень, поширеність інсультів у світі становить від 150 до 200 на 100 тис. населення, причому останніми роками зазначений показник має тенденцію до зростання [2, 3]. Така ж невтішна ситуація і в нашій країні: щорічно в Україні реєструють близько 100–110 тис. інсультів [4]. Після інсульту більше ніж половина пацієнтів залишаються фізично залежними [5], приблизно дві третини мають залишковий неврологічний дефіцит, 22 % — когнітивні порушення через п’ять років після судинної катастрофи [6, 7].
Черепно-мозкова травма (ЧМТ) також є найпоширенішою причиною смерті та інвалідності в усьому світі, з великими прямими й непрямими витратами на лікування. У США від ЧМТ страждають приблизно 3,3–5,3 млн осіб на рік, а щорічні прямі витрати оцінюються в 9,2 млрд доларів. Ще 51,2 млрд доларів втрачені через пропущену роботу і зниження працездатності [9–11]. При тяжкій ЧМТ летальність дорослого населення становить 45 %, серед тих, хто вижив, неврологічні наслідки спостерігаються у 60–90 % хворих протягом 1 року [8].
Враховуючи це, Національний інститут неврологічних розладів та інсульту США нещодавно визначив раннє відновлення після інсульту як пріоритетний напрямок, який дозволить поліпшити прогноз захворювання [12]. Однак зусилля щодо забезпечення ранньої реабілітації після гострого інсульту можуть бути скомпрометовані різними станами, включно з апатією та гіперсомнією, які можуть виникнути в 35 і 18 % пацієнтів відповідно [13, 14]. Порушення свідомості після інсульту виникають унаслідок пошкодження багатьох різних структур, включно з двостороннім ураженням кори головного мозку, покришки мосту, середнього мозку, базальних відділів переднього мозку, гіпоталамуса, центрального таламуса, лушпини, хвостатого ядра і палідуму [15]. Щоб обійти ці порушення і розширити участь пацієнтів у ранній реабілітації, необхідні нові медикаментозні стратегії.
Ці дані значною мірою можуть бути екстрапольовані на пацієнтів із черепно-мозковою травмою [16]. В оновлених рекомендаціях Фонду мозкових травм [17] також робиться акцент на необхідності відновлення свідомості хворих із ЧМТ, що поліпшує період ранньої реабілітації пацієнтів. Крім того, рекомендується використання нових терапевтичних засобів, які здатні запобігти вторинному пошкодженню мозку і поліпшити результати після ЧМТ.
На сьогодні з цією метою застосовується амантадин (АМТ), який є нейростимулятором, здатним поліпшувати або прискорювати когнітивне і функціональне відновлення після інсульту та ЧМТ [16, 17].
Патогенетичні ланки нейронального пошкодження при інсульті та ЧМТ
Після первинного пошкодження головного мозку внаслідок ЧМТ або інсульту виникають патофізіологічні зміни, які призводять до вторинних (відстрочених) пошкоджень. При цьому численними дослідженнями доведено, що загальні клітинні і тканинні реакції головного мозку при травмі й інсульті виглядають ідентично з точки зору патогенетичних механізмів [18].
У відповідь на ішемічне пошкодження мозку розвивається нейронально-гліальна деструкція, яка перебігає за законами гострого запалення і має адаптаційно-пристосувальний характер. При цьому важливу роль відіграє нейротрансмітерний дисбаланс [19]. У відповідь на травматичне або судинне пошкодження підвищується активність глутаматергічних нейронів, збільшується вивільнення збудливої амінокислоти глутамату і, як наслідок, посилюється її шкідлива дія на клітину. У міру виснаження адаптаційних можливостей розвиваються ацидоз, іонний дисбаланс, зростає концентрація збуджуючих амінокислот (у тому числі глутамату), утворюються вільні радикали. Окиснювальні радикали сприяють вивільненню цитокінів, а також вивільненню пресинаптичними нервовими закінченнями надлишкової кількості глутамату, який чинить цитотоксичну дію (феномен глутаматної ексайтотоксичності). Агресивні метаболіти кисню і продукти перекисного окиснення ліпідів потенціюють нейротоксичний ефект глутамату. Отже, нейрони і глія стають об’єктом впливу каскаду нейродеструктивних процесів, що викликають порушення їх структурно-функціональної цілісності. Ключову роль у каскаді клітинного пошкодження відіграє внутрішньоклітинне підвищення вмісту іонів кальцію і натрію [19, 20].
Збудлива дія глутамату опосередковується через рецептори N-метил-D-аспартату (NMDA-рецептори). Інтенсивне пошкодження клітин, яке спостерігається при ЧМТ та інсульті, призводить до набухання нейронів і їх лізису (некрозу) внаслідок масивної стимуляції NMDA-рецепторів [21]. У пошкодженні нейронів, обумовленому NMDA-рецепторами, виділяють два компоненти: швидкий натрійзалежний компонент, що приводить до негайного набряку клітини, і повільний кальційзалежний компонент, що обумовлює відстрочену деструкцію клітини. В умовах низької інтенсивності активації NMDA-рецепторів кальційзалежний компонент превалює [22, 23].
Надмірне накопичення кальцію всередині клітини в ішемізованих нейронах за рахунок зв’язування з внутрішньоклітинним рецептором кальмодуліном викликає активацію клітинних ферментів (протеїнкіназ, ліпаз, нуклеаз), що обумовлюють утворення NO, вільних радикалів, руйнування внутрішньоклітинних білків, фосфоліпідів, нуклеїнових кислот. Комбінація цих патобіохімічних процесів призводить до загибелі нейронів шляхом як некрозу, так і апоптозу (запрограмована загибель) [20].
Також важливу роль, серед безлічі патофізіологічних наслідків ЧМТ і інсульту, відіграють зміни в ендогенному рівні катехоламінів, і передусім у виснаженні резервів дофаміну [24, 25], що клінічно проявляється пригніченням свідомості, брадикінезією, тремором, підвищенням тонусу за пластичним типом. Подальше відновлення свідомості й рухової активності залежить від темпу відновлення концентрації дофаміну.
Усе це пояснює необхідність призначення препаратів, які при травматичному і судинному пошкодженні мозку мають багатопрофільний вплив: чинять нейро-стимулюючу дію, що призводить до підвищення рівня неспання, впливають на патогенетичні ланки розвитку оксидативного стресу, передусім глутаматну ексайтотоксичність, підвищують рівень дофаміну і мають ней-ропротективні властивості.
Амантадину сульфат активно стимулює виділення дофаміну з нейрональних депо, зменшує зворотне захоплення дофаміну і збільшує щільність, а також змінює конфігурацію постсинаптичних дофамінергічних рецепторів. Це, у свою чергу, забезпечує відновлення свідомості і функціональної активності пацієнтів з інсультом і ЧМТ [16, 26, 27].
Амантадин також є блокатором NMDA-глутаматних рецепторів, завдяки чому він перериває наростання викиду глутамату і пригнічує глутаматну ексайтотоксичність, тим самим захищає мозок від вторинного ішемічного пошкодження як при ЧМТ, так і при інсульті. Це поліпшує прогноз захворювання і збільшує реабілітаційний потенціал [28, 29].
Амантадин підвищує рівень глутатіону — потужного антиоксиданту, який захищає нейрони від шкідливого впливу токсичних агентів і вільних радикалів [30]. Він здатний зменшувати активацію мікроглії, індукує експресію гліального нейротрофічного фактора в мікроглії та астроглії, що сприяє виживанню і диференціюванню нейронів [33], інгібує запальну активацію мікроглії шляхом зменшення вироблення запальних цитокінів (інтерферон γ і фактор некрозу пухлини α), що забезпечує захист нейронів від пошкодження [31, 32].
Амантадину сульфат як нейростимулятор у лікуванні пацієнтів із черепно-мозковою травмою та інсультом
У проспективному дослідженні P.S. Ghate [34] взяли участь 50 пацієнтів з підтвердженою статичною або зниженою когнітивною функцією, що виникла через 2 місяці після тяжкої ЧМТ. Усі хворі протягом 4 тижнів отримували амантадин у дозі 200 мг/добу. Оцінку результатів дослідження проводили за допомогою шкали детальної оцінки стану ареактивних пацієнтів (Full Outline of UnResponsiveness, FOUR), зосередженої на визначенні реакції очей, рухової реакції, стовбурових рефлексів і дихального патерну, шкали інвалідності (DRS) і шкали наслідків Глазго (GOS).
Під час дослідження було встановлено, що когнітивні функції пацієнтів з ЧМТ протягом 4-тижневого періоду лікування поступово поліпшувалися, про що свідчила позитивна динаміка за шкалою FOUR, DRS і GOS. Через 2 тижні після відміни терапії амантадином досягнуті результати зберігалися, однак швидкість одужання значно сповільнилася (рис. 1–3).
Лікування добре переносилося, тільки у 8 з 50 учасників дослідження були зафіксовані судоми як побічний ефект прийому амантадину; п’ятьом пацієнтам була потрібна відміна препарату з подальшим лікуванням судом.
Отже, результати дослідження вказують на безпеку й ефективність амантадину у відновленні свідомості, зменшенні інвалідності й усуненні симптомів когнітивної дисфункції в дорослих пацієнтів з тяжкою ЧМТ.
В одноцентровому ретроспективному когортному дослідженні R.M. Hadgu et al. [35], проведеному на базі Університетського медичного центру Нового Орлеана (УМЦНО), вивчався вплив амантадину на пильність пацієнтів із ЧМТ. У дослідження були включені 79 пацієнтів, які в період з серпня 2012 р. по лютий 2018 р. проходили лікування в УМЦНО з первинним діагнозом ЧМТ і отримали хоча б одну дозу амантадину.
Первинною кінцевою точкою була зміна середнього бала за шкалою коми Глазго (ШКГ) через 72 години після застосування амантадину. Вторинною кінцевою точкою — зміна середнього бала за ШКГ при одночасному призначенні амантадину і базисної терапії (протисудомних препаратів, бензодіазепінів/анксіолітиків, седативних засобів, нейролептиків), а також кореляція між зміною середнього бала за ШКГ при лікуванні амантадином і призначенні амантадину і базисної терапії та відсотком участі пацієнтів у сеансах фізіотерапії (ФТ) і трудотерапії (ТТ).
Через 72 години після використання амантадину зміна середнього бала за ШКГ порівняно з вихідним рівнем становила +0,75 ([95% ДІ = = 0,09–1,42], P = 0,027), при призначенні амантадину і базисної терапії — +2,29 (95% ДІ = 1,68–2,90), Р < 0,001). Не було суттєвої кореляції між збільшенням балів за ШКГ і відсотком участі в сеансах ФT/ТT через 72 години і під час базисної терапії — r = –0,15 (P = 0,24) і r = –0,02 (Р = 0,74) відповідно. Відсоток учасників у сеансі ФТ/ТТ через 72 години після початку прийому амантадину становив 61,3 % порівняно з 65,9 % під час комплексного лікування (амантадин + базисна те-рапія).
Отже, спостерігалося статистично значуще збільшення зміни середнього бала за ШКГ через 72 години і при використанні амантадину і базисної терапії, однак вони не корелювали з відсотком участі пацієнтів у ФТ/ТТ.
В експериментальному дослідженні A.A. Okigbo et al. [36] оцінювали ефективність різних доз амантадину при лікуванні ЧМТ. Дорослі щури-самці під анестезією піддавалися кортикальному впливу середнього ступеня тяжкості або стимульованому пошкодженню. Через 24 години після травми всі вони випадковим чином були розподілені для отримання внутрішньочеревних ін’єкцій амантадину (10, 20 або 40 мг/кг 1 раз/день) або фізіологічного розчину (ФР) (1 мл/кг) протягом 19 днів. Моторну і когнітивну функції оцінювали на 1–5-й і 14–19-й дні після ЧМТ.
Було виявлено, що найкращий ефект у відновленні моторної і когнітивної функції забезпечує амантадин у дозі 20 мг/кг, значно перевершуючи як групу контролю, так і групи амантадину в дозі 10 і 40 мг/кг. Це свідчить про те, що при оцінці ефектів фармакотерапії після ЧМТ слід ретельно зважувати дозування, щоб не упустити потенційні переваги препарату (рис. 4–6).
У комплексному огляді літератури J.T. Giacino et al. [38] стосовно діагностики, перебігу, прогнозу й лікування розладів свідомості після тяжкої ЧМТ було виявлено, що амантадин прискорює відновлення свідомості в пацієнтів зі станом мінімальної свідомості (МС), вегетативним станом (ВС) або несприйнятливим неспанням (ННС). Ці результати привели до оновлення практичних рекомендацій Американської академії неврології (AAN).
Згідно з рекомендаціями AAN, пацієнтам з травматичним станом МС, ВС/ННС протягом 4–16 тижнів після травми слід призначати амантадин по 100–200 мг два рази на день для прискорення функціонального відновлення і зниження ступеня інвалідності на ранніх стадіях ЧМТ за умови відсутності медичних протипоказань або інших специфічних ризиків використання (рівень В). Швидше одужання зменшує витрати на охорону здоров’я і мінімізує психосоціальні стресори як у пацієнтів, так і в опікунів.
Міністерство охорони здоров’я Канади щодо фармакологічного лікування порушень, пов’язаних з ЧМТ, рекомендує амантадин як засіб для підвищення пробудження й свідомості, прискорення темпів функціонального відновлення в осіб у стані негативної або мінімальної реакції після ЧМТ [39]. У бразильських рекомендаціях пацієнтам з персистуючим ВС або МС також рекомендується призначення амантадину в перші 4–16 тижнів після ЧМТ для прискорення швидкості функціонального відновлення [40].
Рекомендації щодо клінічної діагностики й ней-ровідновлювального лікування хронічних порушень свідомості (Китай, 2021) свідчать, що амантадин має церебральну нейрогенну протизапальну, антиексайтотоксичну дію та активує селективний неврологічний дофамінергічний шлях [41]. Великі дослідження показали позитивні поведінкові ефекти амантадину в пацієнтів з тривалими порушеннями свідомості, тому він рекомендується як традиційний лікарський засіб у дозі 200 мг двічі на день [41].
У Національному клінічному керівництві Британської асоціації неврологів [42] відзначається, що при тривалих порушеннях свідомості внаслідок ЧМТ єдиний доказ 1-го рівня користі медичного втручання має застосування амантадину. У подвійному сліпому плацебо-контрольованому дослідженні амантадину (100–200 мг на добу), який призначався протягом 4 тижнів пацієнтам, у яких після травми минуло від 4 до 16 тижнів, група лікування показала більш швидке одужання за шкалою оцінки інвалідності. Однак його довгострокові наслідки й переваги поза цим періодом раннього втручання потребують подальшого вивчення.
Ефективність нейростимуляторів амантадину і/або модафінілу в постінсультних пацієнтів вивчалася в ретроспективному когортному дослідженні, проведеному А.М. Leclerc et al. у період з грудня 2012 року по липень 2016 року [16]. Критеріями включення були: вік ≥ 18 років; надходження у відділення інтенсивної терапії з гострим внутрішньомозковим крововиливом (ВМК), ішемічним інсультом (ІІ) або субарахноїдальним крововиливом (САК); отримання протягом 72 год амантадину, модафінілу або обох препаратів. 72-годинне вікно було обрано на підставі спостереження, що пацієнти в цей період часу добре реагують на терапію, а більш короткі інтервали для лікування можуть бути недостатніми для оцінки відповіді.
/43.jpg)
Пацієнтів вважали такими, які відповіли на лікування, якщо вони протягом 9 днів після призначення нейростимуляторів відповідали хоча б двом з трьох критеріїв: збільшення бала за шкалою коми Глазго на ≥ 3 порівняно з вихідним рівнем, поліпшення неспання, задокументоване особами, які здійснювали догляд, клінічне поліпшення, зафіксоване при проведенні фізіотерапії або трудотерапії. Якщо пацієнтам додавали або замінювали нейростимулятор, час цієї зміни враховувався при інтерпретації результатів: на який препарат пацієнт відповів чи не відповів.
Також оцінювалися фактори, які потенційно впливали на ефективність лікування, і небажані явища, пов’язані з отриманням препаратів.
У дослідження було включено 87 пацієнтів, з яких 41 (47 %) мав ВМК, 29 (33 %) — ІІ та 17 (20 %) — САК. Амантадин застосовували в 71 (82 %) пацієнта, модафініл — у 13 (15 %), амантадин/модафініл — у 3 (3 %). Нейростимулятори призначалися в середньому через 7 днів після інсульту (діапазон 1–27 днів) при таких симптомах, як сонливість (77 %), невиконання команд (32 %), невідкривання очей (28 %), і низьких балах за ШКГ (17 %). Початкова доза амантадину і модафінілу в більшості випадків була 100 мг 2 р/день, при призначенні двох препаратів — амантадин 50 мг 2 р/день і модафініл 100 мг 2 р/день.
Серед 79 пацієнтів, включених в аналіз клінічної ефективності, 42 пацієнти відповіли на лікування, з них 34 отримували монотерапію амантадином і 8 отримували амантадин і модафініл. Жоден пацієнт, який отримував монотерапію модафінілом, не реагував на лікування (рис. 7).
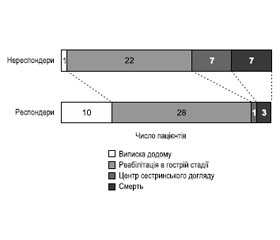
Середній час від початку прийому нейростимуляторів до відповіді на лікування становив 3 дні (діапазон 1–9 днів). Респондери частіше виписувалися додому або для проходження реабілітації порівняно з нереспондерами (90 % проти 62 %, p = 0,006; рис. 8). Із 72 (83 %) пацієнтів, які підлягали виписці з лікарні, прийом нейростимуляторів був припинений у 9 (12 %) пацієнтів до виписки, а 63 (86 %) було рекомендовано продовжити лікування нейростимуляторами.
Під час дослідження було встановлено, що потенційними факторами, які впливають на оцінку клінічної ефективності, є гідроцефалія, підвищення внутрішньочерепного тиску, судоми, церебральний вазоспазм та ішемія, трепанація черепа для евакуації гематоми, прийом супутнього психоактивного препарату (включно із седацією для ШВЛ).
Найбільш частим небажаним ефектом амантадину було порушення сну (16 %), що вимагало зміни режиму його введення або призначення снодійного препарату.
Отже, участь у реабілітаційних заходах під час лікування гострого інсульту в спеціалізованих реабілітаційних закладах є важливим компонентом відновлення після інсульту і є пріоритетною у керівництві щодо інсульту [16]. У даному дослідженні, що включало найбільшу когорту пацієнтів з інсультом, які отримували нейростимулятори під час госпіталізації, було встановлено, що застосування амантадину в перший тиждень після інсульту поліпшує неспання більше ніж у половини хворих. Респондери, які відповіли на лікування, продемонстрували багатообіцяючу тенденцію з більш частою випискою додому або в реабілітаційний центр порівняно з нереспондерами.
Поява гострого респіраторного коронавірусу SARS-CoV-2 спонукала до пошуку нових противірусних агентів і перепрофілювання вже наявних противірусних засобів. Амантадин добре зарекомендував себе при лікуванні нейродегенеративних захворювань, включно з хворобою Паркінсона (ХП), хворобою Альцгеймера, втомою при розсіяному склерозі, неврологічними ускладненнями після інсульту і ЧМТ.
У дослідженні R.F. Butterworth [37], проведеному in vitro та in vivo, було показано, що амантадин, бувши антагоністом рецепторів NMDA, може інгібувати SARS-CoV-2 через пригнічення протеаз клітини-хазяїна, що призводить до порушення вивільнення вірусного геному в клітину. Це, у свою чергу, запобігає розвитку гострого пошкодження легенів і респіраторного дистресу, що характерні для COVID-19.
Випадки, що вказують на профілактичну роль амантадину при COVID-19, були зареєстровані в пацієнтів із хворобою Паркінсона, розсіяним склерозом або тяжкими когнітивними порушеннями, які протягом декількох місяців отримували препарат з приводу основного захворювання, а згодом були інфіковані SARS-CoV-2, підтвердженим полімеразною ланцюговою реакцією.
Висновки
— Найчастіше причинами коми є гострі порушення мозкового кровообігу і травматичні ураження головного мозку, які мають високі показники смертності та інвалідизації пацієнтів.
— Раннє відновлення після інсульту та ЧМТ рекомендоване Національним інститутом неврологічних розладів та інсульту США, а також Фондом мозкових травм. Це пріоритетний напрямок, який дозволяє поліпшити прогноз захворювання. Однак зусилля щодо забезпечення ранньої реабілітації після гострого інсульту і ЧМТ можуть бути скомпрометовані різними станами, включно з порушенням свідомості, апатією, гіперсомнією. Новою стратегією, яка дозволяє розширити участь пацієнтів у ранній реабілітації, є призначення нейростимуляторів. Серед них найбільшу ефективність і безпеку має амантадину сульфат.
— Амантадину сульфат активно стимулює виділення дофаміну з нейрональних депо, зменшує зворотне захоплення дофаміну і збільшує щільність, змінює конфігурацію постсинаптичних дофамінергічних рецепторів. Це, у свою чергу, забезпечує відновлення свідомості й функціональної активності пацієнтів з інсультом і ЧМТ.
— Амантадин також є блокатором NMDA-глутаматних рецепторів, завдяки чому перериває наростання викиду глутамату та пригнічує глутаматну ексайтотоксичність, тим самим захищає мозок від вторинного ішемічного пошкодження як при ЧМТ, так і при інсульті. Це поліпшує прогноз захворювання і збільшує реабілітаційний потенціал.
— У рандомізованих клінічних дослідженнях було доведено, що призначення амантадину пацієнтам з тяжкою ЧМТ та ішемічним інсультом поліпшує показники за шкалою наслідків Глазго, шкалою FOUR і шкалою інвалідності. Використання амантадину приводило до відновлення свідомості, поліпшення когнітивних і моторних функцій і сприяло більш ранній виписці зі стаціонару і початку реабілітації.
— Амантадин може інгібувати SARS-CoV-2 через пригнічення протеаз клітини-хазяїна, що приводить до порушення вивільнення вірусного геному в клітині, що, у свою чергу, запобігає розвитку гострого пошкодження легенів і респіраторного дистресу, характерних для COVID-19.
Список литературы
1. Котуза А.С., Дубиніна В.Г. Кома. Енциклопедія сучасної України. 2014.
2. Зозуля І.С., Цимбалюк В.І., Зозуля А.І. Інсульт: стратегія і тактика надання медичної допомоги. Український медичний часопис. 2012. № 5(91). ІХ-Х.
3. Корнацький В.М., Ревенько І.Л. Соціальні та медичні проблеми цереброваскулярної патології. Укр. кардіол. журн. 2008. 2. 12-18.
4. Сучасні принципи діагностики та лікування хворих із гострим ішемічним інсультом та ТІА: Адаптована клінічна настанова. 2012.
5. Royal College of Physicians. National Sentinel Stroke Clinical Audit 2010. Dublin, Ireland: Intercollegiate Stroke Working Party, 2011.
6. Feigin V.L., Barker-Collo S., Parag V., Senior H., Lawes C.M., Ratnasabapathy Y. et al. Auckland Stroke Outcomes Study. Part 1: Gender, stroke types, ethnicity, and functional outcomes 5 years poststroke. Neurology. 2010. 75(18). 1597-607.
7. Douiri A., Rudd A.G., Wolfe C.D. Prevalence of poststroke cognitive impairment: South London Stroke Register 1995–2010. Stroke. 2013. 44(1). 138-45.
8. Мaas A.I.R., Stocchetti N., Bulloc R. Moderat and severe traumatic brain injury in adults. Lancet Neurol. 2008. 7. 8. 728-741. https://doi.org/10.1016/s1474-4422(08)70164-9.
9. Coronado V.G., Xu L., Basavaraju S.V. et al. Surveillance for traumatic brain injury-related deaths United States, 1997–2007. MMWR Surveil Summ. 2011. 60. 1-32.
10. Faul M., Xu L., Wald M.M. et al. Traumatic brain injury in the United States: emergency department visits, hospitalizations, and deaths. Atlanta: Centers for Disease Control and Prevention, National Center for Injury Prevention and Control, 2010.
11. Hyder A.A., Wunderlich C.A., Puvanachandra P., Gururaj G., Kobusingye O.C. The impact of traumatic brain injuries: a global perspective. Neurorehabilitation. 2007. 22. 341-353.
12. Winstein C.J., Stein J., Arena R., Bates B., Cherney L.R., Cramer S.C., American Heart Association Stroke Council. Council on Cardiovascular and Stroke Nursing. Council on Clinical Cardiology. Council on Quality of Care and Outcomes Research et al. Guidelines for adult stroke rehabilitation and recovery: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2016. 47. e98-e169.
13. van Dalen J.W., Moll van Charante E.P., Nederkoorn P.J., van Gool W.A., Richard E. Poststroke apathy. Stroke. 2013. 44. 851-860.
14. Harris A.L., Elder J., Schiff N.D., Victor J.D., Goldfine A.M. Post-stroke apathy and hypersomnia lead to worse outcomes from acute rehabilitation. Transl. Stroke Res. 2014. 5. 292-300.
15. Rohaut B., Doyle K.W., Reynolds A.S., Igwe K., Couch C., Matory A. et al. Deep structural brain lesions associated with consciousness impairment early after hemorrhagic stroke. Sci. Rep. 2019. 12. 4174.
16. Leclerc А.М., Riker R.R., Brown C.S., May T., Nocella K., Cote J., Eldridge A., Seder D.J. Amantadine and Modafinil as Neurostimulants Following Acute Stroke: A Retrospective Study of Intensive Care Unit Patients. Neurocrit. Care. 2021. 34(1). 102-111.
17. Farrell D., Bendo A.A. Perioperative Management of Severe Traumatic Brain Injury: What Is New? Curr. Anesthesiol. Rep. 2018. 8(3). 279-289.
18. Никонов В.В., Савицкая И.Б. Роль антагонистов глутаматных рецепторов (ПК-Мерц) в лечении повреждений мозга (обзор литреатуры). Медицина неотложных состояний. 2012. № 5(44).
19. Whyte J. et al. Predictors of outcome in prolonged posttraumatic disorders of consciousness and assessment of medication effects: A multicenter study. Arch. Phys. Med. Rehabil. 2005. Vol. 86(3). Р. 453-462.
20. Saver J.L. Time is brain — quantified. Stroke. 2006. Vol. 37. P. 263-266.
21. Lees K.R. Management of acute stroke. Lancet Neurology. 2002. Vol. 1. Р. 41-50.
22. Педаченко Є.Г., Шлапак І.П., Гук А.П., Пилипенко М.М. Черепно-мозкова травма: сучасні принципи невідкладної допомоги. Київ, 2007. 312 с.
23. Blanpied T.A., Clarke R.J., Johnson J.W. Amantadine inhi-bits NMDA receptors by accelerating channel closure during channel block. J. Neurosci. 2005. 25(13). 3312-3322.
24. Giacino J.T., Ashwal S. et al. The minimally conscious state. Definition and diagnostic criteria. Neurology. 2002. 58. 349-335.
25. Patrick P.D. et al. The use of dopamine enhancing medications with children in low response states following brain injury. Brain INJ. 2003. 17. 6. 497-506.
26. Meythaler J.M., Brunner R.C., Johnson A., Novack T.A. Amantadine to improve neurorecovery in traumatic brain injury-associated diffuse axonal injury: a pilot double-blind randomized trial. J. Head Trauma Rehabil. 2002. 17(4). 300-313.
27. Steube D., Gortelmeyer R. The influence of amantadine sulfate on disturbances of arousal after severe traumatic brain injury. Neurologe und Rehabilitation. 2000. 6(6). 307-312.
28. Giacino J.T., Whyte J., Bagiella E., Kalmar K., Childs N., Khademi A. et al. Placebo-controlled trial of amantadine for severe traumatic brain injury. N. Engl. J. Med. 2012. 66(9). 819-826.
29. Culmsee C., Junker V., Kremers W., Thal S., Plesnila N., Krieglstein J. Combination Therapy in Ischemic Stroke: Synergistic Neuroprotective Effects of Memantine and Clenbuterol. Stroke. 2004. 35(5). 1197-1202.
30. Nakano T., Hasegawa T., Suzuki D., Motomura E., Okada M. Amantadine combines astroglial system Xc (–) activation with glutamate/NMDA. Recept. Inhib. Biomol. https://doi. org/10.3390/biom9050191.
31. Kubera M. et al. Inhibitory efects of amantadine on the production of pro-infammatory cytokines by stimulated in vitro human blood. Pharmacol. Rep. 2009. PR 61. 1105-1112.
32. Kim J.H. et al. Microglia-inhibiting activity of Parkinson’s disease drug amantadine. Neurobiol. Aging. 2012. 33. 2145-2159.
33. Ossola B., Schendzielorz N., Chen S.H., Bird G.S., Tuomi-nen R.K., Mannisto P.T., Hong J.S. Amantadine protects dopamine neurons by a dual action: reducing activation of microglia and inducing expression of GDNF in astroglia. Neuropharmacology. 2011. 61. 574-582.
34. Ghate P.S., Bhanage A., Sarkar H., Katkar A. Efficacy of Amantadine in Improving Cognitive Dysfunction in Adults with Severe Traumatic Brain Injury in Indian Population: A Pilot Study. Asian J. Neurosurg. 2018 Jul-Sep. 13(3). 647-650.
35. Hadgu R.M., Borghol A., Gillard C., Wilson C., Elqess Mossa S., McKay M., Jastram C. Jr, Onor I.O. Evaluation of Outcomes in Patients Receiving Amantadine to Improve Alertness After Traumatic Brain Injury. Hosp. Pharm. 2021 Oct. 56(5). 486-494.
36. Okigbo A.A., Helkowski M.S., Royes B.J., Bleimeister I.H., Lam T.R., Bao G.C. et al. Dose-dependent neurorestorative effects of amantadine after cortical impact injury. Neurosci Lett. 2019 Feb 16. 694. 69-73.
37. Butterworth R.F. Adamantanes for the treatment of neurodegenerative diseases in the presence of SARS-CoV-2. Front. Neurosci. 2023 Mar 3. 17. 1128157.
38. Giacino J.T., Katz D.I., Schiff N.D., Ashman E.J., Ashwal S. et al. Practice guideline update recommendations summary: Disorders of consciousness: Report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology; the American Congress of Rehabilitation Medicine; and the National Institute on Disability, Independent Living, and Rehabilitation Research. Neurology. 2018. 91. 450-460.
39. Ontario Neurotrauma Foundation. Clinical Practice Guideline for the rehabilitation of adults with moderate to severe TBI 2017.
40. Anghinah R., Amorim R.L.O., Paiva W.S., Schmidt M.T., Ianof J.N. Traumatic brain injury pharmacological treatment: recommendations. Arq. Neuropsiquiatr. 2018. 76. 100-103.
41. Li Yusheng, He Jianghong, Yang Bing, Zhang Hui, Yang Zhonghua, Fu Jianhui et al. Clinical diagnosis guidelines and neurorestorative treatment for chronic disorders of consciousness (2021 China version). Journal of Neurorestoratology. 2021. Vol. 9. P. 50-59.
43. Prolonged disorders of consciousness following sudden onset brain injury: National clinical guidelines. Royal College of Physicians. 2020.
UA-PKMZ-PUB-092023-024
/43.jpg)

/41.jpg)
/42.jpg)