Протягом останніх десятиліть в усьому світі спостерігається зростання числа побічних ефектів й ускладнень медикаментозної терапії, серед яких більшу частину становлять медикаментозно-індуковані ураження печінки (МІУП). Клінічний досвід лікарів свідчить, що будь-який лікарський засіб, рослинний препарат або біологічно активна добавка (БАД) можуть призвести до МІУП. МІУП є складною клінічною проблемою для лікарів у зв’язку з тим, що спектр клініко-морфологічних варіантів даної патології є надзвичайно різноманітним, а діагноз встановлюється методом виключення інших гострих і хронічних захворювань печінки з подібними симптомами. У той же час МІУП необхідно діагностувати у більш ранні терміни, тому що при тривалому прийомі лікарських препаратів у рази посилюється тяжкість клінічних проявів, що суттєво впливає на прогноз захворювання загалом [1, 2].
Актуальність проблеми МІУП також обумовлена тим, що потенціальне ураження печінки можливе при застосуванні усіх лікарських препаратів при їх введенні в терапевтичних дозах, а клінічний перебіг та наслідки їх застосування можуть бути непередбачуваними. До сьогодні не розроблено чітких принципів терапії МІУП, за винятком відміни лікарського засобу [3]. Крім того, справжня поширеність МІУП недооцінюється. У клінічній практиці даний діагноз установлюється невиправдано рідко. Це можна пояснити як небажанням пацієнта повідомляти про прийом деяких препаратів (антидепресанти, нейролептики та ін.), так і небажанням лікарів документувати ятрогенні захворювання. Відповідно до даних популяційних досліджень, у Франції МІУП було зафіксовано в 0,139 % учасників, в Італії — у 0,041 %, в Іспанії — у 0,03 %, у Швеції — в 0,023 %, у США — в 0,1–1,5 % [4, 5].
Тобто останні епідеміологічні дані не відображають реальної поширеності захворювання, а отримані показники є заниженими. Однак, за даними M.A. Shapiro та співавт. (2007), пошкодження печінки у загальній структурі побічних ефектів від прийому лікарських препаратів становить до 10 % [5]. Спектр гепатотоксичної дії лікарських засобів є надто великим: від субклінічних форм, які спонтанно можуть зникати навіть у разі продовження прийому препарату, до фульмінантного гепатиту, коли єдиним шансом врятувати пацієнта є екстрена трансплантація печінки. У структурі захворювань печінки частота МІУП становить у середньому 5–7 %. МІУП є основною причиною гострого гепатиту в 30 % пацієнтів віком понад 40 років. У 25 % випадків МІУП викликає фульмінантну печінкову недостатність, що потребує трансплантації печінки, а у 10 % може призвести до смерті [6, 7]. У США приблизно 2000 випадків гострої печінкової недостатності реєструються щорічно, із них у понад 50 % випадків причиною є медикаменти (39 % — ацетамінофен (парацетамол), 13 % — реакції ідіосинкразії в результаті дії інших ліків). В Україні МІУП становлять 50 % у загальній структурі гострої жовтяниці, які є основною причиною гострої печінкової недостатності. У загальній структурі побічних ефектів від прийому препаратів гепатотоксичність становить 10 % [8].
За матеріалами Всесвітньої організації охорони здоров’я, 50 із 1000 госпіталізованих у стаціонар хворих направляються на лікування внаслідок медикаментозних ускладнень [9]. Серед амбулаторних пацієнтів їх частота становить 2–3 %, а серед тяжко хворих, які лікуються в стаціонарі, — від 6 до 35 % [4].
Печінка, як найбільший паренхіматозний внутрішній орган, є бар’єром на шляху усіх чужорідних речовин (ксенобіотиків), які надходять до організму людини. Печінка бере участь у метаболізмі всіх поживних речовин, у травленні, синтезі та резервуванні необхідних організму речовин, у розщепленні, детоксикації та екскреції непотрібних або шкідливих речовин, у кровотворенні та здійсненні низки інших функцій і разом з усією гепатобіліарною системою є основною мішенню органотоксичності медикаментів [10, 11].
МІУП — це морфологічні та функціональні зміни печінкової тканини, які виникають внаслідок прямого або опосередкованого ушкодження печінки лікарськими засобами або неправильним їх дозуванням [12].
Найчастіше МІУП виникає внаслідок застосування нестероїдних протизапальних препаратів, гормональних контрацептивів, анаболічних стероїдів, антибактеріальних, системних протигрибкових, протитуберкульозних препаратів, цитостатиків. Сьогодні все більше і більше надходять повідомлення про потенційну гепатотоксичність, пов’язану з нетрадиційною медициною, що використовує рослинні препарати та харчові добавки. У літературі описані випадки розвитку МІУП при застосуванні чистотілу, олександрійського листа, солодки, м’яти болотної, китайських трав Jin Bu Huan і Ma-Huang, китайських, індійських, тайських препаратів рослинного походження для зниження маси тіла та «очищення» організму [13].
Найвищий рівень доказів щодо гепатотоксичності мають препарати самосилу гайового, м’яти болотної, чистотілу, кава-кава, клопогону гроновидного, листя креозотового куща, сени, водно-спиртових екстрактів зеленого чаю і Herbalife [6].
Факторами підвищення ризику МІУП є: генетичні особливості активності ферментів, жіноча стать, похилий вік, підвищення рівня трансаміназ на тлі медикаментозної терапії, доза і тривалість прийому лікарського засобу, одночасний прийом інших медикаментів [10, 14]. Значну роль у розвитку уражень печінки при прийомі певних лікарських засобів відіграють коморбідний стан пацієнта, а саме наявність захворювань печінки (у тому числі гепатитів В, С, цирозу, хронічних гепатитів, жирової інфільтрації печінки), СНІДу, ревматоїдного артриту, хронічної ниркової недостатності; вживання алкоголю (як хронічний алкоголізм, так і спорадичне вживання разом із ліками групи ризику); вживання наркотичних та інших психотропних препаратів; вагітність, дитячий/підлітковий вік; зайва вага; наявність захворювань обміну речовин, у тому числі цукрового діабету [8].
У 2019 р. Європейською асоціацією з вивчення печінки (EASL) були розроблені нові клінічні настанови, присвячені МІУП [15]. Окрім вищезазначених, розглядаються також такі фактори ризику МІУП: наявність компонентів метаболічного синдрому в пацієнтів, які отримують метотрексат і тамоксифен; хронічний гепатит С і В у пацієнтів, які отримують антиретровірусну та протитуберкульозну терапію; пероральні контрацептиви можуть розглядатися як фактори ризику розвитку аденоми печінки; андрогени й андрогенні стероїди, особливо в контексті лікування недостатності кісткового мозку, можуть розглядатися як фактори ризику розвитку пухлин печінки [5, 16].
Патогенетичні механізми пошкодження печінки дуже різноманітні. Загальними ланками патогенезу МІУП різного походження є: гіпоксія, деенергізація (дефіцит вироблення та утилізації аденозинтрифосфату (АТФ)), пошкодження мембран гепатоцитів (цитоплазматичних та мітохондріальних), активізація вільнорадикального окиснення та пригнічення антиоксидантного захисту. Виділяють 6 основних механізмів МІУП: 1) порушення метаболічних процесів у гепатоцитах (особливо 3 зони ацинуса); 2) токсична деструкція субклітинних структур; 3) індукція імунних реакцій; 4) канцерогенез; 5) порушення кровопостачання гепатоцитів; 6) загострення раніше наявного гепатоцелюлярного ураження [17].
Під час розвитку МІУП реактивні метаболіти та вільні радикали спричиняють перекисне окиснення ліпідів (ПОЛ). Активація ПОЛ призводить до надмірного утворення вільних радикалів. У наступному порушується функція мітохондрій (за рахунок пошкодження мітохондріальної мембрани) та виснажуються запаси АТФ. Однак надмірне утворення вільних радикалів може призводити і до денатурації білків (тобто втрати функціональної активності основних ферментативних систем), і до руйнування цитоскелета клітини [15].
Також існують інші патогенетичні механізми розвитку МІУП: утворення гаптенів із подальшим розвитком автоімунної реакції на органели, з якими відбулося зв’язування гаптену; блокада транспортної РНК із порушенням процесів репарації клітини; зв’язування з ядерними та цитоплазматичними молекулами, зміна їх функціональної активності, порушення основних саногенетичних механізмів функціонування клітини (як окремий варіант, зв’язування з мембранними рецепторами). Усі ці механізми можуть як окремо розвиватися, так і поєднуватися. Патофізіологічні механізми медикаментозної гепатотоксичності характеризуються як гепатоцелюлярними, так і позаклітинними змінами [4, 18]. До відомих форм ушкодження печінки можна віднести руйнування гепатоцитів і транспортних білків, цитолітичну активацію Т-клітин, апоптоз гепатоцитів, розпад мітохондрій, ураження жовчних протоків. Виділяють три основні групи реакцій при МІУП: 1) безпосередній дозозалежний вплив препаратів на гепатоцити; 2) ідіосинкратичні реакції на лікарські засоби; 3) опосередкована лікарськими засобами імунна відповідь (імунозумовлені МІУП) [19].
Пряма токсичність медикаментів є передбачуваною, розвивається протягом короткого часу (від годин до днів із моменту прийому лікарського засобу) і залежить від дози (безпосередній дозозалежний вплив). До препаратів із прямою гепатотоксичною дією належать ацетамінофен, аміодарон, анаболічні стероїди, антиретровірусні засоби, вальпроєва кислота, циклоспорин, гепарини, холестирамін, нікотинова кислота, статини [20, 21].
Ідіосинкратичні реакції на лікарські засоби, як правило, не пов’язані з їх дозою, належать до непередбачуваних реакцій, що зумовлені індивідуальними особливостями організму пацієнта. Ураження печінки при цьому може мати латентний характер або проявлятися через тривалий час після прийому першої дози і прогресувати незалежно від відміни препарату. Саме ідіосинкратичні реакції становлять більшість випадків МІУП, що зумовлює складність медичної проблеми. Ідіосинкратичну реакцію потенційно може викликати будь-який лікарський засіб, адже вона залежить від генетичних особливостей пацієнта й імунної реактивності організму [6, 22]. Ідіосинкратичні реакції на лікарські засоби можуть бути поділені на ті, які класифікуються як реакції гіперчутливості, або імуноалергічні, а також на ті, які є метаболічно-ідіосинкратичними [18, 23].
Імунозумовлені МІУП можуть проявитись у формі автоімунного гепатиту з ушкодженням гепатоцелюлярних структур, що проявляється цитолітичним синдромом і холестазом. У більшості досліджених випадків при припиненні прийому препарату клінічні прогнози є сприятливими. Підтвердити імунологічно опосередковане МІУП можливо за допомогою тестування лімфоцитів на їх трансформацію. Механізми розвитку МІУП часто поєднуються, що утруднює діагностику та вибір ефективної схеми лікування [19, 24].
Таким чином, МІУП може виникати в паренхімі органа за рахунок як цитотоксичної дії на гепатоцити, так й ураження елементів внутрішньопечінкової жовчовивідної системи (холестатичне ураження), або може бути змішаного генезу. Кожен тип відповідає певному ураженню основних мішеней — гепатоцитів або жовчних капілярів. При встановленні типу МІУП орієнтуються на рівень білірубіну, альбуміну крові, аланінамінотрансферази (АЛТ), лужної фосфатази (ЛФ) та показник R — співвідношення активності АЛТ (кратність до верхньої межі норми (ВМН)) та ЛФ (кратність ВМН) (АЛТ (кратність ВМН)/ЛФ (кратність ВМН)), у тому числі його повторна оцінка під час спостереження за пацієнтом [4, 6, 11].
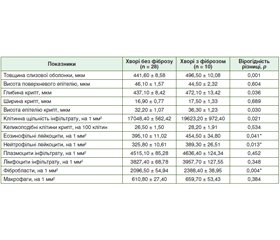
Сьогодні прийнята до практичного застосування класифікація МІУП згідно з критеріями Ради міжнародних організацій медичних наук (Сouncil for International Organizations of Medical Sciences (CIOMS)), що рекомендує оцінювати тип залежно від показника R (гепатоцелюлярний, холестатичний та змішаний) (табл. 1) і тривалості МІУП. За тривалістю ураження виділяють гострі МІУП (зміни АЛТ та ЛФ упродовж < 3 місяців); хронічні МІУП (зміни АЛТ та ЛФ упродовж > 3 місяців); хронічне захворювання печінки (підтверджується гістологічно) [5].
/61.jpg)
Застосування нестероїдних протизапальних препаратів, омепразолу, пароксетину, флуоксетину, парацетамолу, аміодарону, баклофену, ізоніазиду, кетоконазолу, лізиноприлу, лозартану, тетрацикліну, статинів може бути причиною виникнення гепатоцелюлярних МІУП. Холестатичний тип МІУП спостерігається при застосуванні амоксициліну/клавуланової кислоти, анаболічних стероїдів, хлорпромазину, клопідогрелю, пероральних контрацептивів, еритроміцину, ірбесартану, трициклічних антидепресантів [25, 26]. У той же час холестаз може виникати і при ураженні транспортних систем гепатоциту, у результаті чого до жовчі не надходять її компоненти. Ще одним варіантом холестазу, причому прогностично несприятливого, є синдром жовчних проток, що зникають. Цей синдром спостерігається при лікуванні такими препаратами, як аміназин, галоперидол, амоксицилін/клавуланова кислота, розиглітазон та триметоприм/сульфаметоксазол [18, 27].
МІУП змішаного типу можуть бути зумовлені такими лікарськими засобами, як амітриптилін, азатіоприн, каптоприл, карбамазепін, еналаприл, нітрофурантоїн, фенобарбітал, верапаміл, триметоприм/сульфаметоксазол [5].
Для зручності прогнозування гепатотоксичності перед призначенням лікарського засобу рекомендується уточнити його гепатотоксичний потенціал із використанням інтернет-ресурсу LiverTox (розроблено у США у 2012 р.) та HepaTox (розроблено в Китаї у 2014 р.), де міститься інформація про підтверджену гепатотоксичність лікарських засобів, які зареєстровані у регістрі Drug-Induced Liver Injury Network (DILIN) [28].
Клінічні прояви МІУП неспецифічні. Тяжкість перебігу хвороби варіює від безсимптомного до тяжкого з розвитком печінкової недостатності. До загальних симптомів належать нудота, втрата апетиту, абдомінальний дискомфорт, до печінкових симптомів — жовтяниця, свербіж шкіри, печінкові знаки, кровоточивість. Імуноалергічні реакції включають міалгії, артралгії, кон’юнктивіт, риніт, висипання на шкірі, лімфаденопатію, лейкоцитоз, лейкопенію, еозинофілію. Оцінка тяжкості ушкодження печінки оцінюється не тільки за клінічними даними, а і за рівнем лейкоцитів, тромбоцитів, білірубіну, АЛТ, аспартатамінотрансферази (АСТ), ЛФ, γ-глутамілтранспептидази, показників коагулограми [29]. Основними клінічними варіантами МІУП є: гострий гепатит, хронічний гепатит, стеатогепатит, холестаз (канальцевий, паренхіматозно-канальцевий, внутрішньопротоковий), склерозуючий холангіт, гранулематозне ураження печінки, фіброз, цироз, ураження судин (розширення синусоїдів, венооклюзійна хвороба, обструкція ворітної вени, обструкція печінкової вени), пухлини (фокальна нодулярна гіперплазія, аденома, гепатоцелюлярна карцинома) [2, 29].
При встановленні діагнозу МІУП, окрім клінічних і лабораторних досліджень, проводиться ретельний аналіз анамнезу пацієнта, особливо за останні 180 діб, з метою виявлення взаємозв’язків ураження печінки з прийомом лікарського засобу або БАД. Для визначення спектра захворювань, які необхідно виключити при проведенні диференціальної діагностики МІУП, необхідно уточнити його тип. При гепатоцелюлярному типі МІУП насамперед виключають вірусне, алкогольне й автоімунне ураження печінки, при холестатичному типі необхідно провести візуалізацію органів черевної порожнини для виключення інших причин холестазу. У сучасній клінічній практиці для своєчасної діагностики МІУП рекомендовано користуватись таким клінічним алгоритмом (табл. 2) [12, 30].
/62.jpg)
Для визначення зв’язку пошкодження печінки з прийомом певної лікарської речовини використовується шкала RUCAM, що розроблена під егідою CIOMS (Париж, 1989). Створений діагностичний інструмент отримав назву «Метод оцінки причинності Roussel Uclaf» (Roussel Uclaf Causality Assessment Method (RUCAM)). Ця шкала постійно доопрацьовується, та окремі її елементи неодноразово переглядаються [31, 32].
З 2011 року шкала RUCAM рекомендована Міжнародною робочою групою експертів з МІУП для застосування в клінічній практиці. Оцінка за шкалою RUCAM включає такі компоненти: часовий інтервал між початком захворювання та початком застосування лікарських засобів, перебіг захворювання після відміни препарату, наявність специфічних факторів ризику, застосування інших потенційно гепатотоксичних лікарських засобів, виключення інших причин захворювання печінки, відома потенційна гепатотоксичність підозрюваного препарату, реакція на повторне застосування підозрюваного препарату. Кожна ознака оцінюється в балах. Сумарна оцінка та класифікація причинно-наслідкового зв’язку: ≤ 0 балів — виключено; 1–2 бали — малоймовірно; 3–5 балів — можливо; 6–8 балів — ймовірно; ≥ 9 балів — високий ступінь ймовірності.
Якщо в ураженні печінки підозрюються кілька препаратів, то шкалу RUCAM необхідно застосовувати до кожного препарату окремо. Якщо це неможливо (наприклад, при призначенні комбінації протитуберкульозних засобів усі препарати можуть бути причетні до розвитку МІУП), слід вдаватися до думки фахівців та ранжувати ймовірність різних лікарських засобів як причини МІУП на підставі фенотипу ураження та зіставлення з даними літератури [33].
Міжнародні критерії оцінки МІУП включають:
1) наявність часових інтервалів між прийомом препарату та розвитком гепатотоксичної реакції (5–90 днів);
2) перебіг реакції після відміни препарату (зниження рівня печінкових ферментів на 50 % протягом 30 днів для гепатоцелюлярного та 180 днів — для холестатичного ураження);
3) виключення альтернативних причин — шляхом ретельного додаткового обстеження, у тому числі і проведення біопсії печінки;
4) позитивна відповідь на повторне введення препарату (якщо це допускається) та підвищення рівня ферментів у 2 рази вище від норми. Реакцію розцінюють як «пов’язану з препаратом» у випадку, якщо вона задовольняє трьом першим критеріям або двом з перших трьох критеріїв та четвертому критерію [34].
Тяжкість пошкодження печінки визначається за шкалою DILIN (Drug Induced Liver Injury Network), за якою виділяють легкий, помірний, помірно-тяжкий, тяжкий і фатальний ступінь пошкодження. Легкий ступінь МІУП характеризується підвищенням рівнів АЛТ, АСТ або ЛФ, умістом загального білірубіну < 3 мг/дл і значенням міжнародного нормалізованого відношення (МНВ) < 1,5. При помірному МІУП загальний білірубін перевищує 3 мг/дл, а МНВ становить > 1,5 на тлі таких клінічних симптомів, як слабкість, нудота, блювання, біль у правому верхньому квадранті живота, свербіж, висип на шкірі, жовтяниця, відсутність апетиту, втрата маси тіла. Для помірно-тяжкого МІУП властиві дворазове перевищення нормальних значень білірубіну та потреба в госпіталізації. За умови тяжкого МІУП печінкові ферменти щонайменше вп’ятеро перевищують норму, загальний білірубін — більше ніж удвічі; спостерігаються такі симптоми, як асцит, кровотеча з варикозно розширених вен, недостатність інших органів і систем. Найвищим ступенем тяжкості МІУП є фатальні ушкодження, які завершуються смертю від печінкової недостатності чи трансплантацією печінки [5, 6].
Клініко-фармакологічні підходи до вибору препаратів для збереження нормальної функції печінки та сприяння відновленню її структури при МІУП є складними. Як відомо, основною тезою клінічної фармакології є призначення правильних ліків у необхідній дозі конкретному пацієнту. Патогенетична фармакотерапія та профілактика уражень печінки повинні базуватися на прийомі препаратів із механізмом дії, що спрямована на усунення однієї або кількох ланок патогенезу МІУП. Але основні ланки патогенезу МІУП можуть бути пов’язані між собою чи сильно відрізнятися, що створює певні складності при виборі терапії. У зв’язку з поліморфним перебігом МІУП стандартного його лікування не існує. Тактика лікування МІУП насамперед залежить від тяжкості симптомів і типу ураження [35].
Лікування МІУП починається з негайного виключення прийому лікарського засобу, рослинного препарату або БАД, що спричинили небажані явища (промивання шлунка, клізми, форсований діурез, еферентні методи). Існують дані, що фатальний результат спостерігається, якщо речовина, що спричинила МІУП, надходила в організм понад дві-три доби [36].
Для різних форм МІУП EASL рекомендує застосовувати конкретні методи лікування:
— короткотривале призначення холестираміну може використовуватися для зменшення гепатотоксичності, що спричинена лише окремими препаратами (лефлуномід і тербінафін);
— L-карнітин можна призначати для зниження гепатотоксичності при терапії вальпроатами;
— якщо доведений патологічний вплив парацетамолу — на ранніх стадіях захворювання призначається N-ацетилцистеїн [37, 38].
У разі ідіосинкратичних МІУП специфічних антидотів немає. Проводиться симптоматичне лікування. У пацієнтів із гострою печінковою недостатністю та енцефалопатією, тяжкими порушеннями коагуляції та декомпенсованим цирозом може розглядатися проведення трансплантації печінки [37].
Глюкокортикостероїди (ГКС) для лікування гострої печінкової недостатності при ідіосинкратичних МІУП не мають доказів ефективності. Тільки в одному невеликому неконтрольованому дослідженні при лікуванні МІУП комбінацією урсодеоксихолевої кислоти (УДХК) та ГКС отримано обнадійливі результати [39].
Для найкращого захисту печінки від ушкоджуючих факторів необхідно застосовувати такі гепатотропні засоби, які б діяли комплексно і за кількома патогенетичними напрямками та максимально коригували ушкодження печінки. У зв’язку з кумулятивною дією багатьох гепатотоксичних препаратів, а також з повільним регресом патологічних морфологічних змін у печінці особливо актуальним стає використання гепатопротекторів [40, 41].
Дані доказової медицини свідчать, що ідеального гепатотропного препарату не існує. Кожен із відомих гепатопротекторів має свої переваги і недоліки. Найбільш затребуваними у клінічній практиці є препарати силімарину, фосфатидилхоліну, УДХК, природних амінокислот, тіолових сполук [42, 43]. Результати вивчення хімічної структури, фармакодинаміки, фармакокінетики гепатопротекторних засобів не дають однозначних відповідей на численні питання щодо показань до їх застосування, вибору конкретного препарату та тривалості його застосування. Це створює певні складності при виборі гепатопротективного препарату з метою лікування МІУП. Гепатопротектори використовуються для корекції МІУП середнього та тяжкого ступеня. Вибір гепатопротектора для лікування МІУП, зокрема хронічної форми, диктується типом ушкодження печінки. Проводилося дуже мало рандомізованих клінічних досліджень щодо ефективності застосування гепатопротекторів при МІУП. Це зумовлено рідкістю та непередбачуваністю реакцій на більшість лікарських засобів [4, 40, 41].
Препарати природних амінокислот та їх похідних (L-карнітин, L-орнітин-L-аспартат, метіонін, адеметіонін, аргініну глутамат), як основний структурний матеріал для синтезу білків клітинних мембран, рецепторів, ферментів, пептидних гормонів та інших біологічно активних сполук, часто застосовуються для лікування токсичних уражень печінки, тому що вони справляють виражену гепатопротекторну дію і мають найменшу кількість побічних явищ [21, 44].
L-карнітин є похідним амінокислот метіоніну і лізину і служить кофактором бета-окиснення жирних кислот, забезпечує транспорт вільних жирних кислот із цитозолю в мітохондрії, а також їх розщеплення з утворенням ацетил-КоА. Важливу роль у розвитку гепатотоксичних реакцій при прийомі вальпроєвої кислоти може відігравати вихідний дефіцит карнітину. Вальпроєва кислота має здатність пригнічувати синтез за допомогою зменшення концентрації альфа-кетоглутарату та викликати дефіцит карнітину в організмі. Установлено, що прийом L-карнітину активує бета-окиснення вальпроєвої кислоти, тим самим обмежує цитозольне омега-окиснення жирних кислот та утворення токсичних метаболітів, що беруть участь у реакціях гепатотоксичності та накопиченні аміаку. Відомо і те, що L-карнітин стимулює обмінні процеси, енергетичний обмін, нормалізує ліпідний та вуглеводний обмін, служить інгібітором фактора некрозу пухлини альфа (ФНП-α). Різні автори рекомендують вводити L-карнітин у найкоротші терміни після отруєння в такому режимі: 100 мг/кг внутрішньовенно одноразово, потім 50 мг/кг внутрішньовенно кожні 4 години до поліпшення стану [45]. За результатами ретроспективного дослідження, що включало 92 пацієнти з фульмінантною печінковою недостатністю, що розвинулася внаслідок прийому вальпроєвої кислоти, призначення L-карнітину призводило до збільшення виживання з 10 до 48 % (р < 0,001). Підвищення цього показника відзначалося лише при внутрішньовенному способі введення L-карнітину (69 % при внутрішньовенному та 29 % при ентеральному) у дозі 50–100 мг/кг з інтервалом у 6–8 годин [46].
Специфічну антитоксичну дію справляє аргініну глутамат — лікарський препарат, що складається з аргініну та глутамінової кислоти. У його механізмі дії основну роль відіграє здатність зв’язувати ендогенний аміак, що утворюється у високих концентраціях при порушенні детоксикуючої функції печінки. Крім того, аргінін значно зменшує стеатоз, некроз, запалення та фіброз печінки за рахунок позитивної дії системи «L-аргінін — оксид азоту», що здатний пригнічувати адгезію лейкоцитів та тромбоцитів, перешкоджати окисненню ліпопротеїнів низької щільності, зменшувати продукцію вільних радикалів, інгібувати прилипання моноцитів до ендотелію [44]. Експериментальні дослідження з використанням аргініну глутамату показали цілу низку позитивних ефектів препарату, а саме покращення енергетичного обміну через первинне накопичення креатинфосфату, корекцію кислотно-лужного стану за рахунок нормалізації лужного запасу крові, антиоксидантну та мембраностабілізуючу дію завдяки пригніченню ПОЛ, а також стабілізацію мембран гепатоцитів за рахунок зниження активності цитолітичних ферментів [47]. У клінічній практиці аргініну глутамат застосовується при гострих та хронічних гепатитах різної етіології, цирозі печінки, отруєнні гепатотропними отрутами (грибами, хімічними, лікарськими речовинами). Клінічна ефективність аргініну глутамату вивчалась переважно вітчизняними дослідниками. Установлено, що особливістю аргініну глутамату є те, що його можна застосовувати як у гострій стадії захворювання (як дезінтоксикант і донатор оксиду азоту), так і в період реконвалесценції (як гепатопротектор) [44].
Адеметіонін (син.: S-аденозил-L-метіонін, сульфоаденозил-L-метіонін, S-аденозилметіонін; англ.: S-adenosyl-L-methionine/SAMe, S-adenosylmethionine, ademetionine) — природна сполука, похідна сірковмісної незамінної амінокислоти метіоніну та АТФ, наявна у всіх тканинах організму, але в найвищій концентрації — у печінці [48]. Адеметіонін належить до амінокислот або їх похідних. Адеметіонін є активним метіоніном, оскільки саме адеметіонін, а не вільний метіонін є фактичним донатором метильних груп у реакціях трансметилювання, що опосередковано сприяє синтезу фосфоліпідів клітинної мембрани. Ця сполука відіграє найважливішу роль в інших ключових біохімічних процесах, а саме транссульфуруванні (забезпечує синтез глутатіону та таурину, кон’югацію жовчних кислот, детоксикацію жовчних кислот та ксенобіотиків) та амінопропіліруванні (синтез поліамінів: путресцин, спермідин, спермін, що відіграють важливу роль у формуванні структури рибосом та процесах регенерації) [35]. Такі властивості адеметіоніну, як здатність підвищувати рівень глутатіону в мітохондріях і підтримувати їх функціональну активність, інактивувати CYP2E1, пригнічувати експресію ФНП-α, дають підстави щодо широкого його застосування в клінічній практиці, у тому числі при МІУП. Важливу роль у цьому аспекті відіграють антифібротичні, антинейротоксичні, дезінтоксикаційні, антиоксидантні, регенеруючі та антидепресивні властивості адеметіоніну [49]. Адеметіонін забезпечує окисно-відновний механізм клітинної детоксикації, стимулює регенерацію клітин та проліферацію гепатоцитів.
Адеметіонін є максимально ефективним при парентеральному введенні, оскільки має такі властивості:
— холеретичну — стимулює вироблення та відтік жовчі, а також надходження жовчних кислот із гепатоцитів у жовчовивідну систему через покращення плинності мембрани гепатоциту та роботи внутрішньоклітинних транспортних систем;
— холекінетичну — нормалізує моторику жовчовивідних шляхів, забезпечує фізіологічне просування жовчі до жовчного міхура і далі в дванадцятипалу кишку, що сприяє покращенню травлення, ліквідує внутрішньопечінковий холестаз та нормалізує біохімічні показники крові;
— регенеруючу — стимулює регенерацію та проліферацію гепатоцитів, що дозволяє компенсувати функції печінки та збільшує виживання пацієнтів навіть при виражених змінах, у тому числі і при цирозі;
— антиоксидантну — збільшує синтез глутатіону та цистеїну, що є природними факторами антиоксидантного захисту в організмі, що запобігає ураженню вільними радикалами, жовчними кислотами та іншими токсичними агентами клітин печінки [40, 41].
Найбільш переконливі клінічні результати застосування адеметіоніну отримані при холестатичних та змішаних ураженнях. Адеметіонін є ефективним при внутрішньопечінковому варіанті холестазу. У клінічній практиці пропонується така схема призначення адеметіоніну при виявленні МІУП. Препарат вводиться внутрішньовенно у високій дозі (1600 мг на добу) протягом 2–3 тижнів із наступним переходом на пероральний прийом у стандартній дозі (800 мг на добу) або, за потреби, у високій дозі (1600 мг на добу). З метою підтримки ремісії при хронічній формі МІУП рекомендується курсовий прийом препарату (400, 800, 1600 мг на добу), тривалість курсу — щонайменше 30 днів [50].
Також адеметіонін справляє антиатерогенний (впливає на синтез ліпопротеїдів дуже низької щільності та тригліцеридів), протизапальний (індукує синтез інтерлейкіну-10 та пригнічує активність ФНП-α) та захисний (блокує апоптоз нормальних гепатоцитів) ефекти [3]. Існують дані про виражений позитивний ефект адеметіоніну при медикаментозному холестазі, обумовленому застосуванням α-інтерферону [51].
В одному багатоцентровому проспективному дослідженні 105 пацієнтів із псоріазом, які отримували імуносупресивну терапію (метотрексат, циклоспорин, ГКС), показана ефективність адеметіоніну при МІУП холестатичного типу. На початку гепатопротективної терапії пацієнти отримували адеметіонін парентерально у дозі 400–800 мг на добу протягом 2 тижнів, а на підтримуючому етапі — 800–1600 мг на добу перорально упродовж 4 тижнів, період спостереження після терапії становив 30 днів. У результаті застосування даної схеми гепатопротективної терапії вірогідно знизились рівень загального білірубіну, активність ЛФ, γ-глутаматтрансферази, АСТ, АЛТ, а також симптоми внутрішньопечінкового холестазу (свербіж шкіри, жовтяниця, слабкість) [52].
Найбільший досвід оцінки ефективності гепатопротекторів при МІУП накопичений в онкологічній практиці [53]. При цьому цілями призначення гепатопротекторів є не тільки лікування МІУП, що вже виникло, але і його профілактика, а також можливість забезпечити проведення повноцінного курсу хіміотерапії [54]. У рекомендаціях онкологів акцент робиться на препарати S-аденозил-L-метіоніну (адеметіонін) як такі, що мають найбільшу ефективність та доказову базу [50, 55]. Ефективність адеметіоніну доведена у низці досліджень при проведенні поліхіміотерапії. У дослідженні D. Santini et al. 50 пацієнтів отримували три різні протипухлинні режими: ралтитрексид + оксаліплатин, FOLFIRI (іринотекан, 5-фторурацил, натрію левофолінат), CMF (циклофосфан, метотрексат, 5-фторурацил). При розвитку гепатотоксичності (підвищення рівня сироваткових трансаміназ і лактатдегідрогенази) їм призначався адеметіонін. Через 2 тижні лікування спостерігалося значне зниження рівня АСТ, АЛТ і лактатдегідрогенази. Слід зазначити, що і надалі показники печінкових ензимів були сталими, завдяки чому пацієнти змогли продовжити запланований курс поліхіміотерапії. Наявність метастазів не впливала на ефективність лікування адеметіоніном [5, 56].
Ретроспективне дослідження 105 пацієнтів із колоректальним раком та режимом хіміотерапії FOLFOX IV (оксаліплатин, лейковорин, 5-фторурацил) показало, що ад’ювантне призначення адеметіоніну в дозі 400 мг 2 рази на день протягом усього курсу хіміотерапії вірогідно знижує ступінь токсичності для печінки (p = 0,002) і створює меншу потребу в затримці курсу хіміотерапії. У цьому дослідженні 45 пацієнтам вводили FOLFOX IV без адеметіоніну, а 60 пацієнтам проводили такий самий режим разом з адеметіоніном (400 мг двічі на добу). Рівні AСT (p < 0,001), AЛT (p = 0,003), білірубіну (p = 0,04) після закінчення ад’ювантної терапії були значно нижчими в пацієнтів, які отримували адеметіонін. Подібні результати отримані в дослідженні, в якому 42 пацієнти отримували лікування бевацизумабом та XELOX, тоді як 32 пацієнти отримували такий самий режим разом з адеметіоніном (400 мг двічі на день) (р = 0,009). На тлі прийому адеметіоніну відбувалося зменшення потреби у затримці курсу хіміотерапії (р = 0,042) та зменшенні дози (р = 0,051) порівняно з іншими групами. Установлено, що після лікування адеметіоніном рівні різних лабораторних показників (білірубін, γ-глутамілтранспептидаза, AЛT, AСT) значно знижуються (р < 0,05). Відбувалося значне поліпшення таких симптомів внутрішньопечінкового холестазу, як свербіж, втома та жовтяниця, повідомлялося про зменшення кількості пацієнтів із симптомами депресії [57].
Українські вчені І. Скрипник, Г. Маслова у 2019 р. провели дослідження ролі надлишкової маси тіла й ожиріння в розвитку гепатотоксичних реакцій у хворих на хронічний лімфоцитарний лейкоз. Учасників дослідження розподілили на дві групи за індексом маси тіла (ІМТ): до 1 групи були включені хворі (n = 47) із нормальним ІМТ (18,5–25,0 кг/м2), до 2 — пацієнти (n = 26) з ІМТ > 25 кг/м2. Гепатотоксичні реакції після 2 курсу хіміотерапії виникли у 23,4 % хворих 1 групи та в 30,7 % — 2 групи. Гепатотоксичні реакції після 4 курсів зафіксовано всього у 15,4 % пацієнтів 2 групи і не відмічено в пацієнтів 1 групи. Таким чином, надлишкова маса тіла та наявність неалкогольного стеатогепатиту є провідними чинниками гепатотоксичних реакцій, які характеризуються зростанням їх ступеня тяжкості паралельно зі збільшенням кумулятивної дози хіміопрепаратів.
В іншому вітчизняному дослідженні брали участь 44 хворі на вперше встановлений гострий лейкоз, яким було призначено поліхіміотерапію (ПХТ). Їх розподілили на дві групи: пацієнтам 1 групи (n = 23) призначили ПХТ + адеметіонін (1000 мг/добу), 2 групи (n = 21) — ПХТ. Функцію печінки оцінювали за рівнем печінкових ферментів (АЛТ, АСТ, ЛФ, γ-глутамілтранспептидаза, загальний білірубін, загальний білок). У пацієнтів 1 групи частота й тяжкість гепатотоксичності була нижчою порівняно з 2 групою. Дослідниками було зроблено висновок, що захисний ефект адеметіоніну пов’язаний із поліпшенням пластичності мембран гепатоцитів та активності антиоксидантної системи. Рекомендована доза препарату — 1000–1500 мг/добу для перорального застосування або 500–1000 мг/добу парентерально [58].
УДХК традиційно зараховують до гепатопротекторів. На сьогодні достатньо вивченими і доведеними є такі ефекти УДХК: літолітичний, холеретичний, цитопротективний, імуномодулюючий, гіпохолестеринемічний, антиоксидантний. УДХК стала базовим препаратом не тільки при лікуванні хронічних дифузних захворювань печінки, а і низки генетично детермінованих захворювань, зокрема муковісцидозу, а також внутрішньопечінкового холестазу різного генезу (холестаз, зумовлений повним парентеральним харчуванням, СНІД-асоційована холангіопатія, доброякісний оборотний внутрішньопечінковий холе–стаз, холестаз вагітних), токсичних уражень печінки, зокрема МІУП [59].
Призначення препаратів УДХК можливе пацієнтам із холестатичним типом МІУП. Це пояснюється механізмом дії УДХК. Гідрофільна УДХК захищає гепатоцити і холангіоцити від некрозу й апоптозу, які викликані гідрофобними жовчними кислотами при холестазі. УДХК забезпечує захист холангіоцитів, тому що токсичні жовчні кислоти видаляються з крові (заміщаються). При цьому блокується апоптоз гепатоцитів, стабілізується мітохондріальна мембрана та пригнічується розвиток фіброзу [60]. Призначення УДХК хворим на цукровий діабет, які отримували флуклоксацилін із приводу інфікованих виразок діабетичної стопи, сприяло нормалізації рівня білірубіну сироватки крові на 16–21-й день [61]. Показана ефективність УДХК при холестазі, пов’язаному з прийомом аміодарону [59]. Застосування УДХК як гепатопротектора при призначенні антибіотикотерапії запобігало наслідкам негативного ксенобіотичного медикаментозного навантаження на гепатоцити.
Безпека та ефективність застосування УДХК ілюструються результатами метааналізу, що підтвердив високу ефективність сполуки при лікуванні холестазу вагітних, та рекомендаціями EASL із лікування холестазів. Відповідно до рекомендацій EASL, при холестазі вагітних слід приймати внутрішньо УДХК у дозі 10–20 мг/кг/добу [62, 63]. Рекомендації щодо застосування УДХК для лікування холестатичного МІУП містяться у відомому керівництві з гепатології E. Kuntz і H.-D. Kuntz. Ці ж автори допускають застосування в цій ситуації адеметіоніну [64].
Також у рекомендаціях EASL наводяться дані про ефективність УДХК у лікуванні двох третин випадків холестатичних МІУП. EASL також рекомендує цей препарат для лікування автоімунного гепатиту та інших автоімунних захворювань печінки з урахуванням того, що при МІУП нерідко запускається автоімунний процес [62, 65].
Проте дані доказової медицини, що підтверджують ефективність УДХК при лікуванні МІУП, сьогодні досить обмежені. Ефективність УДХК вивчалася у рандомізованому контрольованому дослідженні Yi-Shin Huang із включенням 112 пацієнтів із МІУП, які були рандомізовані у 2 групи: 54 пацієнти отримували УДХК у дозі 13–15 мг/кг маси тіла на добу, 58 пацієнтів становили групу контролю. За результатами дослідження рівень ЛФ був вірогідно нижчим у групі, яка отримувала УДХК. Проте у пацієнтів із тяжким МІУП кількість летальних наслідків, потреба в трансплантації печінки не відрізнялися незалежно від призначення УДХК [66].
Препарати УДХК можуть комбінуватися з будь-якими іншими гепатопротекторами та ГКС. В останніх публікаціях використання УДХК у дозі 13–15 мг/кг в 1–3 прийоми тривалий час (3–6 місяців і більше) при холестатичному типі МІУП розглядається як традиційне [24, 31]. Проте, незважаючи на значну кількість проведених досліджень із вивчення різних властивостей УДХК, експерти EASL вважають, що ефективність УДХК у зменшенні тяжкості МІУП недостатньо обґрунтована.
Гепатотоксичні речовини викликають ушкодження мембран гепатоцитів, що складаються на 60 % із фосфоліпідів, що призводить до порушення внутрішньоклітинного метаболізму і загибелі клітини. Дефіцит есенціальних фосфоліпідів (ЕФЛ) характерний як для хронічних, так і для гострих МІУП. Основна властивість ЕФЛ — мембраностабілізуюча за рахунок вмонтовування екзогенних фосфоліпідів у пошкоджену мембрану. ЕФЛ зменшують вираженість синдрому цитолізу, опосередковано проявляють антифібротичну дію [10]. ЕФЛ продемонстрували свою ефективність при експериментальних моделях токсичного гепатиту, індукованого прийомом парацетамолу, тетрацикліну та індометацину, що зумовило доцільність їх призначення при МІУП у людей [6]. Є також повідомлення про ефективність ЕФЛ у терапії токсичних уражень печінки фенолом, креазолом та алкоголем, а також імуносупресантами, що використовуються при лікуванні пухлин різного генезу [37, 67]. Проте наукові дослідження, що підтверджують ефективність ЕФЛ з високим ступенем доказовості, на сьогодні відсутні [12, 68–70].
До складу гепатотропних препаратів рослинного походження часто включають екстракт розторопші плямистої, основним компонентом якого є силімарин. Механізм дії силімарину і його головного ізомеру силібініну ґрунтується на трьох основних біологічних ефектах: мембраностабілізуючому, антиоксидантному і метаболічному. Силібінін має унікальну здатність блокувати транспортні системи щодо деяких токсичних речовин. Силімарин суттєво знижує активність маркерів цитолізу і внутрішньопечінкового холестазу при токсичних гепатитах внаслідок застосування психотропних, туберкулостатичних і протисудомних засобів [14, 43].
Гепатопротективна активність силімарину доведена на експериментальних тваринах із використанням ацетамінофену, етанолу, D-галактозаміну та інших токсичних речовин. Незважаючи на тривалу історію використання розторопші в медицині, багатогранні ефекти її компонентів все ще вивчаються. Метааналіз 14 рандомізованих плацебо-контрольованих клінічних досліджень, два з яких включали пацієнтів із МІУП, показав, що застосування силімарину при хронічних захворюваннях печінки не призводить до значного зниження активності трансаміназ, тому цей препарат не рекомендується у лікуванні медикаментозної гепатотоксичності [45, 48]. Багатокомпонентні препарати з індійських та китайських трав також вважають гепатопротекторами рослинного походження, але дія кожної складової цих засобів недостатньо вивчена. Крім того, клінічний досвід та результати досліджень свідчать, що при гострій патології печінки та синдромі холестазу застосування багатокомпонентних зборів може посилювати вираженість цитолітичного та мезенхімально-запального синдромів. Відомо, що з речовинами рослинного походження безпосередньо пов’язана проблема генетичного поліморфізму метаболізму, що асоційована з цитохромом Р450. Міжетнічний генетичний поліморфізм визначає індивідуальну реакцію організму на рослинні речовини, у зв’язку з цим можна з високим ступенем ймовірності стверджувати, що рослини, які є ефективними в азіатській популяції, можуть бути небезпечними у європейській [26]. Китайські дослідники при середньотяжкому МІУП із переходом у тяжку форму гепатоцелюлярного або змішаного типу використовують засоби на основі лимонника китайського [5]. У той же час у клінічних рекомендаціях Китайського гепатологічного товариства (2017) зазначено, при холестатичному типі МІУП існують докази ефективності S-аденозилметіоніну й УДХК [5, 65].
Таким чином, лікування пацієнтів із МІУП є складним медичним завданням. При призначенні лікарських засобів необхідно пам’ятати, що усі вони є ксенобіотиками і підлягають метаболізму в печінці, тим самим завдають їй додаткового навантаження. Фармакотерапія повинна бути диференційованою з урахуванням вираженості цитолітичного та мезенхімально-запального синдромів, наявності чи відсутності синдрому холестазу, індивідуальних особливостей пацієнта. Тобто лікування МІУП повинно бути комплексним і персоніфікованим. Вибір гепатопротектора повинен ґрунтуватись на клінічному варіанті патологічного процесу, особливостях фармакокінетики та фармакодинаміки лікарського засобу, що спричинив МІУП, ступені його тяжкості та типі ураження печінки (гепатоцелюлярний, холестатичний, змішаний) [33, 60].
Багато сучасних гепатопротекторів поки що не мають підтверджень клінічної ефективності з позицій доказової медицини, тому перелік показань до їх застосування вимагає додаткового наукового обґрунтування.
З точки зору доказової медицини, безперечною перевагою адеметіоніну є наявність чіткої гепатопротекторної дії практично при будь-якій патології печінки, у тому числі при високих показниках цитолізу та синдромі холестазу. Практичне застосування адеметіоніну найбільш доцільне при МІУП, яке пов’язане з дією токсичних метаболітів лікарського засобу, при первинному або вторинному дефіциті глутатіону в організмі, а також за необхідності продовження прийому лікарського препарату, що спричинив МІУП [52, 56, 71].
Гепатопротекторним препаратом першого вибору при МІУП можна вважати адеметіонін, тому що він має потужний терапевтичний потенціал, що ґрунтується на багатовекторному механізмі дії та антитоксичних властивостях препарату [51].
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Інформація про фінансування. Робота виконується відповідно до плану наукових досліджень Української військово-медичної академії МО України.
Внесок авторів у роботу над статтею. Осьодло Г.В. — концепція та дизайн статті; Бойчак М.П. — пошук та аналіз наукових джерел, написання статті; Федорова О.О. — редагування тексту та літературних джерел.
Отримано/Received 30.06.2022
Рецензовано/Revised 11.07.2022
Прийнято до друку/Accepted 19.07.2022

/61.jpg)
/62.jpg)