Международный эндокринологический журнал Том 18, №3, 2022
Вернуться к номеру
Асоціативні зв’язки між ожирінням і ступенем забезпеченості вітаміном D як чинником ризику первинного гіперпаратиреозу
Авторы: Гончарова О.А. (1, 2), Дубовик В.М. (2)
(1) — Харківський національний медичний університет, м. Харків, Україна
(2) — ДУ «Інститут проблем ендокринної патології ім. В.Я. Данилевського НАМН України», м. Харків, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
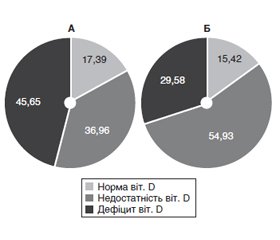
Актуальність. На сьогодні встановлено факт і механізми асоціативних зв’язків між дефіцитом вітаміну D і первинним гіперпаратиреозом (ПГПТ). Відомо, що на рівні 25(ОН)D впливають кліматичні умови та наявність ожиріння (Ож). Вказане визначило мету дослідження — встановити забезпеченість вітаміном D хворих із ендокринною патологією, що мешкають в умовах клімату України, та оцінити вплив Ож на рівні вітаміну D і розвиток гіперкальціємії — ознаки ПГПТ. Матеріали та методи. У 145 хворих, які знаходились в ендокринологічній клініці з приводу різної ендокринної патології, досліджено ІМТ, рівні кальцію (Са) та вітаміну D у сироватці крові. Проаналізовано частоту недостатності та дефіциту вітаміну D, гіперкальціємії у групах з ожирінням та без нього. Результати. Частка хворих із ожирінням у загальній групі становила 33,8 %, серед чоловіків — 28,57 %, серед жінок — 35,04 % (p < 0,05). Рівень Са в крові був 2,39 ± 0,02 ммоль/л, гіперкальціємія відзначалася в 16,55 %, а Ож — у 49 (33,49 %) хворих. На тлі Ож рівень Са становив 2,42 ± 0,02, а в осіб без ожиріння — 2,38 ± 0,02 (p > 0,05). Середній рівень вітаміну D у крові у загальній групі становив 22,95 ± 0,73 мг/мл та був вірогідно нижчим в осіб з Ож (20,95 ± 1,39 мг/мл проти 24,09 ± 0,81 мг/мл у групі без Ож, p < 0,05). Розподіл хворих залежно від ступеня забезпеченості вітаміном D показав, що в когорті зі зниженою забезпеченістю вітаміном D та наявністю Ож підгрупа з дефіцитом вітаміну D (20–29 нг/мл) була майже вдвічі більшою, ніж підгрупа без Ож. Таким чином, наявність Ож у хворих із ендокринною патологією не має вірогідного впливу на частоту гіперкальціємії, але асоціюється з вірогідним зниженням рівня вітаміну D у крові з перевагою у підгрупі з дефіцитом вітаміну D, у той час як у групі без Ож спостерігається перевага недостатності вітаміну D. Висновки. У кліматичних умовах України у хворих з ендокринною патологією середній рівень забезпеченості вітаміном D знаходиться у межах його недостатності (22,95 ± 0,73 нг/мл). Наявність ожиріння у хворих з ендокринною патологією асоціюється з вірогідно більш низькою забезпеченістю вітаміном D, зростанням майже вдвічі кількості осіб з дефіцитом вітаміну (< 20 нг/мл). У хворих з ендокринною патологією поєднання ожиріння і дефіциту вітаміну D слід розглядати як чинник ризику первинного гіперпаратиреозу. Такі хворі потребують регулярного контролю рівня кальцію крові та паратгормону, а також медикаментозної підтримки забезпеченості вітаміном D.
Background. To date, the fact and mechanisms of associative links between vitamin D deficiency and primary hyperparathyroidism (PGPT) have been established. In turn, the level of 25(OH)D is influenced by climatic conditions and the presence of obesity (Ob). These set the purpose of the study — to determine the supply of vitamin D in patients with endocrine disorders living in the climate in Ukraine, and to assess the impact of Ob on vitamin D levels and the development of hypercalcemia — signs of PGPT. Materials and methods. BMI, serum calcium (Ca) and vitamin D levels in 145 patients who were in the endocrinology clinic for various endocrine pathologies were studied. The frequency of vitamin insufficiency and vitamin D efficiency, hypercalcemia in groups with and without obesity was analyzed. Results. The proportion of obese in the general group was 33.8 %, among men — 28.57 %, among women — 35.04 % (p < 0.05). The level of Ca in the blood was 2.39 ± 0.02 mmol/l, high Ca level occurred in 16.55 %, and Ob — іn 49 (33.49 %) patients. Against the background of Ob, the level of Ca was 2.42 ± 0.02, and in non-obese people — 2.38 ± 0.02 (p > 0.05). Average level of vitamin D in the blood in the general group was 22.95 ± 0.73 mg/ml and was probably lower in individuals with Ob (20.95 ± 1.39 vs. 24.09 ± 0.81 mg/ml in groups without Ob, p < 0.05). Distribution of the disease by the degree of provision of vitamin D showed that in a cohort with low security vitamin D and the presence of Ob subgroup with a deficiency of vitamin D (20–29 ng/ml) was almost twice as large as the similar subgroup without Ob. As follows, the presence of Ob in patients with endocrine pathology has no probable effect on the incidence of hypercalcemia, but is associated with a probable decrease in the level of vitamin D in the blood with a predominance of subgroups with vitamin D deficiency, while in the group without Ob. Conclusions. In the climatic conditions of Ukraine and the functioning health care system in patients with endocrine pathology, the average level of vitamin D is within its deficiency (22.95 ± 0.73 ng/ml). The presence of obesity in patients with endocrine pathology is associated with a probably lower supply of vitamin D, almost doubling the subgroup with vitamin deficiency (< 20 ng/ml). The combination of obesity and vitamin D deficiency should be considered as a risk factor for primary hyperparathyroidism in patients with endocrine pathology. Such patients need regular monitoring of blood calcium and parathyroid hormone, as well as medical support for vitamin D.
первинний гіперпаратиреоз; ожиріння; вітамін D
primary hyperparathyroidism; obesity; vitamin D
Вступ
Матеріали та методи
Результати
/53.jpg)
Обговорення
Висновки
- Souberbielle J.-C., Bienaimé F., Cavalier E., Cormier C. Vitamin D and primary hyperparathyroidism (PHPT). Annales d’Endocrinologie. 2012. Vol. 73 (3). P. 165-169. doi.org/10.1016/j.ando.2012.04.008.
- Walker M.D., Bilezikian J.P. Vitamin D and primary hyperparathyroidism: more insights into a complex relationship. Endocrine. 2017. Vol. 55. Р. 3-5. doi.org/10.1007/s12020-016-1169-1.
- Eastell R., Brandi M.L., Costa A.G., D’Amour P., Shoback D.M., Thakker R.V. Diagnosis of asymptomatic primary hyperparathyroidism: proceedings of the Fourth International Workshop. J. Clin. Endocrinol. Metab. 2014. Vol. 99(10). Р. 3570-3579. doi: 10.1210/jc.2014-1414.
- Walker M.D., Cong E., Lee J.A., et al. Low vitamin D levels have become less common in primary hyperparathyroidism. Osteoporos. Int. 2015. Vol. 26(12). Р. 2837-2843. doi:10.1007/s00198-015-3199-6.
- Sempos C.T., Binkley N. 25-Hydroxyvitamin D assay standardisation and vitamin D guidelines paralysis. Public Health Nutr. 2020. Vol. 23(7). Р. 1153-1164. doi:10.1017/S1368980019005251.
- Lindeman B.M., Pesce C.E., Tsai H.L., et al. Lower vitamin D levels in surgical hyperparathyroidism versus thyroid patients. Am. Surg. 2014. Vol. 80(5). Р. 505-510. PMID: 24887732; PMCID: PMC4362715.
- Liu Y., Guo S., Wu J., et al. Changes in clinical patterns of Chinese patients with primary hyperparathyroidism in the past 12 years: a single-center experience. Endocr. Connect. 2021. Vol. 10(11). Р. 1428-1434. doi:10.1530/EC-21-0382.
- Jorde R., Sneve M., Hutchinson M., Emaus N., Figenschau Y., Grimnes G. Tracking of serum 25-hydroxyvitamin D levels during 14 years in a population-based study and during 12 months in an intervention study. Am. J. Epidemiol. 2010. Vol. 171(8). Р. 903-908. doi: 10.1093/aje/kwq005.
- Bjerg L.N., Halgreen J.R., Hansen S.H., Morris H.A., Jørgensen N.R. An evaluation of total 25-hydroxyvitamin D assay standardization: Where are we today? J. Steroid Biochem. Mol. Biol. 2019. Vol. 190. Р. 224-233. doi: 10.1016/j.jsbmb.2019.03.015.
- Vanderwielen R.P., de Groot L.C.P.G.M., van Staveten W.A., et al. Serum vitamin D concentraions among elderly people in Europe. Lancet. 1995. Vol. 346. P. 207-210. DOI: https://doi.org/10.1016/S0140-6736(95)91266-5.
- Povoroznyuk V., Pankiv I. Vitamin D Deficiency and Insufficiency in Population of Bukovyna and Subcarpathia. International Journal оf Endocrinology (Ukraine). 2016. Vol. 4(76). Р. 22-25. https://doi.org/10.22141/2224-0721.4.76.2016.77793.
- Крикливець Л.С., Крикливець С.Ю., Латаш С.О., Медвєдєв О.В. Про рівні вітаміну D у вибірковій когорті хворих ревматологічного профілю консультативної поліклініки Житомира. Український ревматологічний журнал. 2018. № 3 (73).
- Kaminskyi O.V., Pankiv V.I., Pankiv I.V., Afanasyev D.E. Vitamin D content in population of radiologically contaminated areas in Chernivtsi oblast (pilot project). Probl. Radiac. Med. Radiobiol. 2018 Dec. Vol. 23. Р. 442-451. doi: 10.33145/2304-8336-2018-23-442-451. PMID: 30582861.
- Goncharova O.A., Arkhipkina T.L., Bondarenko V.O., Lyubimova L.P. Vitamin D status and features of the immune status in women with autoimmune thyroiditis in the postmenopausal period. Clinical Endocrinology and Enspcrine Surgery. 2020. Vol. 1(69). Р. 51-56. DOI: http://doi.org/10.30978/CEES-2020-1-51 (in Ukrainian).

/52.jpg)