1. Вступ
Хронічна хвороба нирок (ХХН) є однією з глобальних проблем сьогодення в медицині всього світу [1]. На сьогодні повернення до проблеми ХХН дуже важливе, оскільки вона стосується як соціально-економічних, так і загальних медичних аспектів [2].
Відповідно до результатів дослідження, проведеного у 12 країнах із загальною кількістю 75 058 учасників, поширеність ХХН серед дорослих достатньо висока: 14,3 % — у загальній популяції, 36,1 % — у групах високого ризику (артеріальна гіпертензія, цукровий діабет, серцево-судинні захворювання) [3]. Приблизно два мільйони людей мають термінальну стадію хронічної ниркової недостатності, і частка таких захворювань щорічно зростає на 5–7 % [4]. Відповідно до даних Всесвітньої організації охорони здоров’я щорічно 5–10 мільйонів людей помирає через хворобу нирок [5].
Хоча лише приблизно 1 % пацієнтів із ХХН потребує діалізу чи трансплантації нирки, економічні витрати на діаліз і трансплантацію дуже високі в усіх країнах — у середньому 5 % від річного бюджету охорони здоров’я витрачається на 1 % населення [6]. У зв’язку з цим дуже важливо своєчасно виявляти пацієнтів із ХХН, зокрема на перших стадіях надання медичної допомоги, а також забезпечувати профілактику й лікування якомога раніше.
Існує багатий емпіричний та експериментальний досвід застосування фітонірингових препаратів при лікуванні захворювань нирок і сечовидільної системи. Проте доказова база досі недостатня. Фітофармацевтичні препарати успішно використовуються для симптоматичного лікування ХХН, але вони представлені в достатньо вузькому діапазоні попри ряд переваг, включно з м’яким терапевтичним ефектом і набагато меншим переліком побічних ефектів. Отже, актуальним практичним завданням є знаходження шляхів для розширення показань для вже відомих фітотерапевтичних агентів і дослідження можливості їх використання для лікування ХХН.
Відомий у клінічній практиці комбінований рослинний препарат BNO 2103 («Біонорика СЕ», Німеччина) використовується в комплексному лікуванні інфекцій сечових шляхів і для профілактики сечокам’яної хвороби [7, 8]. Такі показання для застосування пов’язані зі складом ліків — комбінація трави золототисячника, листя розмарину й коренів любистку в рівній пропорції. Ці ліки мають не лише прямий діуретичний вплив, але й антибактеріальну, антиоксидантну, спазмолітичну й протизапальну дію. Нефропротекторна дія, протизапальний та анальгетичний вплив препарату були доведені при експериментальному нефриті Хеймана [9], циститі [10] та простатиті [11]. Антиоксидантна дія BNO 2103 при діабетичній нефропатії також була доведена в клінічному дослідженні [12]. У дослідженні серед пацієнтів зі стеатогепатитом із ХХН I–II стадії було підтверджено вірогідне покращення видільної функції нирок на фоні комбінованого застосування BNO 2103 і S-аденозилметіоніну [13]. Також була доведена можливість безпечного використання препарату у вагітних жінок [14–16] і при алергії на антибактеріальні препарати [17]. У той же час на сьогодні кількість сучасних досліджень недостатня для формування переконливої доказової бази, для обґрунтування застосування BNO 2103 при ХХН.
Мета цього дослідження полягає у вивченні нефропротекторних властивостей BNO 2103 на моделі ниркової недостатності (НН) у щурів, щоб довести можливість використання цієї композиції в клінічній практиці для комплексного лікування ХХН.
2. Матеріали та методи
2.1. Тварини
Експериментальне дослідження проводилося на 52 безпородних самцях щурах-альбіносах з масою тіла 180–200 г, яких отримали у віварії Центральної науково-дослідної лабораторії Навчально-наукового інституту прикладної фармації (ЦНДЛ ННІПФ) Національного фармацевтичного університету (НФаУ) (Харків, Україна). Тварини знаходились на стандартному раціоні для щурів і воді ad libitum. Щурів утримували в стандартних лабораторних умовах у добре вентильованому приміщенні за температури 25 ± 1 °C і відносної вологості 55 ± 5 % з регулярними 12-годинними циклами світлого періоду/темряви [18, 19]. Усі дослідження проводилися відповідно до Директиви Ради ЄС 2010/63/ЄС щодо дотримання законів, настанов та адміністративних положень країнами — членами ЄС для захисту тварин, які використовуються для наукової мети [20]. Протоколи експериментів затверджувала комісія з біоетики НФаУ (затвердження № 2 від 4 листопада 2019 р.).
2.2. Об’єкт дослідження і його приготування
Об’єктом дослідження була комбінована фітокомпозиція BNO 2103 (активна речовина препарату Канефрон® Н, код дослідження PM 19-016), яку надавала компанія «Біонорика СЕ» (Ноймаркт, Німеччина). Досліджувана фітокомпозиція складається із суміші таких екстрактів, як трава золототисячника, листя розмарину й корені любистку у формі дрібнодисперсного гігроскопічного порошку коричневого кольору зі специфічним запахом рослинної сировини. Відразу перед застосуванням відповідну суспензію готували з порошку за допомогою розчинника, що містив 0,1 % твіну і 0,5 % цеколу, змішаного за допомогою вихрової мішалки V-1 plus (Biosan, Рига, Латвія).
2.3. Препарати порівняння і їх приготування
Преднізолон по 5 мг у таблетках («Дарниця», м. Київ, Україна) вибрали як перший препарат порівняння з протизапальними, імуносупресивними, антипроліферативними властивостями, що використовується при ХХН, пов’язаній з гломерулопатіями й гломерулосклерозом [21]. Цей об’єкт вводили у формі суспензії, яку готували подібно до BNO 2103.
Пероральний розчин леспефрилу («Лубнифарм», м. Лубни, Україна), рослинний препарат з діуретичною і гіпоазотемічною дією, що містить екстракт леспедези, використовувався як другий препарат порівняння. Настойки леспедези широко використовуються при НН [22]. Цей об’єкт вводили в оригінальній формі без змін.
2.4. Дизайн дослідження
Усіх тварин випадковим чином розподілили на 5 експериментальних груп:
— група 1 — інтактний контроль (ІК) (здорові тварини, які отримували розчинник, n = 10);
— група 2 — контрольна патологія (КП) (неліковані тварини, які отримували розчинник, n = 12);
— група 3 — тварини з НН, які отримували BNO 2103 у дозі 33,0 мг/кг (n = 10);
— група 4 — тварини з НН, які отримували преднізолон у дозі 1,9 мг/кг (n = 10);
— група 5 — тварини з НН, які отримували леспефрил у дозі 3,0 мл/кг (n = 10).
Хромат-індукована нефропатія використовувалась як модель НН [23]. Її відтворювали однократним підшкірним введенням 2,5% розчину калію хромату (Sigma-Aldrich, Сент-Луїс, Міссурі, США) у дозі 0,7 мл/кг
в оригінальній модифікації, як описувалося раніше [24], у перший день експерименту. Починаючи з другого дня експерименту тварини отримували BNO 2103 у дозі 33,0 мг/кг (середня терапевтична доза для людини, екстрапольована відповідно до рекомендацій FDA [25]), преднізолон у дозі 1,9 мг/кг (ED50 за протизапальною дією) і леспефрил у дозі 3,0 мл/кг (n = 10) (середня терапевтична доза для людини, екстрапольована відповідно до рекомендацій FDA). Усі випробовувані зразки вводилися щоденно інтрагастрально протягом 20 днів як суспензії, приготовані в розчиннику. Тварини контрольних груп отримували еквівалентну кількість розчинника. Після завершення дослідження тварин виводили з експерименту під загальною анестезією з використанням кетаміну/ксилазину (75/10 мг/кг інтраперитонеально) [26] для отримання крові для біохімічних аналізів і тканини нирок для гістологічної оцінки.
2.5. Приготування й зберігання біологічних зразків
Зразки крові брали з внутрішньої порожнистої вени й центрифугували зі швидкістю 1500× g за температури 4 °C протягом 10 хвилин за допомогою центрифуги з охолодженням Eppendorf 5702R (Eppendorf AG, Гамбург, Німеччина). Зразки сечі збирали за допомогою індивідуальних обмінних кліток і центрифугували зі швидкістю 500× g протягом 10 хв. Надосадову рідину відділяли й використовували для біохімічних аналізів. Усі зразки крові й сечі заморожували й зберігали за температури –80 °C до використання. Нирки швидко видаляли, піддавали макроскопічному аналізу й зважували. Їх масу використовували для розрахунку масового коефіцієнта нирок (МКН) відносно маси тіла. Нирки фіксували в 10% нейтральному забуференому формаліні й заключали до парафінових блоків для проведення гістологічного дослідження.
2.6. Оцінка функціонального стану нирок
Спонтанний добовий діурез визначали за допомогою індивідуальних обмінних кліток у кінці експерименту у всіх тварин. Вміст білка і його добове виведення визначали в зібраній сечі. Швидкість клубочкової фільтрації оцінювали за ендогенним кліренсом креатиніну (КК), також розраховували канальцеву реабсорбцію (КР) і кліренс сечовини (КС) за допомогою стандартних рівнянь [27]:
КК = Ucr × V/Pcr;
КР = (1 – Pcr/Ucr) × 100 %;
КC = Uur × V/Pur,
де Ucr — концентрація креатиніну в сечі, V — добовий діурез, Pcr — концентрація креатиніну в плазмі, Uur — концентрація сечовини в сечі та Pur — концентрація сечовини в плазмі.
2.7. Біохімічні аналізи
Біохімічні дослідження для оцінювання параметрів видільної функції нирок, метаболізму азоту й білка проводили за допомогою відповідних наборів для біохімічного аналізу, доступних на ринку (High Technology, Inc., Норт-Еттлборо, Массачусетс, США), та автоматичного біохімічного аналізатора Express Plus (Bayer Diagnostics, Леверкузен, Німеччина). Рівні креатиніну й сечовини в крові й сечі визначали за допомогою кінетичного аналізу без депротеїнізації, та за методом ферментного уреазо-глутаматдегідрогеназного УФ-теста відповідно [28]. Також розраховували виведення креатиніну й сечовини із сечею. Загальний білок у крові визначали фотометрично за допомогою біуретового методу, а вміст альбуміну — за реакції з бромкрезоловим зеленим. Концентрацію білка в сечі визначали колориметричним методом з пірогалоловим червоним і молібдатом [29].
2.8. Гістологічне дослідження
Парафінові зрізи (товщиною 5 мкм) розміщували на предметні скельця й забарвлювали Шифф-йодною кислотою (ШИК-реакція). Зрізи вивчали у світловому мікроскопі Optika B-1000BF і фотографували цифровою камерою Optikam HDMI Pro (Optika, Бергамо, Італія) [30]. Для визначення ступеня гломерулосклерозу з 10 канальців ШИК-забарвлених зрізів отримували напівкількісний бал, помноживши ступені мезангіальної експансії, розширення капсули Боумена й сегментарно-глобулярного склерозу (ступінь 0 — немає ушкодження; 1 — ушкодження 25 %; 2 — ушкодження 50 %; 3 — ушкодження 75 %; 4 — ушкодження всієї зони клубочків у полі зору). Ушкодження канальців оцінювали на ШИК-забарвлених зрізах шляхом оцінки в балах некрозу клітин канальців, розширення канальців, накопичення гіалінових циліндрів і втрати щіточкової облямівки в 10 полях зору, що не перекриваються, у кірковому шарі й кортико-медулярному переході. Ураження оцінювали за 5-бальною шкалою (ступінь 0 — немає ушкодження; 1 — ушкодження 1–10 %; 2 — ушкодження 10–25 %; 3 — ушкодження 25–50 %; 4 — ушкодження 50–75 %, 5 — понад 75 % ушкодження). Усі результати для напівкількісних балів усереднювалися [31].
2.9. Статистичний аналіз
Усі результати обробляли за допомогою описової статистики й подавали як середні значення ± стандартна похибка середнього значення (СП). Статистичну різницю між групами аналізували за допомогою однофакторного дисперсійного аналізу ANOVA з апостеріорним тестом Тьюкі [32]. Використовувалося таке програмне забезпечення: IBM SPSS Statistics v. 22 (IBM Corp., Армонк, Нью-Йорк, США) і MS Excel 2016 (Microsoft Corp., Редмонд, Вашингтон, США). Відмінності вважалися статистично вірогідними при p < 0,05.
3. Результати
3.1. Вплив BNO 2103 на функцію нирок у щурів з нирковою недостатністю
Результати дослідження продемонстрували, що в групі КП під впливом калію хромату виникала виражена НН, що проявлялася 25% смертністю тварин, зменшенням маси тіла (p < 0,05 відносно ІК), діурезу, КР і зниженням КК у 2,8 раза. Також спостерігали виражену протеїнурію, що досягала 23,0 мг/доба (табл. 1).
/30_2.jpg)
Під час застосування об’єкта дослідження BNO 2103 у тварин із НН смертність зникла, було зареєстровано збільшення маси тіла й покращення видільної функції нирок порівняно з нелікованими тваринами. Це проявлялося збільшенням діурезу (p < 0,05), КР, зниженням протеїнурії в 1,5 раза й підвищенням КК у 1,7 раза (табл. 1). Під впливом препарату порівняння преднізолону реєструвався менший рівень загальної ефективності порівняно з BNO 2103. Очікувано преднізолон продемонстрував виражений антипротеїнуричний ефект зі зниженням протеїнурії в 1,7 раза, але при цьому він підвищив КК лише на 16,3 % (p < 0,05) (табл. 1). Другий препарат порівняння леспефрил продемонстрував виражений діуретичний ефект, збільшивши діурез і КК у 1,6 раза (p < 0,05). Окрім цього, під його впливом зареєстрували зниження протеїнурії в 1,3 раза (p < 0,05) (табл. 1). Порівняно з преднізолоном композиція BNO 2103 підвищувала діурез на 35,7 %, а КК — на 44,9 % (p < 0,05). Очікувано композиція BNO 2103 виявилася менш ефективною порівняно з леспефрилом щодо діуретичної дії, але вона була на 86,9 % ефективнішою щодо зниження рівня протеїнурії (p < 0,05).
3.2. Вплив BNO 2103 на виведення залишкового азоту в щурів з нирковою недостатністю
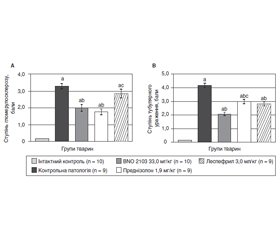
Погіршення функціонального стану нирок у групі КП спричинило зменшення виведення азотистих сполук і підвищення вмісту залишкового азоту в крові тварин. Отже, виведення креатиніну й сечовини зменшилося (p < 0,05) відповідно на 16,6 і 21,9 %, а показник КС знизився в три рази (рис. 1, 2).
Вміст креатиніну й сечовини в крові підвищився (p < 0,05) у 2,3–2,4 раза порівняно з групою ІК (табл. 2).
Під впливом BNO 2103 спостерігались позитивні зміни показників азотистого обміну. Досліджуваний препарат підвищував (p < 0,05) виведення креатиніну із сечею на 17,4 %, сечовини — на 15,7 %, а КС — у 1,7 раза відповідно (рис. 1, 2). У результаті рівень креатиніну й сечовини в крові знизився (p < 0,05) у 1,4–1,5 раза, що вказує на зменшення проявів азотемії і нормалізацію азотистого обміну. Відповідно преднізолон підвищував КC на 19,0 % і не мав вірогідного впливу на виведення азотистих сполук (рис. 1, 2). У результаті рівень креатиніну в крові підвищився лише на 10,5 % (p < 0,05), а рівень сечовини змінився незначно. Леспефрил мав помірний гіпоазотемічний вплив, підвищивши (p < 0,05) виведення креатиніну на 14,9 %, а КC — на 43,0 % (рис. 1, 2), у той час як рівень креатиніну й сечовини в крові знизився в 1,4 раза. Порівняно з преднізолоном композиція BNO 2103 підвищила кліренс сечовини на 45,3 % (p < 0,05). Також композиція BNO 2103 перевищила показник преднізолону (p < 0,05) на 21,9 і 26,0 % щодо впливу на креатинін і сечовину крові відповідно. Окрім цього, композиція BNO 2103 підвищувала рівень КC на 22 % ефективніше, ніж леспефрил (p < 0,05).
/31_2.jpg)
3.3. Вплив BNO 2103 на вміст білка в крові щурів з нирковою недостатністю
У результаті стійкої протеїнурії в групі КП було зареєстровано зниження (p < 0,05) загального білка й альбуміну в крові на 12,5 і 28,3 % відповідно, що вказує на селективний характер протеїнурії (табл. 2). Під впливом BNO 2103 рівні загального білка й альбуміну в крові знизилися на 9,7 і 28,0 % відповідно (p < 0,05), що пов’язано з антипротеїнуричною дією BNO 2103 (табл. 2). Через антипротеїнуричну дію преднізолону реєстрували підвищення (p < 0,05) загального білка й альбуміну в крові на 6,8 і 35,0 % відповідно (табл. 2). Проте при застосуванні леспефрилу не було зареєстровано вірогідного впливу на виведення й метаболізм білка (табл. 2). Композиція BNO 2103 була на 86,9 % більш ефективною щодо зниження рівня протеїнурії і на 15,6 % вірогідніше підвищувала рівень альбуміну в крові порівняно з леспефрилом (p < 0,05).
3.4. Вплив BNO 2103 на масу й гістоструктуру нирок
У результаті активного запалення й деструктивних процесів у групі КП реєстрували вірогідне підвищення показника МКН на 42,0 % (p < 0,05). Під впливом BNO 2103 цей показник знизився до рівня ІК (p < 0,05), при цьому вплив досліджуваного об’єкта був майже таким самим, як і препаратів порівняння, без вірогідних відмінностей (рис. 3).
/32.jpg)
Гістологічне дослідження ниркової тканини в групі КП (рис. 4B) виявило вірогідні патологічні зміни порівняно з ІК (рис. 4A). У цьому разі впливу зазнала як гломерулярна (стоншення парієтального листка й розширення сечового простору в капсулі Боумена — Шумлянського, проліферація мезангію, розвиток гломерулосклерозу), так і тубулярна зона (розширення просвіту канальців, накопичення гіалінових циліндрів у них, втрата щіточкової облямівки епітелію канальців і його десквамація). Ступінь гломерулосклерозу становив 3,3 бала (рис. 5А), а ураження канальців — 4,3 (рис. 5B). Комбінація BNO 2103 сприяла збереженню цитоархітектоніки ниркової тканини, як гломерулярного, так і тубулярного компонента нефрона. Під впливом цієї комбінації товщина стінки капсули Боумена — Шумлянського й кількість мезангіальних клітин зменшувалися, щіточкова облямівка епітеліальних клітин канальців добре забарвлювалася, а відкладення гіаліну майже не виявлялися (рис. 4C). Показник гломерулярного склерозу знизився на 39,4 %, а тубулярного ураження — на 48,8 % (p < 0,05). Препарат порівняння преднізолон мав такий самий рівень впливу на клубочки, як і композиція BNO 2103, але його ефект був меншим на канальцеву зону ниркової тканини (рис. 4D), у той час як під його впливом показник ураження канальців був на 36,4 % вищий (p < 0,05). Леспефрил мав позитивний вплив на ниркову тканину, зокрема на канальці, але чинив поганий вплив на клубочки нефронів порівняно з BNO 2103.
/33.jpg)
При цьому спостерігалось стоншення зовнішнього шару капсули Боумена — Шумлянського й активна проліферація мезангіальних клітин (рис. 4E); ступінь гломерулосклерозу становив 2,9 бала, що на 45 % вище, ніж для BNO 2103 (p < 0,05), і не відрізняється від групи КП (рис. 5А).
4. Обговорення
Результати дослідження довели, що комплексний фітоніринговий препарат BNO 2103 має виражений позитивний вплив на перебіг НН. У разі його використання спостерігається покращення фізичного стану щурів і підвищення їх виживаності до 100 % (проти 75 % у групі КП). Також у щурів відбувається посилення видільної функції нирок, вірогідне підвищення діурезу, інтенсивності клубочкової фільтрації і канальцевої реабсорбції, а також зниження протеїнурії. Це призвело до підвищення виведення залишкового азоту із сечею і зниження його вмісту в крові. Окрім цього, через антипротеїнуричну дію BNO 2103 реєстрували підвищення вмісту загального білка в крові, переважно за рахунок альбуміну, що пояснюється не лише зниженням виведення білка з сечею, але й підвищенням селективності протеїнурії. Загалом все перелічене вище вказує на підвищення резистентності нефронів до несприятливих умов патологічно змінених нирок, відновлення їх фільтраційно-реабсорбційної функції, що разом обумовлює нефропротекторний ефект. Найвищої об’єктивності отриманим результатам надають докази, отримані завдяки гістологічній оцінці, що підтверджують нефропротекторні властивості BNO 2103 і вказують на гарне збереження цитоархітектоніки ниркової тканини під впливом цієї композиції, зниження ступеня гломерулосклерозу й ураження канальців. Гіпоазотемічний вплив BNO 2103 пояснюється покращенням гломерулярної гемодинаміки, що сприяє підвищеному виведенню продуктів обміну азоту із сечею під впливом процесів фільтрації.
Описані вище фармакологічні властивості BNO 2103 визначаються комплексом біологічно активних сполук (флавоноїдів, фенольних кислот, ефірних олій), що містяться в рослинній сировині об’єкта дослідження — у траві золототисячника, листі розмарину й корені любистку [33, 34]. Імовірно, ключовим фармакологічним ефектом, що лежить в основі нефропротекторних властивостей BNO 2103, є протизапальний вплив. Відомо, що розмаринова кислота, яка є головною діючою речовиною BNO 2103, пригнічує неспецифічну активацію комплементу й ліпоксигенази, у результаті пригнічується синтез лейкотрієнів і розривається ланцюг реакцій за участю вільних радикалів [35]. Протизапальні властивості BNO 2103 також були виявлені в ряді проведених раніше експериментальних і клінічних досліджень, де вони сприяли загалом позитивному впливу на перебіг циститу [10, 11, 17].
Отримані результати корелюють з результатами дослідження [12], у якому було продемонстровано нефропротекторний вплив BNO 2103, що проявлявся зменшенням проникності клубочкових капілярів та антипротеїнуричним ефектом у пацієнтів з діабетичною нефропатією. Подібні висновки про нефропротекторні й протизапальні властивості BNO 2103 були отримані в експериментальному дослідженні на моделі нефриту Хеймана [9]. У нашому експерименті фітонірингова композиція BNO 2103 також продемонструвала вірогідний вплив на посилення процесів ниркової фільтрації, що відповідає результатам клінічного дослідження серед пацієнтів з комбінацією ХХН I–II стадії і стеатогепатиту [13].
При зіставленні ефективності об’єкта дослідження з препаратами порівняння було виявлено, що BNO 2103 був вірогідно ефективнішим, ніж преднізолон, щодо впливу на видільну функцію нирок, екскреції залишкового азоту і його рівня в крові. Він також вірогідно був ефективнішим, ніж леспефрил, щодо впливу на протеїнурію, показник КC і білковий обмін. У зв’язку з цим фармакодинамічний спектр BNO 2103 поєднує найбільш корисні ефекти референс-препаратів — нефропротекторний, гіпоазотемічний, протизапальний, антипротеїнуричний і діуретичний. Отже, BNO 2103 має більш збалансовані фармакологічні властивості для лікування патології нирок, ніж препарати порівняння.
Важливість і доцільність цього дослідження полягає в розширенні показань для застосування вже відомого фітопрепарату BNO 2103, щоб розширити групу лікування пацієнтів із ХХН, які потребують ефективної, своєчасної і безпечної терапії. ХХН — це багатофакторне захворювання, патогенез якого варіює залежно від первинної патології, але в будь-якому разі найбільш поширеним результатом є НН. З цієї причини в цьому дослідженні вибрали відповідну експериментальну модель. У цій роботі не розглядали проблеми комбінованої терапії BNO 2103 з іншими препаратами для лікування ХХН і застосування фітонірингового препарату для лікування ХХН у комбінації з іншими захворюваннями. Окрім цього, результати цього дослідження базуються на біохімічних, лабораторних, гістоморфологічних аналізах та функціональних показниках нирок. Через це в перспективі ми проведемо імуногістохімічну оцінку ефективності BNO 2103, щоб отримати більш переконливі докази.
5. Висновки
В умовах розвитку НН у щурів досліджувана фітонірингова композиція BNO 2103 покращує фізичний стан тварин, зменшує їхню смертність, покращує видільну функцію нирок, нормалізує азотистий й білковий обмін, сприяє захисту структури ниркової тканини, а отже, має позитивний вплив на перебіг нефропатії. У той же час композиція BNO 2103 не тільки не поступається, а за деякими показниками перевищує препарати порівняння, такі як преднізолон і леспефрил. Отже, в експериментальних дослідженнях композиція BNO 2103 мала виражену нефропротекторну й гіпоазотемічну дію і є перспективним засобом для лікування ХХН. Окрім цього, досі залишаються невстановленими точні механізми дії BNO 2103, а також варіанти імунозабарвлення для апоптозу ниркової тканини й маркери запалення подоцитів при НН.
Рекомендується провести подальше дослідження BNO 2103 у доклінічних і клінічних умовах, щоб розширити доказову базу, а також провести пошук можливих безпечних та ефективних комбінацій з препаратами, які потенціюють вплив BNO 2103, що може розглядатися як базова комбінована терапія для патології нирок.
Внесок авторів. Складення концепції — С.К.Ш. і К.О.З.; методологія — С.К.Ш; програмне забезпечення — С.К.Ш., валідація — С.К.Ш. і К.О.З.; формальний аналіз — С.К.Ш. і В.В.Ч.; дослідження — С.К.Ш. і В.В.Ч.; ресурси — С.К.Ш.; курування даних — С.К.Ш.; написання — приготування оригінального чорнового варіанта — В.В.Ч.; написання — перегляд і редагування — С.К.Ш. і К.О.З.; візуалізація — С.К.Ш., нагляд — К.О.З.; адміністрування проєкту — К.О.З.; залучення фінансування — К.О.З. Усі автори прочитали опубліковану версію рукопису й погодили її.
Фінансування. Це дослідження фінансувала компанія «Біонорика СЕ».
Подяки. Автори вдячні персоналу й керівнику ЦНДЛ ННІПФ (Харків, Україна), кафедрі клінічної фармакології та клінічної фармації НФаУ (Харків, Україна), клініко-діагностичній лабораторії (Харків, Україна) та завідувачу кафедри клінічної фармакології та клінічної фармацевтики І.А. Зупанцю за надання матеріалу й технічної бази для проведення дослідження.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів. Спонсори не брали участі в розробці дизайну дослідження, зборі, аналізі або інтерпретуванні даних, написанні рукопису або прийнятті рішення про публікування результатів.
Список литературы
1. Grams M.E., Levey S.A., Coresh J. Epidemiology of Kidney Disease. Brenner and Rector’s The Kidney, 11th ed.; Yu A.S.L., Chertow G.M., Luyckx V.A., Marsden P.A., Skorecki K., Taal M.W., Wasser W.G., Eds.; Elsevier: Philadelphia, PA, USA, 2020. Vol. 1. Р. 616-639.e5. ISBN 978-0-323-75933-5.
2. Zhou Y., Yang J. Chronic Kidney Disease: Overview. Chronic Kidney Disease: Diagnosis and Treatment; Yang J., He W., Eds.; Springer: Singapore, 2020. Р. 3-12. ISBN 978-981-32-9131-7.
3. Ene-Iordache B., Perico N., Bikbov B., Carminati S., Remuzzi A., Perna A., Islam N., Bravo R., Aleckovic-Halilovic M., Hequn Z. et al. Chronic kidney disease and cardiovascular risk in six regions of the world (ISN-KDDC): A cross-sectional study. Lancet Glob. Health. 2016. 4. e307-e319.
4. Wang H., Naghavi M., Allen C., Barber R.M., Bhutta Z.A., Carter A., Casey D.C., Charlson F.J., Chen A.Z., Coates M.M. et al. Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980–2015: A systematic analysis for the Global Burden of Disease Study 2015. Lancet. 2016. 388. 1459-1544.
5. Luyckx V., Tonelli M.; Stanifer J. The global burden of kidney disease and the sustainable development goals. Bull. World Health Organ. 2018. 96. 414-422D.
6. Kidney Disease: Improving Global Outcomes (KDIGO) CKDWork Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int. Suppl. 2013. 3. 1-150.
7. Ceban E. Efficacy of a fixed combination of Centaurii herba, Levistici radix and Rosmarini folium in urinary lithiasis. Z. Phytother. 2012. 33. 19-23.
8. Ivanov D., Abramov-Sommariva D., Moritz K., Eskötter H., Kostinenko T., Martynyuk L., Kolesnik N., Naber K.G. An open label, non-controlled, multicentre, interventional trial to investigate the safety and efficacy of Canephron® N in the management of uncomplicated urinary tract infections (uUTIs). Clin. Phytosci. 2015. 1. 7.
9. Sivak K.V., Lesiovskaya E.E., Stosman K.I., Savateeva-Lubimova T.N. Efficiency of Canephron N in complex treatment of experimental heymann glomerulonephritis. Clin. Phytosci. 2017. 2. 5.
10. Wagenlehner F., Abramov-Sommariva D., Höller M., Steindl H., Naber K. Non-Antibiotic Herbal Therapy (BNO 1045) versus Antibiotic Therapy (Fosfomycin Trometamol) for the Treatment of Acute Lower Uncomplicated Urinary Tract Infections inWomen: A Double-Blind, Parallel-Group, Randomized, Multicentre, Non-Inferiority Phase III Trial. Urol. Int. 2018. 101. 327-336.
11. Nausch B., Pace S., Pein H., Koeberle A., Rossi A., Künstle G., Werz O. The standardized herbal combination BNO 2103 contained in Canephron® N alleviates inflammatory pain in experimental cystitis and prostatitis. Phytomedicine. 2019. 60. 152987.
12. Martynyuk L., Martynyuk L., Ruzhitska O., Martynyuk O. Effect of the Herbal Combination Canephron N on Diabetic Nephropathy in Patients with Diabetes Mellitus: Results of a Comparative Cohort Study. J. Altern. Complement. Med. 2014. 20. 472-478.
13. Antoniv A. Optimization of Treating Nonalcoholic Steatohepatitis with Obesity and Chronic Kidney Disease of the I–II Stages. JMBS. 2018. 3. 83-87.
14. Medved V. Safety of Canephron® N for the treatment of urinary tract infections in the first trimester of pregnancy. Clin. Phytosci. 2015. 1. 11.
15. Lokshin K. Comparative effectivenesss of standard antibiotic therapy and Canephron N asymptomatic bacteriuria in pregnant women. Urologiia. 2018. 3. 54-57.
16. Davidson A.V., Neymark A.I. Evaluation of the Effectiveness of the Herbal Remedies Canephron N Application in the Complex Treatment of Patients with Chronic Cystitis. Eff. Pharmacother. 2019. 15. 20-23.
17. Davidov M.I., Voitko, D.A., Bunova N.E. Treatment of acute uncomplicated cystitis in women with antibiotic allergy or intolerance. Urologiia. 2019. 5. 64-71.
18. National Research Council (US). Guide for the Care and Use of Laboratory Animals, 8th ed.; The National Academies Press: Wa–shington, DC, USA, 2011; ISBN 978-0-309-15400-0.
19. Faith R.E., Allen K.P., Hessler J.R. Housing and Environment. The Laboratory Rat, 3rd ed.; Suckow M.A., Hankenson F.G., Wilson R.P., Foley P.L., Eds.; Academic Press: London, UK, 2020. Р. 349-417. ISBN 978-0-12-814338-4.
20. The European Parliament and the Council of the European Union. Directive 2010/63/EU of the European Parliament and of the Council of 22 September 2010 on the protection of animals used for scientific purposes (Text with EEA relevance). Off. J. Eur. Union. 2010. 53. 33-79.
21. Appel G.B., D’Agati V.D. Primary and Secondary (Non-Genetic) Causes of Focal and Segmental Glomerulosclerosis. Comprehensive Clinical Nephrology, 6th ed.; Feehally J., Floege J., Tonelli M., Johnson R.J., Eds.; Elsevier: Philadelphia, PA, USA, 2019. Р. 219-231. ISBN 978-0-323-47909-7.
22. Yarnell E.L. Botanical Medicines Used for Kidney Disease in the United States. Iran. J. Kidney Dis. 2012. 6. 407-418.
23. Wedeen R.P., Qian L.F. Chromium-induced kidney disease. Environ. Health Perspect. 1991. 92. 71-74.
24. Shebeko S., Zupanets I., Zimina M. Dose-dependent efficacy of the N-acetylglucosamine and quercetin combination in rats with renal failure. Acta Pharm. Sci. 2020. 58. 154-168.
25. Estimating the Maximum Safe Starting Dose in Initial Clinical Trials for Therapeutics in Adult Healthy Volunteers. Available online: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/estimating-maximum-safe-starting-dose-initial-clinical-trials-therapeutics-adult-healthy-volunteers (accessed on 10 August 2020).
26. Flecknell P.A. Laboratory Animal Anesthesia, 4th ed.; Academic Press: London, UK, 2015. ISBN 978-0-12-800036-6.
27. Koeppen B.M., Stanton B.A. Renal Physiology, 6th ed.; Elsevier: Philadelphia, PA, USA, 2019; ISBN 9780323595681.
28. Lamb E.J., Jones G.R.D. Kidney Function Tests. In Tietz Fundamentals of Clinical Chemistry and Molecular Diagnostics, 8th ed.; Rifai N., Horvath A.R., Wittwer C.T., Eds.; Elsevier: St. Louis, MO, USA, 2019. Р. 359–376. ISBN 978-0-323-53044-6.
29. Blamires T.L. Amino Acids and Proteins. Clinical Chemistry: Principles, Techniques, and Correlations, 8th ed.; Bishop M.L., Fody E.P., Schoe L.E., Eds.; Wolters Kluwer: Philadelphia, PA, USA, 2018. Р. 203-243. ISBN 9781496335586.
30. Bancroft J.D. Light microscopy. In Bancroft’s Theory and Practice of Histological Techniques, 8th ed.; Suvarna S.K., Layton C., Bancroft J.D., Eds.; Elsevier: St. Louis, MO, USA, 2019. Р. 25-39.
31. Wang Y., Niu M., Yin S., Zhang, F., Shi R. Nephroprotective effects of nebivolol in 2K1C rats through regulation of the kidney ROS-ADMA-NO pathway. Pharmacol. Rep. 2018. 70. 917-929.
32. Islam M.A., Al-Shiha A. Foundations of Biostatistics; Springer: Singapore, 2018. ISBN 978-981-10-8627-4.
33. Naber K.G. Efficacy and safety of the phytotherapeutic drug Canephron® N in prevention and treatment of urogenital and gestational disease: Review of clinical experience in Eastern Europe and Central Asia. Res. Rep. Urol. 2013. 5. 39-46.
34. Gaybullaev A.A., Kariev S.S. Effects of the herbal combination Canephron N on urinary risk factors of idiopathic calcium urolithiasis in an open study. Z. Phytother. 2013. 34. 16-20.
35. Scheckel K.A., Degner S.C., Romagnolo D.F. Rosmarinic Acid Antagonizes Activator Protein-1-Dependent Activation of Cyclooxygenase-2 Expression in Human Cancer and Nonmalignant Cell Lines. J. Nutr. 2008. 138. 2098-2105.
/31.jpg)
/32.jpg)

/30_2.jpg)
/30.jpg)
/31_2.jpg)
/33.jpg)
/34.jpg)