Архив офтальмологии Украины Том 7, №3, 2019
Вернуться к номеру
Вплив тромбоцитарного фактора росту (PDGF) на розвиток рецидивівпри хірургічному лікуванні діабетичної макулопатії у хворихна цукровий діабет 2-го типу
Авторы: Панченко Ю.О.(1, 2, 4), Могілевський С.Ю.(1), Зябліцев С.В.(3)
(1) — Київська міська клінічна офтальмологічна лікарня «Центр мікрохірургії ока», м. Київ, Україна
(2) — Національна медична академія післядипломної освіти імені П.Л. Шупика МОЗ України, м. Київ, Україна
(3) — Національний медичний університет імені О.О. Богомольця МОЗ України, м. Київ, Україна
(4) — Медичний центр «Лазер Плюс», м. Львів, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
Актуальність. Нині проводяться пошуки та ідентифікація факторів ризику розвитку та факторів прогнозу діабетичної макулопатії (ДМП) у хворих на цукровий діабет 2-го типу (ЦД2). Тромбоцитарний фактор росту (Platelet-Derived Growth Factor — PDGF) є важливим регуляторним поліпептидом, який в умовах гіпоксії та ішемії стимулює проліферацію ендотеліальних клітин і неоангіогенез, підвищує проникність капілярів. Це обґрунтовує необхідність його досліджень при діабетичних ушкодженнях сітківки при ЦД2. Мета: визначити вплив PDGF на розвиток рецидивів при хірургічному лікуванні діабетичної макулопатії у хворих на ЦД2. Матеріали та методи. Під нашим спостереженням перебували 313 хворих на ЦД2 (313 очей) із ДМП та початковою (1-ша група; n = 40), помірною або тяжкою непроліферативною діабетичною ретинопатією (НПДР; 2-га група; n = 92) та проліферативною діабетичною ретинопатією (ПДР; 3-тя група; n = 181). Рівень тяжкості ДР і ДМП встановлювали відповідно до Міжнародної клінічної шкали тяжкості діабетичної ретинопатії і діабетичної макулопатії Американської академії офтальмології (2002): 78 хворим (78 очей) провели закриту субтотальну вітректомію; 85 хворим (85 очей) — закриту субтотальну вітректомію з пілінгом внутрішньої пограничної мембрани сітківки; 81 хворому (81 око) — закриту субтотальну вітректомію з пілінгом внутрішньої пограничної мембрани сітківки у поєднанні з панретинальною лазеркоагуляцією; 69 хворим (69 очей) — факоемульсифікацію катаракти у поєднанні із закритою субтотальною вітректомією, пілінгом внутрішньої пограничної мембрани сітківки та панретинальною лазеркоагуляцією. У крові всіх пацієнтів до хірургічного втручання було визначено рівень PDGF-BB методом імуноферментного аналізу (R&D Systems, США). У контрольну групу увійшли 95 осіб. Для статистичної обробки отриманих даних використовували програму Statistica 10 (StatSoft, Inc., США). Результати. Встановлено, що вміст PDGF у крові хворих на ЦД2 із ДМП був підвищеним при помірній та вираженій НПДР (2-га група) та при ПДР (3-тя група) у порівнянні з контролем у 1,6 та 2,2 раза відповідно (p < 0,001). За наявності рецидивів уміст PDGF у крові до початку хірургічного лікування ДМП був значуще вище (у 1,3–1,4 раза; p < 0,001), ніж за їх відсутності. Була побудована регресійна модель розрахунку ймовірності розвитку рецидивів хірургічного лікування ДМП залежно від початкового рівня у крові PDGF з точністю прогнозу 89,8 % (p < 0,001); критичний рівень PDGF для розвитку рецидивів становив 51,8 нг/мл. Висновки. Отримані результати довели патогенетичне значення PDGF у прогресуванні ДМП, а також його значення для виникнення рецидивів хірургічного лікування.
Актуальность. В настоящее время проводятся поиски и идентификация факторов риска развития и факторов прогноза диабетической макулопатии (ДМП) у больных с сахарным диабетом 2-го типа (СД2). Тромбоцитарный фактор роста (Platelet-Derived Growth Factor — PDGF) является важным регуляторным полипептидом, который в условиях гипоксии и ишемии стимулирует пролиферацию эндотелиальных клеток и неоангиогенез, повышает проницаемость капилляров. Это обосновывает необходимость его исследований при диабетических повреждениях сетчатки при СД2. Цель: изучить влияние тромбоцитарного фактора роста (PDGF) на развитие рецидивов при хирургическом лечении диабетической макулопатии у больных сахарным диабетом 2-го типа. Материалы и методы. Под наблюдением находились 313 больных СД2 (313 глаз) с ДМП и начальной (1-я группа; n = 40), умеренной или тяжелой непролиферативной диабетической ретинопатией (НПДР; 2-я группа; n = 92) и пролиферативной диабетической ретинопатией (ПДР; 3-я группа; n = 181). Степень тяжести ДР и ДМП устанавливали в соответствии с Международной клинической шкалой тяжести диабетической ретинопатии и диабетической макулопатии Американской академии офтальмологии (2002): 78 больным (78 глаз) выполнили закрытую субтотальную витрэктомию; 85 больным (85 глаз) — закрытую субтотальную витрэктомию с пилингом внутренней пограничной мембраны сетчатки; 81 больному (81 глаз) — закрытую субтотальную витрэктомию в сочетании с панретинальной лазеркоагуляцией; 69 больным (69 глаз) — факоэмульсификацию катаракты в сочетании с закрытой субтотальной витрэктомией, пилингом внутренней пограничной мембраны сетчатки и панретинальной лазеркоагуляцией. В крови всех пациентов до хирургического вмешательства был определен уровень PDGF-BB методом иммуноферментного анализа (R&D Systems, США). В контрольную группу вошли 95 человек. Для статистической обработки полученных данных использовали программу Statistica 10 (StatSoft, Inc., США). Результаты. Установлено, что содержание PDGF в крови больных СД2 с ДМП было повышенным при умеренной и выраженной НПДР (2-я группа) и при ПДР (3-я группа) по сравнению с контролем в 1,6 и 2,2 раза соответственно (p < 0,001). При наличии рецидивов содержание PDGF в крови до начала хирургического лечения ДМП было значимо выше (в 1,3–1,4 раза; p < 0,001), чем при их отсутствии. Была построена регрессионная модель расчета вероятности развития рецидивов хирургического лечения ДМП в зависимости от исходного уровня в крови PDGF с точностью прогноза 89,8 % (p < 0,001); критический уровень PDGF для развития рецидивов составил 51,8 нг/мл. Выводы. Полученные результаты доказали патогенетическое значение PDGF в прогрессировании ДМП, а также его значение для возникновения рецидивов хирургического лечения.
Background. At present the risk factors and predictor factors for diabetic maculopathy (DMP) in patients with type 2 diabetes mellitus (DM2T) are being researched and identified. Platelet derived growth factor (PDGF) is an important regulatory polypeptide, which under conditions of hypoxia and ischemia stimulates the proliferation of endothelial cells and angiogenesis and increases the capillary permeability. This substantiates the need of its research in diabetic damage to the retina in DM2T. The purpose was to determine the effect of PDGF on development of relapses in the surgical treatment of DMP using a variety of options of vitreoretinal intervention in DM2T patients. Material and methods. The study included 313 DM2T patients (313 eyes) with DMP and primary (group 1; n = 40), moderate-to-severe non-proliferative diabetic retinopathy (NPDR; group 2; n = 92) and proliferative diabetic retinopathy (PDR; group 3; n = 181). The severity of DR and DMP was assessed in accordance with the recommendations of the American Academy of Ophthalmology (2002). In this study, patients received four types of surgical treatment: 78 patients underwent three-ports closed subtotal vitrectomy; in 85 patients peeling of the internal limiting membrane was additionally performed; 81 patients underwent panretinal laser coagulation along with the mentioned above methods and 69 patients underwent additional cataract phacoemulsification. In all patients before surgery the PDGF-BB blood level was identified by ELISA (R&D Systems, USA). The control group consisted of 95 people. The obtained data were statistically processed using the program Statistica 10 (StatSoft, Inc., USA). Results. It was established that the content of blood PDGF in DM2T/DMP patients was increased in moderate-to-severe NPDR (group 2) and in PDR (group 3) compared to control by 1.6 and 2.2 times, respectively (p < 0.001). In the presence of relapses, the content of blood PDGF before the surgical DMP treatment was significantly higher (1.3–1.4 fold; p < 0.001) than in their absence. There was developed the regression model for calculating the probability of DMP surgical treatment relapses depending on the initial PDGF blood level with predictive accuracy 89.8 % (p < 0.001); the PDGF critical level for the relapses development was 51.8 ng/ml. Conclusions. The obtained results confirmed the pathogenetic importance of PDGF in the DMP progression and also its value for the surgical treatment relapses.
діабетична макулопатія; цукровий діабет 2-го типу; тромбоцитарний фактор росту; хірургічне лікування; рецидив
диабетическая макулопатия; сахарный диабет 2-го типа; тромбоцитарный фактор роста; хирургическое лечение; рецидив
diabetic maculopathy; diabetes mellitus 2 type; platelet derived growth factor; surgery; relapse
Вступ
На цей час проводяться пошуки та ідентифікація факторів ризику розвитку та факторів прогнозу діабетичної макулопатії (ДМП) у хворих на цукровий діабет 2-го типу (ЦД2) [1–4]. До таких факторів зараховують тривалість і тяжкість захворювання (понад 6 років, середньотяжкий та тяжкий перебіг із переходом на інсулінотерапію), ожиріння, розвиток артеріальної гіпертензії [5, 6]. Безумовно, крім клінічних факторів, важливе та вкрай перспективне значення має виявлення патофізіологічних змін регуляторних молекулярних факторів щодо розвитку та прогресування ДМП. Перспективним є дослідження проагрегантного стану тромбоцитів (Тц), який ініціює тромбози та геморагії судин сітківки, ішемію нейросенсорних клітин і глії, розвиток запалення й акумуляцію інтерстиціальної рідини [7]. У наших попередніх дослідженнях була показана роль проагрегантного статусу тромбоцитів при ДМП та можливість прогнозування ризику діабетичної ретинопатії (ДР) та діабетичного макулярного набряку (ДМН) на підставі визначення показників функціонального стану рецепторів тромбоцитів [8, 9].
У продовження даного наукового напрямку увагу привертає важливий регуляторний поліпептид — тромбоцитарний фактор росту (Platelet-Derived Growth Factor — PDGF), який є трансмембранним глікопротеїдом з мітогенними властивостями [10]. Існує три ізоформи PDGF: АА, ВВ і АВ, які є продуктами генів, що належать до суперсімейства PDGF/VEGF. Джерелом PDGF у крові є α-гранули тромбоцитів, а у тканинах — фібробласти, гладком’язові клітини, астроцити [11, 12]. PDGF-ВВ продукується активованими макрофагами та неоангіогенним ендотелієм та, на відміну від інших ізоформ, які швидко виводяться з клітини, лишається асоційованим із нею [13].
PDGF-ВВ є активатором хемотаксису, клітинної проліферації й експресії генів, що її регулюють. Особливо важливу роль PDGF-ВВ відіграє в умовах гіпоксії та ішемії, коли стимулює проліферацію ендотеліальних клітин та неоангіогенез, підвищує проникність капілярів [10–12]. Специфічна для сітківки експресія PDGF-BВ у трансгенних мишей призводить до тяжкої неоваскуляризації та відшарування сітківки, що типово для ішемічної ретинопатії [14].
Мета дослідження: визначити вплив тромбоцитарного фактора росту (PDGF) на розвиток рецидивів при хірургічному лікуванні діабетичної макулопатії у хворих на цукровий діабет 2-го типу.
Матеріали та методи
Під нашим спостереженням перебували 313 хворих на ЦД2 (313 очей) із ДМП та початковою (1-ша група; n = 40), помірною або тяжкою непроліферативною діабетичною ретинопатією (НПДР; 2-га група; n = 92) та проліферативною діабетичною ретинопатією (ПДР; 3-тя група; n = 181).
Усім хворим було проведено загальноприйняті офтальмологічні дослідження, що включали візометрію, статичну периметрію Humphrey, рефрактометрію, тонометрію, біомікроскопію, гоніоскопію, офтальмоскопію за допомогою асферичної лінзи Volk Super/Field (NC, США) і контактної трьохдзеркальної лінзи Гольдмана. Всім хворим виконували спектрально-доменну оптичну когерентну томографію (ОСТ) на приладі Optopoltechnology, SOCT, Copernicus REVO (протокол Retina3D, Retina Raster) і ОСТ у ангіорежимі (протокол RetinaAngio, wide 6 × 6 mm). Також проводили дослідження очного дна на фундус-камері з його фотографуванням у 7 стандартних полях відповідно до модифікованої ETDRS системи клінічних ознак Airlie House. Флюоресцентну ангіографію (ФАГ) виконували на апараті TOPCON TRS-NW7SF за показаннями (у разі підозри на початкову ретиновітреальну проліферацію чи неоваскуляризацію, яку не було ідентифіковано офтальмоскопічно і на фотографіях очного дна, а також у разі невідповідності зорових функцій офтальмоскопічним змінам у макулярній області або даним ОСТ).
Рівень тяжкості ДР і ДМП встановлювали відповідно до Міжнародної клінічної шкали тяжкості діабетичної ретинопатії і діабетичної макулопатії Американської академії офтальмології (2002) [15].
Показаннями до проведення закритої субтотальної вітректомії були: прогресуюче зниження гостроти зору, зміни поля зору в центральних і парацентральних відділах, зміни якості зору на фоні непроліферативної діабетичної ретинопатії з рефрактерним макулярним набряком або макулярним набряком з наявністю тангенціальних тракцій, які з’явились внаслідок неповного відшарування задньої гіалоїдної мембрани склоподібного тіла, а також проліферативної діабетичної ретинопатії з рефрактерним макулярним набряком, наявністю епіретинальних мембран і тангенціальних та осьових тракцій сітківки і загрозою тракційного відшарування сітківки, а також наявністю гемофтальма, преретинальних і субгілоїдальних крововиливів.
78 хворим (78 очей) виконували трьохпортову закриту субтотальну вітректомію 25+ на апараті Constellation Vision System (Alcon, США). Ендолазерним зондом 25 Ga здійснювали ендолазеркоагуляцію винятково у місцях, де були видалені вітреоретинальні тракції, з подальшою заміною рідини на стерильне повітря. У вітреальну порожнину вводили газоповітряну суміш 18% С3F8. Видаляли троакари та герметизували порти.
85 хворим (85 очей) під час виконання трьохпортової закритої субтотальної вітректомії 25+ було додатково проведено пілінг внутрішньої пограничної мембрани (ВПМ) у макулярній ділянці діаметром 2,5–3,5 мм з попереднім введенням у вітреальну порожнину барвника Membran Blue для чіткої візуалізації мембрани.
81 хворому (81 око) під час трьохпортової закритої субтотальної вітректомії 25+ з пілінгом внутрішньої пограничної мембрани сітківки була проведена панретинальна лазеркоагуляція (ПРЛК), яку виконували на ендолазері PurePoint (Alcon, США) ендолазерним зондом 25 Ga; параметри лазерної плями були вибрані відповідно до пігментації тканини сітківки до формування опіка середньої інтенсивності (2–3-го ступеня), що коливались у межах: потужність випромінювання — 100–200 мВт, тривалість імпульсу — 100–200 мс, інтервал — 100–150 мс.
69 хворим (69 очей) була виконана факоемульсифікація катаракти у поєднанні із закритою субтотальною вітректомією, пілінгом внутрішньої пограничної мембрани сітківки та етапом ПРЛК. Факоемульсифікацію катаракти виконували за стандартною методикою на апараті Constellation Vision System (Alcon, США) за допомогою касети Constellation TOTALPLUS комбінованої — 7500 СРМ, 25+ калібр (Alcon, США) через розрізи 2,65 та 2,2 мм. Імплантували інтраокулярну лінзу Alcon моделі SA60AT, зважаючи на її гідрофобні властивості.
У всіх пацієнтів до хірургічного втручання було визначено рівень PDGF-BB у крові методом імуноферментного аналізу з використанням набору реактивів Human PDGF-BB Quantikine ELISA Kit (R&D Systems; США). До контрольної групи було залучено 95 осіб відповідної статі та віку, які не мали патології зору, цукрового діабету та іншої супутньої соматичної патології.
Досліджували зв’язок тромбоцитарного фактора росту у хворих на ДР та ЦД2 із ДМП і ДМО, а також з їх рецидуванням після різних видів хірургічного втручання. Усіх хворих обстежували через 1, 3, 6 і 12 місяців після операції.
Для статистичної обробки отриманих даних використовували програму Statistica 10 (StatSoft, Inc., США). Після проведення тестів Колмогорова — Смирнова і χ-квадрат був встановлений відмінний від нормального характер розподілу варіаційних рядів (p < 0,05). У зв’язку з цим для описової статистики кількісних даних використовували медіану (Me) та перший і третій квартилі (Q1; Q3) варіаційних рядів. Для порівняння категоріальних змінних використовували таблиці сполучення і непараметричний критерій χ2 Пірсона. У всіх випадках статистичного оцінювання значення р < 0,05 вважали вірогідними.
Результати та обговорення
Як показав статистичний аналіз вибірки, розподіл значень вмісту PDGF у крові хворих відрізнявся від нормального: тест Колмогорова — Смирнова: р = 0,032; тест χ2: p < 0,001. Отже, для аналізу було обрано методи непараметричної статистики: для множинних порівнянь — критерій Kruskal-Wallis, для парних — Mann-Whitney (табл. 1).
Порівняльний аналіз вмісту PDGF у крові хворих показав його збільшення відповідно до тяжкості ДР (рис. 1).
Порівняння значень у контрольній та 1-й групах хворих показало відсутність статистичної різниці (р = 0,262), тоді як різниці між умістом PDGF у контролі та інших групах хворих, а також між усіма групами хворих були статистично значущі (р < 0,001). Максимальний рівень PDGF був відзначений у хворих із ПДР, мінімальний — при початковій НПДР. Вміст PDGF у крові хворих із ПДР (3-тя група) перевищував значення у контролі у 2,2 раза (p < 0,001).
За даними літератури, вміст у крові всіх ізоформ PDGF був суттєво підвищений у сироватці крові та склоподібному тілі пацієнтів із ПДР у порівнянні з контролем, причому він корелював з її тяжкістю [16]. Ці дані збігаються з нашими, що доводить патогенетичну роль підвищення вмісту PDGF при ДР. Також було встановлено, що після виконання ПРЛК вміст PDGF у склоподібному тілі значно зменшувався.
Аналіз вмісту PDGF у групах хворих залежно від застосованого методу хірургічного лікування показав відповідність отриманих даних загальній тенденції: рівень PDGF був вищим у хворих із ПДР і не відрізнявся від контрольних значень при початковій НПДР (табл. 2). Отже, початковий вміст PDGF у даному дослідженні був однаковим при різних методах хірургічного втручання.
По-іншому виглядала ситуація при аналізі зв’язку вмісту PDGF до хірургічного лікування з наявністю або відсутністю рецидивів ДМП у групах хворих (табл. 3).
За умов наявності рецидивів уміст PDGF по кожній з груп статистично значуще (p < 0,001 за критерієм Mann-Whitney) перевищував такий за відсутності рецидивів (у 1,3–1,4 раза). При цьому порівняння вмісту PDGF між групами хворих відповідало загальній тенденції — збільшення від початкової НПДР до ПДР (рис. 1).
Таким чином, було показано, по-перше, наявність збільшення вмісту PDGF у крові хворих на ЦД2 із ДМП за умов наявності у них помірної та вираженої НПДР та, більшою мірою, ПДР; а по-друге — зв’язок наявності рецидивів при хірургічному лікуванні ДМП з рівнем PDGF у крові до хірургічного лікування.
Такі результати поставили завдання доказового з’ясування наявності впливу вмісту у крові PDGF до хірургічного лікування на розвиток рецидивів ДМП. Це завдання було вирішено шляхом застосування однофакторного логістичного регресійного аналізу. Як незалежну змінну використано значення вмісту PDGF у крові хворих на ДМП, залучених у дослідження (313 пацієнтів), до початку хірургічного лікування. Як залежну змінну використано наявність або відсутність рецидивів ДМП (відсутність кодовано індикаторним значенням 0; наявність — 1). Результати розрахунків β-коефіцієнтів отриманого регресійного рівняння подано в табл. 4.
Регресійне рівняння впливу вмісту PDGF на ймовірність розвитку рецидивів ДМП мало такий вигляд:
P = 1/(1 + e–(–7,622 + 0,114 • PDGF)),
де PDGF — вміст у крові PDGF до хірургічного лікування (нг/мл).
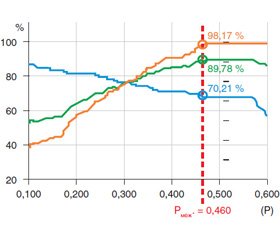
Операційні властивості моделі були розраховані у ROC-аналізі. Вони мали задовільні характеристики: площа під ROC-діаграмою: AUC = 0,84; –2 • log (Likelihood) = 267,60; χ2 = 114,97 (p < 0,001).
На діаграмі (рис. 2) зображено залежність чутливості, специфічності та точності розрахованої регресійної моделі прогнозування ймовірності рецидивів ДМП за вмістом у крові хворих PDGF до хірургічного лікування. Діаграма застосована для визначення оптимальної ймовірності для розмежування позитивних і негативних прогнозів. На підставі аналізу значень показника точності як межового обрано значення ймовірності — Pмеж. = 0,460.
З метою практичного використання отриманих даних було проведено розрахунок критичного вмісту PDGF у крові (нг/мл) до хірургічного лікування, яке відповідало розвитку рецидивів ДМП. Для цього було застосовано таку формулу:
де PDGF — вміст у крові PDGF (нг/мл); Рмеж. — значення межової ймовірності.
Встановлено, що критичний рівень PDGF у крові до хірургічного лікування, при якому стає ймовірним розвиток рецидивів ДМП, був більшим ніж 51,8 нг/мл, з точністю 89,8 %.
Висновки
1. Вміст PDGF у крові хворих із ДМП був підвищеним при помірній та вираженій НПДР (2-га група) та при ПДР (3-тя група) і ЦД2 у порівнянні з контролем у 1,6 та 2,2 раза відповідно (p < 0,001).
2. Високий рівень PDGF у крові хворих із ДМП та ЦД2 був фактором ризику рецидиву ДМП у найближчі та віддалені терміни після втручання. Встановлено, що у хворих із рецидивом ДМП рівень PDGF у крові був значуще вищим (у 1,3–1,4 раза; p < 0,001), ніж за його відсутності.
3. Побудова регресійної моделі розрахунку ймовірності розвитку рецидивів хірургічного лікування ДМП залежно від початкового рівня у крові PDGF, яка мала задовільні характеристики при точності прогнозу на рівні 89,8 % (p < 0,001), довела патогенетичне значення PDGF як у розвитку ДМП, так і її рецидивів після втручання. Критичний рівень PDGF для розвитку рецидивів хірургічного лікування ДМП становить 51,8 нг/мл.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
1. Kamoi K. Identifying risk factors for clinically significant diabetic macula edema in patients with type 2 diabetes mellitus. Curr. Diabetes Rev. 2013 May. Vol. 9(3). P. 209-17.
2. Sivaprasad S. Prevalence of diabetic retinopathy in various ethnic groups: a worldwide perspective. Surv. Ophthalmol. 2012. Vol. 57(4). P. 347-70.
3. Пасечникова Н.В. Диабетическая макулопатия. Современные аспекты патогенеза, клиники, диагностики, лечения. К.: Изд-во ООО «Карбон ЛТД», 2010. 154 с.
4. Пшеничнов М.В. Факторы риска формирования макулярного отека у больных сахарным диабетом 2 типа. Катарактальная и рефракционная хирургия. 2010. № 1. С. 46-50.
5. Diep T.M. Risk factors associated with diabetic macular edema. Diabetes Res. Clin. Practice. 2013 Jun. Vol. 100(3). P. 298-305.
6. Jenkins A.J. Biomarkers in Diabetic Retinopathy. Rev. Diabet. Stud. 2015 Spring-Summer. Vol. 1–2. P. 159-95.
7. Eshaq RS. Diabetic retinopathy: Breaking the barrier. Pathophysiology. 2017. Vol. 24(4). P. 229-41.
8. Mogilevskyy S. Influence of local and systemic factors of type 2 diabetes mellitus on the functional status of platelets in patients with diabetic and maculopathy. Journal of Ophthalmology (Ukraine). 2018. Vol. 6(485). P. 23-9.
9. Mogilevskyy S.Iu., Panchenko Iu.O., Ziablytsev S.V. Predicting the risk of diabetic retinopathy-assosiated macular edema in patients with type 2 diabetes mellitus. Journal of Ophthalmology (Ukraine). 2019. Vol. 3(488). P. 3-8.
10. Мельничук Ю.М. Тромбоцитарний фактор росту, як діагностично важливий маркер фізіологічних процесів в організмі людини (огляд літератури). Вісник проблем біології та медицини. 2014. № 3(1). С. 217-21.
11. Zhang J. Differential roles of PDGFR-alpha and PDGFR-beta in angiogenesis and vessel stability. FASEB J. 2009 Jan. Vol. 23(1). P. 153-63.
12. Rodriguez A. Phenotypical differences in connective tissue cells emerging from microvascular pericytes in response to overexpression of PDGF-B and TGF-β1 in normal skin in vivo. Sundberg C. Am. J. Pathol. 2013 Jun. Vol. 182(6). C. 2132-46.
13. Hata N. Platelet-derived growth factor BB mediates the tropism of human mesenchymal stem cells for malignant gliomas. Neurosurgery. 2010 Jan. Vol. 66(1). P. 144-56; discussion 156-7.
14. Mori K. Retina-specific expression of PDGF-B versus PDGF-A: vascular versus nonvascular proliferative retinopathy. Invest. Ophthalmol. Vis. Sci. 2002. Vol. 43. P. 2001-6.
15. Балашевич Л.И. Диабетическая офтальмопатия. СПб.: Человек, 2012. 396 с.
16. Praidou A. Vitreous and serum levels of platelet-derived growth factor and their correlation in patients with proliferative diabetic retinopathy. Curr. Eye Res. 2009 Feb. Vol. 34(2). P. 152-61.

/21-1.jpg)
/22-1.jpg)
/22-2.jpg)