Статья опубликована на с. 153-166
Актуальность
Характерной особенностью некоторых часто встречающихся форм кислотно-основного дисбаланса является тесное переплетение повреждающих и приспособительных элементов, четкой границы между которыми не существует. Многофакторность и патогенетическая неоднозначность нарушений кислотно-основного гомеостаза обусловливают значительные разногласия в оценке прогностической значимости и стратегии лечения его сложных форм. В клинической практике это зачастую приводит к неоправданной схематизации, обезличиванию терапии либо, что еще хуже, к стремлению учитывать параметры кислотно-основного состояния (КОС) только при смещении рН в область угрожающих жизни значений.
Механизмы формирования ацидоза
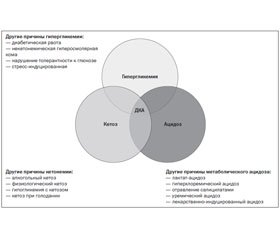
По патогенетическому механизму различают кетоацидоз и молочнокислый ацидоз.
Кетогенез — универсальная защитная патофизиологическая реакция организма на истощение запасов глюкозы, которая возникает при различных патологических состояниях (голодание, неукротимая рвота беременных, декомпенсированный стеноз пищевода, постреанимационная болезнь и др.). Образующиеся в процессе β-окисления жирных кислот кетоновые тела занимают одно из центральных мест в системе обеспечения организма энергией, конкурируя в этом отношении с глюкозой. При критическом состоянии различной этиологии в связи с повышенным расходом энергии запасы гликогена как основного источника энергии, как правило, быстро истощаются или уже бывают истощены. В организме человека содержится примерно 40 % органических веществ, т.е. около 28 кг при массе тела 70 кг. Из них белок составляет 9–12 кг, жировая ткань — 16–20 кг, а углеводы (гликоген, глюкоза) — всего несколько сотен граммов. Последних обычно хватает на несколько часов усиленного потребления энергии. Известно, что для проникновения глюкозы через клеточную мембрану, помимо наличия определенного количества энергии в виде АТФ, нормальной функции калий-натриевого насоса, необходим активно действующий инсулин. При отсутствии хотя бы одного из этих условий гипергликемия может сочетаться с дефицитом энергии в клетке. Гликолиз способствует ускорению расходования запасов гликогена и накоплению молочной кислоты — сильного донатора ионов водорода. Кроме того, при развитии шокового состояния любой этиологии происходит снижение секреции инсулина и снижение его активности, вследствие чего нарушается усвоение глюкозы. Развивается диабетоподобное состояние, при котором довольно высокий уровень сахара в крови сочетается с недостатком в клетках глюкозы как субстрата окисления.
Таким образом, возросшая потребность в энергии при критическом состоянии не может удовлетворяться только за счет запасов гликогена. При их истощении увеличивается выработка контринсулярных гормонов, результатом чего является усиление липолиза и кетогенеза, т.е. расщепления триглицеридов жировой ткани до глицерина и свободных жирных кислот (СЖК). Так, процесс кетоза и липолиза стимулируют, активируя тканевую липазу, высокие концентрации в плазме крови катехоламинов, глюкагона, тироксина, а также глюкокортикоидов. Свободные жирные кислоты фиксируются на молекулах альбумина и поступают в кровоток как источники энергии. Продукты липолиза поглощаются всеми тканями, за исключением нервной. Быстрая мобилизация жирных кислот при повышенной потребности в энергии — очень важная защитная реакция организма, так как калорическая ценность жиров (9 ккал/г) намного больше, чем углеводов и белка (по 4,1 на 1 г). При усиленном липолизе в печень поступает излишек свободных жирных кислот. В печени СЖК трансформируются в универсальный метаболит — ацетил-коэнзим А (ацетил-КоА). В условиях нормального обмена основным путем метаболизма ацетил-КоА является реакция с оксалоацетатом и дальнейшее участие в цикле Кребса с образованием энергии. Часть ацетил-КоА используется для ресинтеза СЖК и образования холестерина, и только небольшое количество ацетил-КоА идет на образование кетоновых тел. При усилении липолиза количество ацетил-КоА становится чрезмерным, кроме того, ограничивается его поступление в цикл Кребса в связи с уменьшением количества оксалоацетата, вызванным недостатком углеводов.
Также снижается активность ферментов, которые активируют образование холестерина и СЖК. В результате этого остается лишь один путь утилизации ацетил-КоА — кетогенез (рис. 1).
Кетоновые тела либо окисляются, либо выводятся из организма человека почками и легкими. Получается, что кетоз развивается в тех случаях, когда скорость образования кетоновых тел превышает скорость их утилизации. Таким образом, усиленный липолиз углубляет ацидоз за счет образования в печени слишком большого количества кетоновых тел, ацетона, которые полностью не окисляются при дефиците кислорода (рис. 2). Липолиз ведет к усугублению ацидоза, так как каждая молекула триглицерида расщепляется на одну молекулу глицерина, три — свободных жирных кислот и три свободных иона водорода. Кроме того, чрезмерная мобилизация жирных кислот, сверх энергетической потребности, приводит к образованию из них триглицеридов и жировой инфильтрации органов.
/155.jpg)
Такой кетоз может наблюдаться в физиологических условиях (физическая работа, эмоциональное напряжение, поздние сроки беременности). Однако он никогда не бывает продолжительным, при этом уровень кетоновых тел в крови не превышает 0,1 мМ, поскольку происходит их быстрая утилизация в качестве энергетического сырья.
В своей практике анестезиолог (интесивист) часто сталкивается с двумя видами ацидоза, имеющими различные причины, механизмы формирования и, следовательно, тактики лечения: кетоацидоз и молочнокислый ацидоз. В свою очередь, кетоацидоз разделяется на диабетический и недиабетический. Другие виды метаболического ацидоза: гиперхлоремический, лекарственно-индуцированный, при отравлениях (салицилаты) и т.д.
Диабетический кетоацидоз
Диабетический кетоацидоз является одним из самых распространенных неотложных состояний, возникающих у больных сахарным диабетом. Заболеваемость и смертность из-за данного состояния чрезвычайно высоки по всему миру, особенно в развивающихся странах, где возникают определенные трудности в ранней диагностике сахарного диабета и выборе терапевтической стратегии.
Этиология. К развитию диабетической кетоацидотической комы могут привести следующие факторы:
— нелеченый и нераспознанный диабет;
— прекращение введения инсулина или других сахароснижающих препаратов, а также необоснованное снижение их доз;
— острые гнойные инфекции и другие интеркуррентные заболевания;
— физическая или психическая травма, оперативные вмешательства и другие стрессовые воздействия;
— грубые нарушения диеты (избыток углеводов, жиров), алкогольные и пищевые интоксикации;
— частая повторная рвота, понос;
— длительное голодание;
— беременность;
— сердечно-сосудистые катастрофы (инфаркт, инсульт, тромбоз).
Патофизиология. Диабетический кетоацидоз (ДКА) — это комплекс расстройств метаболизма, характеризующийся гипергликемией, ацидозом и кетонемией. ДКА является итогом абсолютной или относительной инсулиновой недостаточности. Инсулин усиливает проницаемость клеточных мембран для глюкозы и обеспечивает ее переход из крови в клетки. Этот гормон активирует цикл Кребса и увеличивает утилизацию глюкозы в жировой ткани, стимулируя преобразование углеводов в жиры. Инсулин тормозит глюконеогенез, снижает катаболическое действие стероидных гормонов, катехоламинов, гормонов гипофиза. Поэтому при недостатке инсулина нарушается обмен углеводов, белков и жиров, возникают расстройства водно-электролитного обмена.
Итак, в результате недостатка инсулина в организме возникает гиперпродукция глюкагона (контринсулярный гормон). Вследствие этого усиливаются контролируемые им процессы: гликогенолиз и глюконеогенез. В результате резко увеличивается продукция глюкозы, возникает гипергликемия. Но так как глюкоза не усваивается клетками организма, то усиливается распад гликогена, депонированного в печени, что способствует возрастанию гипергликемии. Увеличение концентрации глюкозы крови ведет к глюкозурии, в определенной связи с которой находится и полиурия.
В процессе полиурии ионы натрия, калия, хлора усиленно выводятся из организма, уменьшается объем внеклеточного пространства. В условиях гиперосмолярности плазмы крови происходит перераспределение воды из интерстициального и клеточного пространства с последующей гиповолемией, полиурией. В результате развивается тотальная дегидратация. Гиповолемия вызывает централизацию кровообращения.
Накапливаются лактаты и пируваты, т.к. синтез гликогена из молочной кислоты нарушен.
Нарушение цикла трикарбоновых кислот с задержкой окисления ацетоуксусной, β-оксимасляной кислот и ацетона является едва ли не самым опасным патофизиологическим сдвигом в организме. Кетоновые тела крайне токсичны для организма. Обладая выраженной кислой реакцией, они вызывают некомпенсированный метаболический ацидоз. Появляясь в крови в большом количестве, кетоновые тела, наряду с высоким уровнем глюкозы, увеличивают суммарную осмотическую концентрацию растворенных кинетически активных частиц в крови и в интерстиции. Развивается гиперосмолярный синдром. Осмолярность крови повышается, развивается гипертоническая дегидратация, т.е. уменьшается объем внеклеточной жидкости и повышается ее осмолярность (за счет высокой концентрации глюкозы и кетоновых тел, мочевины). Осмолярность внутриклеточного пространства ниже, чем внеклеточного, за счет более низкой концентрации глюкозы и кетоновых тел. Между жидкостными секторами возникает осмотическое давление — сила, стремящаяся уравнять концентрации растворов по обе стороны клеточной мембраны. Так как биологические мембраны полупроницаемы, то есть проницаемы только для воды, диффузия идет только в одну сторону — растворителя, в сторону большей концентрации. Жидкость выходит из клеток во внеклеточное пространство, развивается обезвоживание клеток, то есть гипертоническая дегидратация всегда внутриклеточная. Кетоновые тела усиливают потерю с мочой натрия, что еще больше увеличивает дегидратацию. Накопление кетоновых тел является одной из главных причин острой инсулинорезистентности. Снижается продукция иммуноглобулинов, с чем связана восприимчивость больных диабетом к инфекциям. Возникший метаболический ацидоз компенсируется респираторным алкалозом. Развивается тяжелая внутриклеточная дегидратация и возникает кома (как результат дегидратации клеток головного мозга).
Таким образом, причиной диабетической комы является не только снижение уровня инсулина и недостаток поступления глюкозы в клетки. Ведущей причиной комы является гиперосмолярный синдром с внутриклеточной дегидратацией, токсемией, тяжелым метаболическим ацидозом. Поэтому тезис о том, что при диабетической коме прежде всего необходимо ввести достаточное количество инсулина, не совсем правомочен, более того, достаточно опасен.
Кроме того, вследствие развития полиурии-дегидратации компенсаторно возрастает секреция катехоламинов и альдостерона, что приводит к задержке натрия и способствует выведению калия с мочой. Развивается гипокалигистия — один из важных компонентов метаболических нарушений при диабетическом кетоацидозе.
Клиническая картина диабетического кетоацидоза. Кома развивается относительно медленно (от 12 часов до нескольких суток). В продромальном периоде усиливается жажда, ухудшается аппетит, появляется тошнота, рвота, сухость во рту, полиурия. Появляются жалобы на разбитость, усталость, головные боли, адинамию. Затем нарушается сознание. Налицо все признаки дегидратации. Кожные покровы и слизистые оболочки сухие, дряблые, бледные. Отмечаются трещины на губах, ксантохромные пятна на ладонях и подошвах, расчесы, многочисленные фурункулы. Тургор кожи и мышц снижен, глазные яблоки мягкие. Реакция зрачков на свет вялая, корнеальные рефлексы не вызываются, миоз. Ощущается запах ацетона в выдыхаемом воздухе, дыхание типа Куссмауля. Пульс слабого наполнения, тоны сердца глухие, артериальное давление снижено. Язык сухой, малинового цвета, с коричневым налетом, сухожильные рефлексы не вызываются. Температура тела сниженная или нормальная.
Диагностические критерии. Выделяют следующие критерии диагностики диабетического кетоацидоза:
— глюкоза капиллярной крови более 11 ммоль/л;
— кетоновые тела: ++ при качественной реакции определения кетоновых тел в моче;
— рН венозной крови менее 7,3 и уровень бикарбоната менее 15 ммоль/л.
Интенсивная терапия диабетического кетоацидоза. Патогенетически обоснованная интенсивная терапия диабетической кетоацидотической комы должна включать следующие направления:
— регидратацию;
— коррекцию уровня гликемии, инсулинотерапию;
— коррекцию электролитных расстройств (прежде всего гипокалигистии);
— купирование метаболического ацидоза.
Регидратация и коррекция солевого обмена. Важнейшей частью интенсивной терапии диабетического кетоацидоза является восстановление баланса жидкости, сопровождаемое мониторированием и воздействием на уровень гликемии.
Главными целями регидратации являются:
— восстановление циркулирующего объема крови;
— снижение уровня кетоновых тел;
— коррекция электролитного дисбаланса.
По нашим наблюдениям, ликвидации кетонурии и дегидратации удается добиться максимально через 20 часов от начала интенсивной терапии, поскольку дефицит жидкости у больных с гиперосмолярными гипергликемическими комами составляет 6–12 литров. А согласно Рекомендациям ABCD дегидратация, кетонемия и ацидоз должны быть купированы к 12-му часу интенсивной терапии. В случае, если данные цели не достигнуты, проводится коррекция инсулинотерапии, инфузионной терапии.
Ведущая роль при проведении интенсивной терапии при диабетической кетоновой коме принадлежит своевременному восполнению водных потерь организма. Ранняя регидратационная терапия приводит к восстановлению объема циркулирующей крови (ОЦК), снижает осмолярность плазмы, содержание глюкозы, кетокислот, контринсулярных гормонов в крови, повышает чувствительность клеток к инсулину и предотвращает инсулинорезистентность. Задержка с введением первых доз инсулина до одного часа не является опасной для больного.
Во время проведения регидратации необходимо учитывать последовательность восстановления водных пространств. Для стабилизации гемодинамики первоначально восполняют объем сосудистого и интерстициального пространства. С этой целью применяют изотонические кристаллоидные и коллоидные растворы.
Тотальный дефицит жидкости составляет не менее трех литров, а в тяжелых случаях может достигать 6–7 литров. В среднем начальный режим восстановления жидкости может быть следующим: 1 л жидкости в первый час, затем 1 л в течение двух часов, затем — 1 л в течение трех или четырех часов.
Базовым раствором для проведения регидратационной терапии является изотонический раствор хлорида натрия. Казалось бы, логичным является использование гипотонических растворов. Однако быстрое изменение осмолярности сосудистого русла из-за большого объема переливаемой жидкости (1 литр в 1 час) может привести к быстрому перемещению жидкости между водными секторами с развитием отека головного мозга и отека легких.
В 30-х годах XX века А. Хартманном было отмечено усугубление диабетического кетоацидоза при регидратации раствором Рингера. С целью купирования кетоацидоза им впервые был применен носитель резервной щелочности в виде лактата, введенного в раствор Рингера. Раствор получил название раствора Хартманна (син.: Рингер-лактат, лактосол). Инфузия растворов, не содержащих носителей резервной щелочности, вызывает уменьшение буферной емкости крови и приводит к развитию гемодилюционного ацидоза. Поэтому с целью регидратации вполне уместно использовать растворы Рингер-лактат, Рингер-ацетат.
В комплексной инфузионной терапии диабетического кетоацидоза целесообразно применять сбалансированные изотонические растворы. В состав такого инфузионного раствора входят: натрий, калий, магний, кальций, хлорид, ацетат и малат. Препарат является изотоническим электролитным раствором, который по своему составу сходен с плазмой крови и используется для восполнения потерь внеклеточного сектора жидкости. Анионная структура представляет собой сбалансированное соединение хлорида, ацетата и малата, что предупреждает и ликвидирует метаболический ацидоз. Максимальная суточная доза сбалансированного изтонического раствора — 3000 мл.
Объем и скорость регидратации необходимо дифференцировать в зависимости от выраженности циркуляторных нарушений, состояния сердечно-сосудистой системы, сохранения функции почек и возраста больного. Хартиг и др. рекомендует поддерживать скорость инфузии в течение первого часа в объеме не менее 1,5 л/ч, в течение второго и третьего часа — по 500 мл, а затем ежечасно — по 250 мл. Однако такой режим регидратации может сопровождаться серьезными осложнениями со стороны сердечно-сосудистой и дыхательной систем, т.к. общий объем жидкости, введенной за сутки, составляет около 8 л.
Рекомендуется проводить регидратацию в течение двух суток, обеспечивая ежедневное введение жидкости в объеме 50 % от исходного дефицита, а у больных с выраженными сопутствующими заболеваниями — в течение трех суток, восполняя ежедневно 30 % жидкости от исходного дефицита ОЦК с учетом потерь жидкости организмом [5]. Для профилактики интерстициального отека, восстановления ОЦК и быстрой стабилизации нарушений гемодинамики предпочтительно применять коллоидные растворы, альбумин или его заменители.
Согласно Рекомендациям ABCD растворы гидроксиэтилированного крахмала (ГЭК) при лечении диабетического кетоацидоза применять не рекомендуется, ввиду того что в результате их использования возможно повышение уровня амилазы крови. Мы бы не были столь категоричны в отношении применения растворов ГЭК, поскольку диагностическое значение имеет эндогенная амилаза крови, которая является маркером эндокринной функции поджелудочной железы. Декстраны в результате биотрансформации расщепляются до глюкозы, следовательно, их применение также нежелательно при данной патологии.
В Украине в комплексе интенсивной терапии диабетического кетоацидоза широко применяется отечественный препарат ксилат фирмы «Юрия-Фарм» (Украина). Данный препарат обладает гемодинамическими и антикетогенными свойствами, корригирует метаболический ацидоз, не повышает уровень глюкозы в крови. Благодаря своей гиперосмолярности (610 мосм/л) ксилат длительное время находится в сосудистом русле, оказывает плазморасширяющий эффект, что, в свою очередь, помогает быстро наполнить сосудистое русло и способствует регидратации организма при сахарном диабете. Однако необходимо учитывать гиперосмолярность ксилата; использовать данный препарат рекомендуется только после предварительной регидратации изотоническими солевыми растворами, по схеме, изложенной выше.
Основными компонентами препарата ксилат являются ксилит и ацетат натрия. Ксилит — это пятиатомный спирт, который при парентеральном пути введения быстро включается в общий метаболизм и пентозофосфатный цикл. Антикетогенный эффект ксилита обусловлен несколькими факторами:
— ксилит путем метаболизма через пентозофосфатный цикл может являться источником глицерофосфата, тем самым уменьшая количество свободных жирных кислот, способных окисляться в ацетил-коэнзим А;
— повышая интенсивность гликолиза, ксилит усиливает образование пировиноградной кислоты, которая способствует окислению ацетил-коэнзима А в цикле Кребса;
— ксилит усиливает образование гликогена в печени, тем самым снижая мобилизацию жира на периферии.
Второй компонент ксилата, ацетат натрия, обладает ощелачивающим свойством. Ацетат натрия вызывает накопление оснований за счет метаболизма препарата. Таким образом, при применении ацетата натрия в отличие от гидрокарбоната натрия происходит медленная коррекция метаболического ацидоза, не возникает резких колебаний рН. Ацетат натрия метаболизируется на протяжении 1,5–2 часов, не вызывает такой грозной ятрогении, как отек мозга.
Преимущества ацетата перед лактатом заключаются в том, что он преобразуется в бикарбонат в клетках всех тканей организма, а лактат метаболизируется в бикарбонат преимущественно в печени. Поэтому метаболизм ацетата не замедляется у тяжелых пациентов и у пациентов с нарушением функций печени. Для метаболизма в бикарбонат ацетат требует в 1,5 раза меньше О2, чем лактат.
Ксилат в своем составе имеет основные катионы (Na+, K+, Ca2+, Mg2+) и анион Cl–. Кроме того, концентрация ионов в растворе близка к физиологической. Переливание ксилата в комплексе инфузионной терапии способствует коррекции электролитных нарушений у больных декомпенсированным диабетическим кетоацидозом, позволяет восстановить электролитный баланс.
Наша тактика инфузионной терапии не расходится с рекомендациями Британской ассоциации клинических диабетологов (ABCD The Management of Diabetic Ketoacidosis in Adults, 2012). Предлагается схема инфузионной терапии, которая разбита на 6 этапов:
Этап 1. Время 0–60 минут
При исходном АДсист. ниже 90 мм рт.ст. проводить инфузию 0,9% раствора NaCl 500 мл в течение первых 10–15 минут от начала терапии. Если после первой инфузии АДсист. остается ниже 90 мм рт.ст. — повторить введение 0,9% раствора NaCl 500 мл в прежнем быстром темпе. При достижении АДсист. уровня 90 мм рт.ст. — провести инфузию 0,9% раствора NaCl в объеме 1 л в течение 60 минут.
При исходном АДсист. выше 90 мм рт.ст. — инфузия 0,9% раствора NaCl 1000 мл в течение первых 60 минут.
Этап 2. Время 60 мин — 6 ч
Инфузия 0,9% раствора NaCl 1000 мл в течение следующих 2 часов.
Инфузия 0,9% раствора NaCl 1000 мл в течение следующих 2 часов.
Инфузия 0,9% раствора NaCl 1000 мл в течение следующих 4 часов.
При снижении уровня гликемии до 14 ммоль/л мы рекомендуем переходить на инфузию изотонических гликозилированных растворов с добавлением инсулина в расчете 1 ЕД инсулина на 1 г глюкозы. В рекомендациях Британского общества клинических диабетологов предусматривается инфузия 10% раствора глюкозы со скоростью 125 мл/ч (для введения глюкозы предлагается использовать вену на другой руке).
Этап 3. Время 6–12 ч. Инфузионная терапия проводится по редуцированной схеме:
— инфузия 0,9% раствора NaCl 1000 мл в течение следующих 4 часов;
— инфузия 0,9% раствора NaCl 1000 мл в течение следующих 6 часов.
Однако следует помнить, что массивная инфузия кристаллоидов способна привести к развитию таких грозных осложнений, как отек мозга и отек легких.
Инсулинотерапия. Коррекция концентрации глюкозы в крови является одним из наиболее важных этапов этиотропной терапии диабетического кетоацидоза. Лечение начинают с введения инсулина короткого действия, что позволяет подобрать эффективную дозу препарата и регулировать скорость снижения содержания глюкозы в плазме. Уровень глюкозы крови определяют каждый час до стабилизации показателей жизнедеятельности больного.
Учитывая исходную выраженную дегидратацию, значительные нарушения микроциркуляции, инсулинотерапию осуществляют методом постоянной внутривенной инфузии с помощью инфузомата. Для этого необходимо добавить 50 единиц инсулина актрапид в шприц с 50 мл физраствора, вводить препарат в следующем режиме:
Глюкоза крови (ммоль/л) Доза инсулина
Меньше 4 ммоль/л 0
4–7 ммоль/л 1 мл/ч (1 ед/ч)
7,1–11 ммоль/л 2 мл/ч
11,1–17 ммоль/л 4 мл/ч
17,1–27,9 ммоль/л 6 мл/ч
Больше 28 ммоль/л 8 мл/ч
Глюкоза крови должна измеряться 1 раз в 1 час; скорость введения инсулина изменяется в зависимости от результатов каждого измерения.
Согласно рекомендациям Британской ассоциации клинических диабетологов (ABCD The Management of Diabetic Ketoacidosis in Adults, 2012), инсулинотерапию проводят по схеме IVII: 0,1 ЕД/кг/
час (из расчета на определенную массу тела), 50 ЕД человеческого инсулина (актрапид, хумулин С) растворяют в 50 мл 0,9% раствора натрия хлорида, инфузия осуществляется помпой. Если пациент в плановом порядке получает инсулин продленного действия, продолжается его применение в обычной дозировке и в прежнее время. Измеряется уровень глюкозы в капиллярной крови каждый час терапии. При этом эффективность проводимой инсулинотерапии оценивается по следующим показателям:
— от начала терапии до 6 часов уровень кетонемии снижается как минимум на 0,5 ммоль/л/час; уровень бикарбоната венозной крови повышается как минимум на 3 ммоль/л/час; концентрация глюкозы в плазме снижается минимум на 3 ммоль/л/час. Рекомендуется проводить инфузию инсулина до достижения целевых лабораторных показателей: концентрация кетоновых тел в крови не выше 0,3 ммоль/л, рН венозной крови не ниже 7,3 и/или концентрация бикарбоната не ниже 18 ммоль/л. В случае, если в течение временного периода от начала терапии до 6 часов не происходит приближение контролируемых параметров к целевым, необходимо корригировать инсулинотерапию путем добавления инсулина 1 ЕД/ч в инфузомат до достижения номинальных уровней кетонемии, гликемии и КОС. Для коррекции инсулинотерапии выделяется временное окно — 6 часов. Согласно данному руководству, гиперкетонемия и ацидоз должны быть купированы в течение 24 часов от начала интенсивной терапии.
Если дозы вводимого инфузоматом инсулина недостаточны, можно дополнительно ежечасно вводить 10 ЕД инсулина актрапид в/м. А согласно Британским рекомендациям клинических диабетологов, в данном случае следует увеличивать дозу инсулина на 1 ЕД/ч каждый час до тех пор, пока не получим адекватный ответ на инсулинотерапию.
Введение инсулина в указанных дозах создаст в крови уровень, необходимый для подавления липолиза, глюконеогенеза, гликогенолиза, кетогенеза и достижения максимального транспорта глюкозы и ионов калия в клетку. Инфузия инсулина в более низких дозах ведет к прекращению его влияния прежде всего на липидный обмен, который играет основную роль в развитии метаболического ацидоза.
Коррекция электролитного дисбаланса. В результате полиурии происходит потеря многих электролитов (натрий, калий, магний, кальций, хлор). Несмотря на это, у больных в состоянии кетоацидоза часто наблюдается гипернатриемия, причиной которой является неравномерная потеря воды и натрия (жидкость выводится в больших объемах, чем натрий).
Эквивалентные отношения значимых химических соединений и элементов, необходимых для расчета дефицита электролитов и количества растворов для их коррекции, приведены в табл. 1.
Актуальной является коррекция уровня калия плазмы, поскольку энергичная инфузионная терапия и инсулинотерапия могут привести к резкому снижению и без того сниженного уровня калия в плазме крови с развитием осложнений в виде нарушения сердечного ритма, вплоть до фибрилляции желудочков. Во избежание этих осложнений ABCD рекомендуют дополнять инфузионную терапию калием из расчета 40 ммоль/л на 1000 мл инфузионной среды (при показателях калия плазмы крови менее 5,5 ммоль/л).
Для расчета дефицита любого электролита применяют следующую универсальную формулу:
Д (ммоль/л) = 0,2m(K2–K1),
где m — масса больного (кг);
К1 — нормальное содержание ионов (катионов или анионов) в плазме больного (ммоль/л);
К2 — реальное содержание ионов (катионов или анионов) в плазме больного (ммоль/л).
Для расчета количества раствора электролита, необходимого для коррекции, применяют формулу:
V (мл) = АД,
где Д — дефицит электролита (ммоль/л);
А — коэффициент, означающий количество данного раствора, содержащего 1 ммоль дефицитного иона (аниона или катиона):
KCl (3%) — 2,4
KCl (7,5%) — 1,0
NaCl (10%) — 0,58
NaCl (5,8%) — 1,0
NH4Cl (5%) — 1,08
NH4Cl (5,4%) — 1,0
CaCl (10%) — 1,1
HCl (2%) — 1,82
NaHCO3 (5%) — 1,67
NaC3H5O2 (10%) — 1,14
MgSO4 (25%) — 0,5
NaCl (0,85%) — 7,1
Ниже приведены уже готовые расчетные формулы, позволяющие сразу определить нужный объем стандартных растворов (мл) для коррекции дефицита электролитов, которую следует начинать с того катиона (аниона), дефицит которого выражен минимально (m — масса пациента в кг; пл — плазма; эр — эритроциты) (А.П. Зильбер, 1982) (табл. 2).
Разработана универсальная формула для коррекции любого аниона и катиона плазмы крови, которая удобна для использования практическими врачами [24]. Подставив соответствующие значения, формулу легко преобразовать для коррекции конкретных электролитов:
где V — количество раствора, необходимого для коррекции,
М.в. — молекулярный вес;
m — масса больного (в кг);
Э — нормальное содержание электролита в плазме;
Эи — истинное содержание электролита в плазме больного;
% — процент раствора, используемого для коррекции.
Купирование метаболического ацидоза. По литературным данным, правильная регидратационная и инсулинотерапия приводит к самоликвидации кетогенеза, поэтому больные не требуют коррекции КОС. Однако абсолютным показанием к немедленной коррекции ацидоза считается рН крови ≤ 7,15. Между тем, по нашим наблюдениям, у больных, поступавших с гиперосмолярной гипергликемической кетоацидотической комой нередко показатель рН крови соответствовал 7,15 и ниже, что требовало немедленного лечения декомпенсированного ацидоза.
Пути коррекции могут быть различными. Наибольшее распространение в интенсивной терапии метаболического ацидоза различной этиологии получил бикарбонат натрия, впервые предложенный Howland и соавт. в 1916 г.
В основе расчета требуемого количества оснований лежит формула Mellengaard — Astrup:
TBE = 0,3WBE,
где TBE — тотальный дефицит буферных оснований организма (мэкв/л);
W — масса тела больного (кг);
BE — сдвиг буферных оснований крови (мэкв/л).
Используются и другие методы расчета, например:
NaHCO3 (мэкв/л) = 0,5pCO2 – [HCO3–] • 0,5a,
где a — масса тела больного (кг).
Наиболее предпочтительной является универсальная формула [23]:
где V — объем раствора, применяемого для коррекции (мл);
m — масса тела больного (кг);
BE — сдвиг буферных оснований крови (ммоль/л);
MB — молекулярный вес вещества, применяемого для коррекции;
C — процент раствора, применяемого для коррекции.
Преимуществом этой методики расчета перед другими является то, что она может использоваться для расчета дозы любого корректора КОС — как при ацидозе, так и при алкалозе. Кроме того, формула дает количество миллилитров раствора, необходимое для коррекции, что весьма удобно для практического использования (в отличие от миллиэквивалентов бикарбоната натрия).
Принудительная коррекция метаболического ацидоза может иметь противопоказания. Основным противопоказанием к применению натрия гидрокарбоната является неадекватная легочная вентиляция. С целью избежания возможных осложнений даже при отсутствии противопоказаний некоторые авторы рекомендуют первоначальное введение 1/2–1/3 расчетной дозы основания.
Обычно в практике интенсивной терапии используется полумолярный раствор бикарбоната натрия, который составляет 4,2 %. Этот раствор соды достаточно стабилен, содержит в 1 мл 0,5 ммоль и удобен для коррекции. Молекулярный вес бикарбоната натрия (NaHCO3) составляет 84. Если в одном литре воды растворить 84 г бикарбоната натрия (1 грамм-молекулу), то в 1 мл раствора содержится 1 ммоль. Это 8,4% раствор соды — молярный, а 4,2% соответственно — полумолярный. Но рН такого раствора составляет 8,0–8,1, а это намного превышает физиологическую константу (рН = 7,4).
Рядом авторов целесообразность применения бикарбоната для устранения ацидоза при ДКА оспаривается. Негативными последствиями применения этого препарата является то, что бикарбонат натрия может сдвинуть кривую диссоциации гемоглобина влево, усилить гипокалиемию, повысить осмолярность плазмы, способствовать развитию отека мозга, вызывать артериальную гипотензию, снижение сердечного выброса и увеличение содержания лактата в крови. Гипотензия и уменьшение сердечного выброса могут быть результатом связывания ионов кальция анионами бикарбоната. Введение существующих растворов бикарбоната может вызывать резкий сдвиг рН крови и переход в состояние алкалоза, который может удерживаться на протяжении многих часов и приводить к тяжелым осложнениям. Этот эффект связан со скачкообразным и несбалансированным увеличением концентрации ионов бикарбоната при возникающем относительном дефиците углекислоты. Ситуация усугубляется при гипервентиляции, приводящей к еще большей гипокапнии.
Часто отмечают неэффективность использования натрия бикарбоната, несмотря на введение его в больших расчетных дозах, для повышения рН крови. Это объясняется способностью препарата, связывая ионы H+, образовывать угольную кислоту, которая распадается на двуокись углерода и воду. Двуокись углерода обычно выводится легкими, но может также диффундировать в клетки, где при участии воды образуются ионы водорода, вызывая внутриклеточный ацидоз. Кроме того, в крови появляется дополнительный лактат. Все это приводит к усугублению расстройств кислотно-основного состояния и является главным дефектом лечения препаратом.
Поспешная компенсация ацидоза чревата резким падением рН спинномозговой жидкости (СМЖ) и ее осмолярности, гипокалиемией. В то же время адекватная инсулинотерапия с регидратацией в большинстве случаев устраняет ацидоз.
Лечение бикарбонатом с быстрой компенсацией ацидоза может вызвать и неврологические осложнения — от спутанности сознания до комы. Анионы HCO3, соединяясь с ионами H+, образуют угольную кислоту. При ее диссоциации в избытке образуются CO2 и вода. CO2 легко проникает через гематоэнцефалический барьер и вызывает закисление СМЖ (сам бикарбонат практически не проникает в СМЖ). Поэтому нормализация pH плазмы может сопровождаться парадоксальным ацидозом в центральной нервной системе, который и приводит к неврологическим нарушениям.
С другой стороны, при тяжелом декомпенсированном кетоацидозе нарушается сократимость и возбудимость миокарда, возникают аритмии и снижается реакция рецепторов сердца и сосудов на катехоламины. Многие авторы настаивают на назначении бикарбоната натрия в следующих случаях:
— при угрожающей жизни гиперкалиемии;
— если диабетический кетоацидоз осложняется тяжелым лактатацидозом;
— если имеется тяжелый ацидоз (pH < 6,9), особенно осложненный шоком, который не поддается инфузионной терапии, направленной на повышение сердечного выброса.
Однако даже в такой ситуации назначение бикарбоната натрия не гарантирует ликвидацию кетоацидоза при продолжающемся кетогенезе.
Наиболее рациональным, по нашему мнению, является применение препарата сода-буфер, который обладает улучшенными качествами для коррекции метаболического ацидоза и восстановления щелочного резерва. Применение препарата позволяет предупредить многие осложнения, которые были указаны выше [12].
Необходимо учитывать, что бикарбонат является только частью основной буферной системы организма. Кроме бикарбоната, эта система включает углекислый газ. Соотношение этих двух компонентов описано уравнением Гендерсена — Гессельбаха (рН = 6,11 + logHCO3/рСО2) и определяет уровень рН. Буферированный раствор натрия бикарбоната 4,2% сода-буфер производства «Юрия-Фарм» содержит основные составляющие бикарбонатного буфера — гидрокарбонат натрия и угольную кислоту в физиологическом соотношении 20 : 1. Это соотношение обеспечивает поддержание рН раствора на уровне 7,4 и позволяет корригировать и поддерживать постоянный уровень рН организма без резких колебаний.
Буферированный раствор сода-буфер является эффективным препаратом коррекции метаболических нарушений при диабетическом кетоацидозе (компенсация ацидоза к 1,4 ± 0,2 дня, дефицита бикарбоната к 2,0 ± 0,2 дня от начала лечения). Использование соды-буфер у пациентов с диабетическим кетоацидозом по 100 мл 1–2 раза в день не приводит к осложнениям и побочным эффектам, характерным для применения обычного раствора гидрокарбоната натрия.
В отделении интенсивной терапии Донецкого областного клинического территориального медицинского объединения нами обследовано 40 пациентов с кетоацидозом вследствие декомпенсации сахарного диабета I типа. Средний возраст составил 37,3 ± 2,4 года (от 25 до 58 лет). Мужчин было 11, женщин — 29. У 12 пациентов сахарный диабет был выявлен впервые, у 28 продолжительность заболевания варьировала от 3 до 22 лет и в среднем составила 8,7 ± 1,8 года. Причинами декомпенсации послужили нарушение диеты, употребление алкоголя, физические и нервно-эмоциональные нагрузки, снижение дозы вводимого инсулина.
Обследование пациентов включало общеклинические и биохимические анализы крови, мочи, КОС капиллярной крови, коагулограмму, ЭКГ, консультации эндокринолога, невропатолога, окулиста. Значения глюкозы крови исследовались каждые 1–3 часа, КОС — до и через 1 час после введения раствора сода-буфер, затем, как и остальные основные клинико-лабораторные показатели, — в динамике заболевания.
Все больные получали интенсивную терапию, направленную на регидратацию, коррекцию гипергликемии препаратами инсулина короткого действия и водно-электролитных нарушений, детоксикацию, улучшение микроциркуляции [16]. По показаниям в программу лечения включались антибактериальные, сосудистые препараты, антиагреганты, витамины и прочие медикаментозные средства. Кроме того, в составе интенсивной терапии для коррекции метаболического ацидоза применялся буферированный 4,2% раствор натрия бикарбоната сода-буфер. Препарат назначался от 1 до 2 раз в сутки в количестве 100–200 мл в течение 50–90 минут под контролем КОС крови. Каждому больному было выполнено от 1 до 4 инфузий, введение раствора сода-буфер прекращали после ликвидации дефицита оснований.
Коррекция гипокалиемии проводилась дозированным препаратом калия хлорида гик («Юрия-Фарм», Украина). К преимуществам гик можно отнести заводское изготовление препарата с невысокой концентрацией глюкозы (5 %) и осмолярностью (320 мосм/л). Для контроля уровня гликемии добавлялся инсулин в соотношении 1 : 1 или 1 : 2 к глюкозе лекарственного средства.
Состояние всех больных при поступлении было оценено как тяжелое. Степень нарушения сознания: кома (у 9 больных), сопор (у 12) и глубокое оглушение (у 19). Признаки дегидратации в виде сухих кожных покровов, снижения тургора и эластичности мягких тканей, продольных складок на языке были выявлены у всех больных. Дегидратация при стабильном артериальном давлении проявлялись тахикардией (93,3 ± 2,8 уд/мин), умеренной гемоконцентрацией (эритроциты 4,3 ± 0,2 Т/л, гемоглобин 135,3 ± 3,9 г/л). При дыхании больных отчетливо улавливался запах ацетона, одышка от 20 до 36 в 1 мин, в среднем 26,4 ± 2,1 в 1 мин. Аускультативно в легких выслушивалось дыхание с жестковатым оттенком без хрипов. При пальпации живота разлитая болезненность отмечалась у 72,4 % без нарушения перистальтики. Проба на ацетон в моче определялась как положительная и резко положительная.
У всех больных был выявлен декомпенсированный метаболический ацидоз, значения рН капиллярной крови варьировали от 6,98 до 7,29, в среднем 7,21 ± 0,02 (табл. 3). Дефицит бикарбоната составлял от 20,7 до 6,9 ммоль/л, в среднем 14,3 ± 1,3 ммоль/л. Во внеклеточной жидкости недостаток оснований — ВЕecf был еще выше. Соответственно были снижены актуальный и стандартный бикарбонат.
Несмотря на значительное снижение парциального давления СО2 и его общей концентрации в крови по сравнению с нормальными показателями, метаболический ацидоз не компенсировался дыхательным алкалозом (табл. 3).
Почечный механизм компенсации КОС, несмотря на снижение рН мочи у пациентов от 5,3 до 6,2 (в среднем 5,86 ± 0,07), также был неэффективен. Мы провели корреляционный анализ между рН крови и мочи, выявили корреляцию средней степени (показатель ранговой корреляции Cпирмена Ro = 0,432 при р = 0,04).
Метаболический декомпенсированный ацидоз закономерно сопровождался активацией системного воспалительного ответа в виде лейкоцитоза, сдвига лейкоцитарной формулы влево с увеличением индексов эндогенной интоксикации Я.Я. Кальф-Калифа и Г.А. Даштаянца (табл. 4).
После первого введения раствора сода-буфер рН достоверно увеличивался (табл. 3), причем у 82,8 % пациентов этот показатель начинал соответствовать норме. Клинически у пациентов уменьшилась тахикардия до 82,9 ± 2,9 в 1 мин, частота дыхания — до 18,5 ± 0,4 в 1 мин. Введение препарата продолжали до ликвидации дефицита бикарбоната от 1 до 3 дней. Соответствие рН нормальным величинам было в среднем достигнуто через 1,4 ± 0,2 дня, ВЕ — через 2,0 ± 0,2 дня от начала лечения. Вопреки литературным данным [17–21], применение раствора сода-буфер не привело ни к увеличению концентрации натрия, ни к повышению осмолярности (табл. 3). Несмотря на увеличение в процессе лечения, общая концентрация углекислого газа тСО2 и его парциальное давление рСО2 не превышали нормальных значений. При инфузии препарата в течение 50–90 мин не было ни озноба, ни каких-либо других клинических побочных эффектов. При компенсации метаболического ацидоза рН мочи повысился до слабокислого состояния — 6,3 ± 0,3. Выявленная корреляционная связь с рН крови и изменения рН мочи в процессе лечения позволяют ориентироваться на этот показатель для оценки КОС у больных с ДКА.
На фоне проведенной в течение 3 суток терапии у всех больных восстановилось сознание, повысился тургор и эластичность мягких тканей. Частота пульса уменьшилась до 70,9 ± 3,9 в 1 мин, дыхания — до 12,9 ± 0,6 в 1 мин. Известно, что системный воспалительный ответ может привести к развитию полиорганной недостаточности с неблагоприятным исходом заболевания [22]. В нашем исследовании при ликвидации метаболического ацидоза достоверно снизились лейкоцитоз, сдвиг лейкоцитарной формулы влево, уменьшились лимфоцитопения, индексы эндогенной интоксикации (табл. 4).
При дальнейшем лечении только у 3 больных был выявлен рецидив метаболического, но уже компенсированного ацидоза. Его причинами у 2 больных послужили обширная двусторонняя пневмония, у 1 больной — хроническая почечная недостаточность 3-й ст. Интенсивная терапия проводилась с учетом этой патологии и уже не требовала введения бикарбоната. Все больные выжили и для дальнейшего лечения были переведены в эндокринологическое отделение.
Вышесказанное позволяет сделать такие выводы:
1. Буферированный раствор сода-буфер является эффективным препаратом для коррекции метаболических нарушений при диабетическом кетоацидозе (компенсация ацидоза — через 1,4 ± 0,2 дня, дефицита бикарбоната — через 2,0 ± 0,2 дня от начала лечения).
2. Восстановление кислотно-основного состояния способствует регрессу активации системного воспалительного ответа и улучшению исхода критического состояния.
3. Использование соды-буфер у пациентов с диабетическим кетоацидозом по 100 мл 1–2 раза в день не приводит к осложнениям и побочным эффектам, характерным для применения обычного раствора гидрокарбоната натрия.
Осложнения инфузионной терапии. Наиболее частым и опасным осложнением некорректной интенсивной терапии диабетической кетоновой комы является диффузный цитотоксический отек мозга, летальность при котором достигает 90 %. Данная кома сопровождается быстро нарастающей гипергидратацией внутриклеточного пространства, в том числе клеток головного мозга, что может привести к грубым нарушениям неспецифических клеточных функций с последующей гибелью нервных клеток.
Механизмы формирования этого осложнения следующие: при поступлении больного с диабетической кетоновой комой в отделение интенсивной терапии осмолярность клеточного пространства может быть равна осмолярности внеклеточного пространства. При проведении интенсивной терапии необходимо учитывать, что осмолярность клеточного пространства изменяется более медленно, чем осмолярность внеклеточной жидкости, и быстрое снижение осмолярности внеклеточного пространства при стабильно высокой осмолярности клеток мозга будет способствовать переходу жидкости внутрь клеток и их отеку. Повышение внутриклеточной осмолярности может осуществляться и другими факторами — увеличением содержания ионов натрия внутри клетки («шоковая клетка»), развитием тканевой гипоксии за счет падения ОЦК, нарушением перфузии и увеличением концентрации гликированного гемоглобина.
Ранними признаками данного осложнения на начальном этапе являются симптомы, связанные с повышением внутричерепного давления (отек соска зрительного нерва, головная боль), а также отсутствие положительной динамики в состоянии сознания больного на фоне объективного улучшения показателей углеводного обмена и КОС крови.
Ятрогенными причинами развития отека мозга при проведении интенсивной терапии являются погрешности, резко понижающие осмолярность внеклеточного пространства: быстрое снижение концентрации глюкозы и натрия в крови, массивная регидратационная терапия, особенно большими объемами гипоосмолярных растворов. Поэтому развитие отека мозга как осложнение интенсивной терапии диабетической кетоновой комы наблюдается крайне редко в условиях тщательно контролируемого снижения содержания глюкозы, натрия и осмолярности крови.
Быстрая объемная инфузия кристаллоидных растворов, стабилизируя объем циркулирующей крови и артериальное давление, снижает онкотическое давление. Увеличение разницы между гидростатическим капиллярным и онкотическим давлением приводит к развитию отека интерстициального пространства, более выраженного в легких. Эти изменения возникают у всех больных, которым проводится массивная регидратационная терапия. У больных диабетом со сниженными компенсаторными возможностями организма, полиорганной недостаточностью возможно дальнейшее прогрессирование патологического процесса с развитием РДСВ.
Для предотвращения развития данного осложнения существуют физиологические механизмы защиты, а именно: нарастающая дегидратация приводит к включению ауторегуляционных механизмов, способствующих повышению осмолярности клеток мозга и, следовательно, уменьшающих потери жидкости клетками ЦНС. Повышение внутриклеточной осмолярности достигается за счет активного перехода глюкозы из внеклеточного сектора в инсулиннезависимые клетки мозга, а при недостаточности этого механизма активизируется сорбитоловый путь трансформации глюкозы во фруктозу, образование так называемых идиогенных осмолей.
Продолжение в следующем номере
/160.jpg)
/161.jpg)

/154.jpg)
/155.jpg)
/156.jpg)
/160_2.jpg)
/161_2.jpg)
/163.jpg)
/164.jpg)