Журнал «Медицина неотложных состояний» 6 (77) 2016
Вернуться к номеру
Феохромоцитома: особливості гемодинамічного контролю при лапароскопічних адреналектоміях
Авторы: Кунатовський М.В. - ДУ «Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України», м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Мета роботи: упровадження сучасного анестезіологічного менеджменту пацієнтів із феохромоцитомою в умовах спеціалізованого ендокринологічного центру із застосуванням алгоритму етапного періопераційного гемодинамічного контролю. Матеріали і методи. Проведена імплементація анестезіологічного менеджменту в 33 жінок із феохромоцитомою надниркових залоз при хірургічному її видаленні шляхом відеоасистованої лапароскопічної адреналектомії. Усім пацієнткам застосовувався алгоритм етапного періопераційного гемодинамічного менеджменту (ЕПОГМ): передопераційна таблетована гіпотензивна терапія до надходження в стаціонар, передопераційна інфузійна керована гіпотензивна терапія урапідилом та корекція гіповолемії збалансованими кристалоїдними розчинами та 10% розчином гідроксіетилкрохмалю (ГЕК) (200/0,5) на 2-му етапі, інтраопераційна інфузійна керована гіпотензивна терапія урапідилом на 3-му етапі під контролем інвазивного та неінвазівного моніторингу гемодинаміки й профілактика надниркової недостатності та корекція гіповолемії. Результати та обговорення. У всіх хворих був вірогідно (p < 0,001) відмічений підвищений рівень метанефринів добової сечі до 1831,6 ± 337,9 мкг/24 год (контроль — 169,3 ± 12,7 мкг/24 год). Згідно з розробленим алгоритмом ЕПОГМ на першому етапі застосовували доксазозин у дозі 10,0 ± 1,0 мг або урапідил у дозі 144,0 ± 11,2 мг у 2 прийоми. На другому етапі виконували гемодилюцію 10% розчином ГЕК (200/0,5) та інфузійну керовану гіпотензивну терапію урапідилом із середньою швидкістю 9,7 ± 1,9 мг/год. На третьому етапі інтраопераційно швидкість інфузії урапідилу становила 1,25 ± 0,08 мг/хв (додатково при хірургічному виділенні надниркової залози з феохромоцитомою болюсно вводився урапідил 25–50 мг в/в при виявленні навіть мінімального підвищення артеріального тиску). На четвертому етапі здійснювалась профілактика надниркової недостатності та гіповолемії. Висновки. Упровадження анестезіологічного менеджменту пацієнтів з феохромоцитомами в спеціалізованому ендокринологічному центрі забезпечило високу ефективність та безпеку при лапароскопічних адреналектоміях під час загальної анестезії. ЕПОГМ при підготовці до операції та під час хірургічного втручання є ефективним, легко керованим та безпечним методом стабілізації показників гемодинаміки. Летальних випадків не було.
Цель работы: внедрение современного анестезиологического менеджмента пациентов с феохромоцитомой в условиях специализированного эндокринологического центра с применением алгоритма этапного периоперационного гемодинамического контроля. Материалы и методы. Проведена имплементация анестезиологического менеджмента у 33 женщин с феохромоцитомой надпочечников при хирургическом ее удалении путем видеоассистированной лапароскопической адреналэктомии. Всем пациенткам применялся алгоритм этапного периоперационного гемодинамического менеджмента (ЭПОГМ): предоперационная таблетированная гипотензивная терапия до поступления в стационар, предоперационная инфузионная управляемая гипотензивная терапия урапидилом и коррекция гиповолемии сбалансированными растворами кристаллоидов и 10% раствором гидроксиэтилкрахмала (ГЭК) (200/0,5) на 2-м этапе, интраоперационная инфузионная управляемая гипотензивная терапия урапидилом на 3-м этапе под контролем инвазивного и неинвазивного мониторинга гемодинамики и профилактика надпочечниковой недостаточности и коррекция гиповолемии. Результаты и обсуждение. У всех больных был достоверно (p < 0,001) отмечен повышенный уровень метанефринов суточной мочи — до 1831,6 ± 337,9 мкг/24 ч (контроль — 169,3 ± 12,7 мкг/24 ч). Согласно разработанному алгоритму ЭПОГМ на первом этапе применяли в 2 приема или доксазозин в дозе 10,0 ± 1,0 мг, или урапидил в дозе 144,0 ± 11,2 мг. На втором этапе выполняли гемодилюцию 10% раствором ГЭК (200/0,5) и инфузионную управляемую гипотензивную терапию урапидилом со средней скоростью 9,7 ± 1,9 мг/ч. На третьем этапе интраоперационно скорость инфузии урапидила составила 1,25 ± 0,08 мг/мин (дополнительно при хирургическом выделении надпочечника с феохромоцитомой болюсно вводился урапидил 25–50 мг в/в при обнаружении даже минимального повышения артериального давления). На четвертом этапе осуществлялась профилактика надпочечниковой недостаточности и гиповолемии. Выводы. Внедрение анестезиологического менеджмента пациентов с феохромоцитомами в специализированном эндокринологическом центре обеспечило высокую эффективность и безопасность при лапароскопических адреналэктомиях под общей анестезией севораном и отсутствие летальных исходов. ЭПОГМ при подготовке к операции и во время хирургического вмешательства является эффективным, легко управляемым и безопасным методом стабилизации показателей гемодинамики у пациентов с феохромоцитомами во время адреналэктомии.
Aim: the introduction of modern anesthetic management of patients with pheochromocytoma in a specialized endocrinology center using the algorithm of staged perioperative hemodynamic monitoring. Materials and methods. The anesthetic management was implemented in 33 women with pheochromocytoma during surgical removal by video-assisted laparoscopic adrenalectomy. In all patients we have used an algorithm of staged perioperative hemodynamic management (SPOHM): preoperative tableted hypotensive therapy before admission to the hospital; preoperative infusion controlled hypotensive therapy by urapidil and correction of hypovolemia by balanced crystalloid solutions and a 10% solution of hydroxiethyl starch (HES) (200/0.5) on the 2nd stage; intraoperative infusion controlled antihypertensive therapy by urapidil on the 3rd stage under the control of invasive and non-invasive hemodynamic monitoring and prevention of adrenal insufficiency and hypovolemia correction. Results and discussion. All patients had significantly (p < 0.001) increased levels of daily urine metanephrines up to 1,831.6 ± 337.9 mg/24 h (control of 169.3 ± 12.7 mg/24 h). According to developed SPOHM algorithm, doxazosin 10.0 ± 1.0 mg or urapidil 144.0 ± 11.2 mg were used twice daily at the first stage. On the second stage, we have performed hemodilution by 10% solution of HES (200/0.5) and controlled infusion antihypertensive therapy by urapidil in an average speed 9.7 ± 1.9 mg/hr. During the third stage, infusion rate of urapidil was 1.25 ± 0.08 mg/min intraoperatively (additionaly, during the surgical removal of pheochromocytoma, urapidil 25–50 mg i/v bolus was administered even if the slightest increase of blood pressure was detected). On the fourth stage, there was conducted the prevention of adrenal insufficiency and hypovolemia. Conclusions. The introduction of anesthetic management of patients with pheochromocytoma in a specialized endocrinological center has provided a high efficiency and safety of laparoscopic adrenalectomy under general anesthesia. EPOGM is effective, easily manageable and safe method for the stabilization of hemodynamic markers in the preparation for surgery and during surgical intervention. There were no deaths.
феохромоцитома, анестезія, етапний періопераційний гемодинамічний менеджмент, урапідил, ГЕК.
феохромоцитома, анестезия, этапный периоперационный гемодинамический менеджмент, урапидил, ГЭК.
pheochromocytoma, anesthesia, staged perioperative hemodynamic management, urapidil, hydroxiethyl starch.
Статтю опубліковано на с. 49-56
Феохромоцитоми, відомі також під назвою хромафінних пухлин, секретують і накопичують катехоламіни й найчастіше виникають у мозковому шарі надниркових залоз. Поза наднирковими залозами феохромоцитоми утворюються з хромафінних клітин, розташованих у симпатичних гангліях або біля них і називаються позанаднирковими феохромоцитомами, або парагангліомами [1, 2, 4].
Матеріали та методи
/52.jpg)
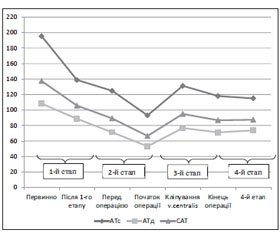
Результати та обговорення
/53.jpg)
Висновки
1. Харрісон Т.Р. Внутрішні хвороби. Ч. 2 / Пер. з англ.: д.м.н. А.В. Сучкова, к.м.н. Н.Н. Заваденко, к.м.н. Д.Г. Катковський. — М.: Медицина, 1992–1997. — 3430 с.
2. Daniel D. Kim, Christiano Matsui, Judymara L. Gozzani, Ligia A.S.T. Mathias. Pheochromocytoma Anesthetic Management // Open Journal of Anesthesiology. — 2013. — 3. — 152-155.
3. Fernández-Cruz L., Puig-Domingo M., Halperin I., Sesmilo G. Pheochromocytoma // Scand. J. Surg. — 2004. — 93. — 302-309.
4. Chen H., Sippel R.S., O’Dorisio M.S., Vinik A.I., Lloyd R.V. and Pacak K. North American Neuroendocrine Tumor Society (NANETS). The North American Neuroendocrine Tumor Society Consensus Guideline for the Diagnosis and Management of Neuroendocrine Tumors: Pheochromocytoma, Paraganglioma, and Medullary Thyroid Cancer // Pancreas. — 2010. — Vol. 39. — Р. 775-783.
5. Lenders et al. Guidelines on Pheochromocytoma and Paraganglioma // J. Clin. Endocrinol. Metab. — June 2014. — 99(6). — 1915-1942.
6. Черенько С.М., Дубров С.О., Кунатовський М.В., Товкай О.А., Тарасенко С.О. Анестезіологічний менеджмент феохромоцитом в умовах спеціалізованого ендокринологічного центру // Міжнародний ендокринологічний журнал. — 2016. — № 2(74). — С. 115-123.
7. Bajwa S.S., Bajwa S.K. Implications and Considerations during Pheochromocytoma Resection: A Challenge to the Anesthesiologist // Indian Journal of Endocrinology & Metabolism. — 2011. — Vol. 15, № S4. — Р. S337-S344.
8. Eisenhofer G., Rivers G., Rosas A.L., Quezado Z., Manger W.M. and Pacak K. Adverse Drug Reactions inPatients with Phaeochromocytoma: Incidence, Prevention and Management // Drug Safety. — 2007. — Vol. 30. — Р. 1031-1062.
9. Kinney M.A., Narr B.J., Warner M.A. Perioperative Management of Pheochromocytoma // Journal of Cardiothoracic and Vascular Anesthesia. — 2002. — Vol. 16. — Р. 359-369.
10. Habbe N., Ruger F., Bojunga J., Bechstein W.O., Holzer K. Urapidil in the preoperative treatment of pheochromocytomas: a safe and cost-effective method // World J. Surg. — 2013 May. — 37(5). — 1141-6.
11. Steib A., Collin F., Stojeba N., Coron T., Weber J.C., Beller J.P. Use of urapidil during surgery for pheochromocytoma // Ann. Fr. Anesth. Reanim. — 1996. — 15(2). — 142-8.
12. Кунатовський М.В. Передопераційна медикаментозна підготовка α-адреноблокаторами як невід’ємна складова периопераційного анестезіологічного менеджменту лапароскопічних адреналектомій при феохромоцитомі / М.В. Кунатовський // Клінічна ендокринологія та ендокринна хірургія. — 2016. — № 2. — С. 74-84.
13. Садриев О.Н., Гаибов А.Д., Анварова Ш.С., Авгонов У.М. Диагностика и лечение феохромоцитомы // Кардиология и сердечно-сосудистая хирургия. — 2014. — № 5. — С. 52-56.
14. Інструкція з медичного застосування препарату Рефортан плюс 10 %, Р.П. № UA/6680/01/01 від 28.09.2012. Наказ МОЗ № 755 від 28.09.2012.
15. Дубров С.О., Глумчер Ф.С., Гавриленко О.О., Тарасенко С.О., Сем’янків А.М. Профілактика венозних тромбоемболічних ускладнень у пацієнтів у торакальній хірургії // Досягнення біології та медицини. — 2012. — № 1(19). — С. 43-46.

/50.jpg)
/51.jpg)
/53_2.jpg)