Международный неврологический журнал 4 (66) 2014
Вернуться к номеру
Диагностика и лечение нарушений церебральной гемодинамики у больных с хроническим обструктивным заболеванием легких
Авторы: Кунцевская И.В. - Городская больница № 1, г. Севастополь, АР Крым
Рубрики: Неврология, Пульмонология
Разделы: Справочник специалиста
Версия для печати
В статье представлены результаты исследования особенностей мозговой гемодинамики по данным магнитно-резонансной ангиографии и допплерографии у больных с хроническими обструктивными заболеваниями легких. Выявлено нарушение как артериального, так и венозного звеньев кровообращения. Сделан вывод о целесообразности применения препарата диосмин в составе комплексной терапии.
У статті наведено результати дослідження особливостей мозкової гемодинаміки за даними магнітно-резонансної ангіографії і допплерографії у хворих із хронічними обструктивними захворюваннями легень. Виявлено порушення як артеріальної, так і венозної ланок кровообігу. Зроблено висновок про доцільність вживання препарату діосмін у складі комплексної терапії.
The article presents the findings on the features of cerebral hemodynamics according to magnetic resonance angiography and Doppler ultrasound data in patients with chronic obstructive pulmonary diseases. It is found a violation of both arterial and venous circulation. A conclusion was made about the appropriateness of diosmin use in the complex therapy.
хронические обструктивные заболевания легких, допплерография церебральных сосудов, магнитно-резонансная ангиография, диосмин.
хронічні обструктивні захворювання легень, допплерографія церебральних судин, магнітно-резонансна ангіографія, діосмін.
chronic obstructive pulmonary diseases, cerebral vascular Doppler ultrasound, magnetic resonance angiography, diosmin.
Статья опубликована на с. 132-136
Хроническое обструктивное заболевание легких (ХОЗЛ) является чрезвычайно серьезной медицинской и социальной проблемой. Это обусловлено высоким ростом заболеваемости, инвалидности и смертности больных ХОЗЛ. Все чаще из-за многочисленных клинических проявлений ХОЗЛ относят к системной патологии. Согласно современным представлениям, одним из системных проявлений ХОЗЛ является поражение центральной нервной системы [4].
При ХОЗЛ создаются благоприятные условия для формирования кардиоваскулярной патологии: системной артериальной гипертензии, атеросклероза и ишемический болезни сердца (ИБС). Это свидетельствует не только о сочетании ХОЗЛ и сердечно-сосудистой патологии, но и о существовании сердечно-респираторного континуума, в котором ХОЗЛ является непосредственным участником формирования артериальной гипертензии, атеросклероза и ИБС.
В основе их развития лежит комплекс патогенетических механизмов, которые действуют непосредственно на органы-мишени или опосредованно через развитие повреждения сосудистой стенки и эндотелиальной дисфункции. К таким факторам относят гипоксемию в покое или при физической нагрузке, курение, оксидативный стресс, системное воспаление.
В последнее время ХОЗЛ рассматривается как системное заболевание, при котором формируются множественные осложнения и в первую очередь возникают изменения в структурах организма с наиболее высоким уровнем метаболических процессов, таких как центральная нервная система.
В связи с высокой активностью головной мозг обладает большой потребностью в кислороде. В отличие от других органов головной мозг практически не располагает запасами кислорода, потребляемого им для получения энергии. Этим объясняется высокая чувствительность нервной ткани к гипоксии, являющейся одним из ведущих факторов в поражении головного мозга на фоне ХОЗЛ [3]. Гипоксия рано проявляется не только расстройствами функции, но и нарушением строения различных клеток мозга (нейроны, глия) и синаптических структур.
У больных ХОЗЛ, благодаря наличию таких факторов, как гипоксемия, действие поллютантов сигаретного дыма, гемодинамического и оксидативного стресса, системного воспаления, дисбаланса в системе «протеиназы — ингибиторы», наблюдается раннее формирование эндотелиальной дисфункции, которая ассоциируется с высоким риском цереброваскулярной патологии [2].
В настоящее время накапливается все больше и больше данных, что персистирующее системное воспаление, присутствующее при ХОЗЛ, вносит свой вклад в патогенез атеросклероза [3].
При нарастании стадии ХОЗЛ у больных отмечаются явления декомпенсации венозного кровообращения. Венозная энцефалопатия является наиболее частым проявлением расстройств венозного мозгового крово–обращения [9]. При нарастании венозного застоя наступают значительные изменения мозгового метаболизма, нарушается кислородный, водный, углеводный, жировой баланс мозга, нарастают гипоксия и гиперкапния, повышается венозное и внутричерепное давление [1, 5, 6].
Развитие магнитно-резонансной томографии (МРТ) и магнитно-резонансной ангиографии (МРА) открывает новые возможности для получения мультипланарных изображений всего сосудистого комплекса [10]. Такие широкие возможности в визуализации центральной нервной системы, реализуемые в МРТ, не может предложить ни один другой метод лучевой диагностики [7].
Исследование изменений сосудов головного мозга, выявление взаимосвязи и степени их выраженности в зависимости от стадии ХОЗЛ представляет большой интерес для клинической медицины. Это поможет своевременно назначить корригирующую терапию пациентам с ХОЗЛ, тем самым улучшая качество жизни данных больных [8].
В связи с вышеперечисленным целью данной работы были изучение изменений церебральной гемодинамики в зависимости от стадии ХОЗЛ и коррекция выявленных изменений.
Материалы и методы
При проведении исследований нами был обследован 91 пациент. Средний возраст 62,0 ± 4,2 года (от 45 до 78 лет).
Критерии включения: диагноз ХОЗЛ, верифицированный пульмонологом на основании проведения спирографического исследования; отсутствие цереброваскулярной патологии, артериальное давление (АД) менее 140/90 мм рт.ст.
Всем пациентам проводили общеклиническое и неврологическое обследование. Церебральную гемодинамику исследовали при помощи цветного дуплексного сканирования экстра- и интракраниальных сосудов на приборе SA-8000 EX (MEDISON). Ультразвуковую допплерографию сосудов головного мозга проводили в следующем объеме: внутренняя сонная артерия (ВСА), позвоночная артерия (ПА); передняя мозговая артерия (ПМА), средняя мозговая артерия (СМА), задняя мозговая артерия (ЗМА). При визуальной оценке состояния сосудистого русла оценивали проходимость сосуда (проходим, окклюзирован), направление его хода (наличие деформаций — изгибы, извитости, петли), подвижность сосудистой стенки (ригидность, гиперпульсация), состояние комплекса интима-медиа (плотность, толщина, форма поверхности, однородность). Исследование венозного кровотока проводилось с помощью определения скорости кровотока по вене Розенталя. Основные показатели рассчитывались по количественным характеристикам. Количественная оценка кровотока в артериях была основана на непосредственно измеряемых параметрах допплерограммы (амплитуда, частота, распределение частот, импульсные вариации) и рассчитываемых различных индексах. Этими показателями являлись: линейная скорость кровотока, индекс пульсации Гослинга. Также проводилась гиперкапническая проба путем задержки дыхания на 30 с.
Магнитно-резонансную томографию проводили на томографе General Electric с напряженностью магнитного поля 0,2 Т. По данным МРТ у больных ХОЗЛ изучались структурно-морфологические изменения. При выявлении патологического очага анализировались: характер изменения сигнала, локализация, размеры, контуры. При множественном поражении учитывалось количество очагов, их расположение и наличие слияния. Градации очаговых изменений белого вещества проводились по следующим количественным признакам: 0 баллов — признаки повышенной интенсивности сигнала отсутствуют (на Т2-изображениях); 1 балл — менее чем 5 мелких (до 5 мм) локальных и/или менее чем 2 кpупных (5–10 мм) локальных очага; 2 балла — 5–12 мелких и/или 2–4 кpупных локальных очага; 3 балла — более чем 12 мелких и/или более чем 4 кpупных локальных или несколько сливающихся очагов; 4 балла — преимущественно сливающиеся очаги. Также больным проводилась МРА с целью изучения особенностей артериального и венозного интракраниального кровоснабжения.
Коррекцию венозного оттока проводили в основной группе с помощью препарата диосмин. Препарат назначался в дозе 600 мг (1 таблетка) утром на протяжении месяца. Церебральную гемодинамику оценивали до и после лечения.
Статистическая обработка полученных результатов проводилась с помощью пакета прикладных программ Microsoft Excel, Statistica 6 с оценкой средних значений М, средней квадратической ошибки m. Достоверность различия между группами оценивалась с помощью критерия Стьюдента, непараметрического критерия Манна — Уитни.
При проведении исследования все пациенты были разделены на следующие группы:
1. Основная группа — пациенты с ХОЗЛ I, II, III стадии. Основная группа была разделена на 3 подгруппы в зависимости от стадии ХОЗЛ: I подгруппа — пациенты с ХОЗЛ I стадии (41 обследуемый), II подгруппа — пациенты с ХОЗЛ II стадии (27 обследуемых), III подгруппа — пациенты с ХОЗЛ III стадии (23 обследуемых).
2. Контрольная группа — 10 практически здоровых человек; группа того же возрасто-полового состава.
Группы не отличались по полу, возрасту, средним цифрам АД.
Результаты и их обсуждение
При исследовании неврологического статуса определялась микросимптоматика. Для обследуемых были характерны анизорефлексия, интенция при проведении пальценосовой пробы, положительные субкортикальные знаки.
При проведении МРТ не было выявлено специфических признаков, которые были бы характерны для поражения головного мозга на фоне ХОЗЛ. У больных выявлены множественные мелкие гиперденсивные очаги и умеренный лейкоареоз в белом веществе головного мозга, а также расширение желудочковой системы и субарахноидальных ликворных пространств.
При проведении МРА было выявлено, что у 66 % больных основной группы отмечалось наличие незамкнутого виллизиевого круга, преимущественно за счет отсутствия кровотока по передней и задней соединительным артериям.
Состояние венозной системы было изучено нами при помощи МР-венографии (МРВ). В норме сигнал кровотока в крупных венах и венозных синусах головного мозга имеет равномерную интенсивность. Контуры потока естественно ограничены стенками сосудов, границы потока ровные и четкие. Правая внутренняя яремная вена несколько шире левой. Позвоночные вены или сплетения в горизонтальном положении тела могут плохо визуализироваться вследствие того, что отток из полости черепа в этом положении в норме осуществляется в основном по яремным венам. В местах слияния двух вен наблюдаются участки снижения сигнала из-за артефакта турбулентности потока. На остальных участках вен сигнал однороден по интенсивности и постепенно несколько ослабевает в направлении верхней полой вены.
На полученных при МРВ-изображениях оценивали верхний сагиттальный, прямой, поперечные, сигмовидные венозные синусы головного мозга, а также внутренние яремные вены с обеих сторон. В норме сигнал кровотока в крупных венах и венозных синусах головного мозга имеет равномерную интенсивность.
По данным МРВ у 81 % больных выявлена асимметрия магистральных венозных коллекторов: у 44 % обследуемых преимущественно расширены вены и синусы с правой стороны, у 37 % — с левой стороны. По степени выраженности асимметрии венозных синусов пациенты были разделены на группы следующим образом: легкая степень — менее 15 %, умеренно выраженная степень — от 15 до 30 %, выраженная степень — от 30 до 80 %, тяжелая степень — более 80 %. У 8 % пациентов основной группы выявлялась легкая асимметрия, у 17 % обнаружена умеренно выраженная асимметрия, у 56 % — выраженная асимметрия. У пациентов с выраженной асимметрией кровотока лейкоареоз 2-й степени встречается в 31 % случаев, в то время как у больных с легкой и умеренно выраженной асимметрией наблюдалась лишь 0–1-я стадия лейкоареоза.
В группе контроля асимметрия венозного кровотока наблюдалась у 54 % обследуемых, преимущественно легкой и умеренно выраженной степени.
У 40 % пациентов основной группы наблюдалось повышение МР-сигнала от правого поперечного синуса, что, вероятнее всего, обусловлено замедлением тока крови по синусу.
Таким образом, у большинства больных с ХОЗЛ отмечаются признаки нарушения венозного кровообращения головного мозга в виде замедления тока крови по синусам, асимметрии магистральных венозных коллекторов.
Такие клинические и структурные изменения головного мозга предполагают нарушение гемодинамики.
При изучении сосудов головного мозга по данным допплерографии в основной группе отмечался ряд сосудистых аномалий. Структурно-функциональные изменения церебральных сосудов чаще были в виде S- или С-образной извитости ВСА, гипо- или аплазий позвоночных артерий, патологической извитости позвоночных артерий, а также различных сочетаний. При проведенном нами исследовании не было выявлено достоверной разницы в наличии аномалий сосудов (в I подгруппе сосудистые аномалии выявлены у 75 %, во II подгруппе — у 81 %, в III подгруппе — у 49 %, в группе контроля — у 52 % пациентов).
По данным церебральной допплерографии было произведено исследование цереброваскулярного резерва путем проведения гиперкапнической пробы. В основе пробы лежит произвольная задержка дыхания, что влечет за собой увеличение содержания углекислого газа в плазме крови. Это приводит к раздражению рецепторов синокаротидной зоны и гладкомышечных элементов сосудистой стенки, результатом чего является расширение терминальных артерий и артериол, что сопровождается общим снижением периферического сопротивления и возрастанием кровотока в крупных интракраниальных артериях.
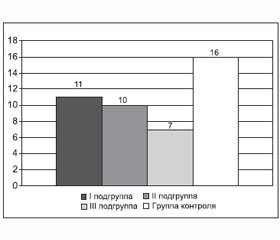
Прирост скорости кровотока по СМА при проведении гиперкапнической пробы отражен на рис. 1.
/134/134.jpg)
Недостаточная реакция сосудов головного мозга у больных ХОЗЛ после проведения пробы с гиперкапнией свидетельствует о снижении функционального резерва мозгового кровообращения у больных ХОЗЛ I стадии, которое усугублялось по мере прогрессирования заболевания, что повышает риск развития церебральных осложнений у больных ХОЗЛ III стадии. Снижение функционального резерва мозгового кровообращения уже на ранних стадиях ХОЗЛ свидетельствовало об ограничении компенсаторно-приспособительных возможностей мозговой гемодинамики.
При анализе показателей церебральной допплерографии выявлено, что в III подгруппе имеется достоверное снижение скорости кровотока по ПМА, ЗМА, ПА. Также имеет место достоверное увеличение индекса пульсации в СМА и ЗМА, что является доказательством снижения эластичности сосудистой стенки. Все это свидетельствует об ухудшении артериального кровоснабжения при прогрессировании ХОЗЛ. Также отмечается достоверное увеличение скорости кровотока по вене Розенталя в III подгруппе. Данные изменения свидетельствуют о нарушении венозного оттока из полости черепа.
Изменения церебральной гемодинамики в зависимости от стадии ХОЗЛ отражены в табл. 1.
Таким образом, по данным транскраниальной допплерографии имеется поражение как артериального, так и венозного кровоснабжения на фоне прогрессирования ХОЗЛ, что дало основание к назначению препарата из группы венотоников, а именно диосмина, на фоне применения препаратов для лечения ХОЗЛ.
При исследовании изменений церебральной гемодинамики в результате лечения по данным допплерографии были получены сдвиги, отраженные в табл. 2.
Диосмин обладает венотонизирующим действием, уменьшает растяжимость вен, повышает их тонус, уменьшает венозный застой, улучшает лимфатический дренаж, повышает тонус и частоту сокращения лимфатических капилляров, увеличивает их функциональную плотность, снижает лимфатическое давление, улучшает микроциркуляцию, повышает резистентность капилляров, уменьшает их проницаемость, уменьшает адгезию лейкоцитов к венозной стенке и их миграцию в паравенозные ткани.
После курса лечения препаратом диосмин у больных наблюдается достоверное уменьшение скорости кровотока по вене Розенталя, что свидетельствует об улучшении венозного оттока. Также отмечаются улучшение артериального кровотока, нормализация индекса пульсации, улучшение цереброваскулярного резерва. Таким образом, включение диосмина в комплексную терапию приводит к улучшению показателей церебральной гемодинамики.
Выводы
1. На фоне прогрессирования ХОЗЛ у исследуемых больных происходит нарушение как артериального, так и венозного кровообращения.
2. По данным МРВ в основной группе отмечается увеличение количества больных с асимметрией венозного кровотока, что является одним из показателей нарушенного венозного кровообращения. У больных с большей выраженностью лейкоареоза наблюдается более выраженная асимметрия венозного кровотока, что свидетельствует о тесной связи нарушения венозного кровотока и структурных нарушений головного мозга.
3. По данным допплерографии наблюдается снижение скоростных показателей по исследуемым артериям и уровня цереброваскулярного резерва. Снижение этих показателей происходит по мере нарастания стадии ХОЗЛ.
4. У больных выявлено нарушение венозной гемодинамики, проявляющееся увеличением скоростных показателей в вене Розенталя по мере прогрессирования ХОЗЛ.
5. Применения венотоника диосмина способствует нормализации как венозного, так и артериального кровообращения, тем самым положительно влияя на церебральную гемодинамику в целом.
1. Афанасьева Н.Л., Мордовин В.Ф. Диагностика нарушений венозного кровообращения головного мозга у пациентов с гипертонической болезнью // Медицинская визуализация. — 2007. — № 6. — С. 27–31.
2. Белова Л.А. Роль артерио–венозных взаимоотношений в формировании клинико–патогенетических вариантов гипертонической энцефалопатии // Журнал неврологии и психиатрии. — 2012. — № 6. — С. 8–13.
3. Булдакова И.А., Григоренко А.А. Изменения артериального сосудистого русла при хронической обструктивной болезни легких // Дальневосточный медицинский журнал. — 2011. — № 4. — С. 115–118.
4. Киняйкин М.Ф., Суханова Г.И., Наумова И.В., Кузнецова Т.А., Овчинников А.Я., Княженская Н.П. Некоторые аспекты диагностики и лечения хронической обструктивной болезни легких // Медицинский совет. — 2010. — № 1–2. — С. 45–53.
5. Мищенко Т.С., Здесенко И.В. Терапевтические возможности коррекции венозных нарушений при дисциркуляторной энцефалопатии // Международный неврологический журнал. — 2013. — № 2. — С. 141–146.
6. Путилина М.В., Ермошкина Н.Ю. Венозная энцефалопатия. Возможности диагностики и лечения // Журнал неврологии и психиатрии. — 2013. — № 9. — С. 89–93.
7. Савельева Л.А., Тулупов А.А. Особенности венозного оттока от головного мозга, по данным магнитно-резонансной ангиографии // Вестник Новосибирского государственного университета. — 2009. — № 7. — С. 36–40.
8. Семенов С.Е., Абалмасов В.Г. Диагностика нарушений церебрального венозного кровообращения с применением магнитно-резонансной венографии // Журнал неврологии и психиатрии. — 2000. — № 10. — С. 44–50.
9. Stam J. Thrombosis of the cerebral veins and sinuses // New Engl. J. Med. — 2005. — V. 352. — P. 1791–1798.
10. Liauw L., Buchem M.A., Spilt A. et al. MR angiography of the intracranial venous system // Radiology. — 2000. — Vol. 3. — P. 678–683.

/135/135.jpg)