Международный неврологический журнал 6 (60) 2013
Вернуться к номеру
Спинальные мышечные атрофии и боковой амиотрофический склероз как проявление болезни двигательного нейрона у детей
Авторы: Евтушенко С.К., Морозова Т.М., Шестова Е.П., Омельяненко А.А., Симонян В.А., Луцкий И.С. - Кафедра детской и общей неврологии, УНИПО Донецкого национального медицинского университета им. М. Горького
Рубрики: Неврология, Нефрология, Педиатрия/Неонатология
Разделы: Медицинское образование
Версия для печати
Болезнь двигательного нейрона (БДН) охватывает широкий спектр дегенеративных нейромышечных заболеваний, которые сопровождаются гибелью периферических и центральных двигательных нейронов, неуклонным прогрессированием и летальным исходом.
Различные виды БДН отличаются главным образом типом наследования, преимущественной локализацией нейродегенеративного процесса, возрастом начала и скоростью прогрессирования заболевания. Традиционно к болезням периферического (нижнего) нейрона относят спинальные мышечные атрофии (СМА), а к болезням центрального (верхнего) нейрона — боковой амиотрофический склероз (БАС).
В МКБ-10 подрубрики «СМА» и «БДН» разделены в зависимости от частоты, тяжести заболевания, степени вовлечения различных уровней нервной системы и представлены в рубрике G12 Спинальная мышечная атрофия и родственные синдромы блока «Системные атрофии, поражающие преимущественно центральную нервную систему» (табл. 1).
Постановка диагноза при этих заболеваниях ставит много вопросов как перед родственниками больного, так и перед смежными специалистами. Для комплексного решения этих задач невролог должен обладать современной информацией о течении болезни, патогенезе, классификации фенотипа, прогнозе для больного, генетических ассоциациях, возможности участия в клинических испытаниях новых препаратов/технических устройств.
1. Болезнь двигательного нейрона — спинальные мышечные атрофии
Спинальные мышечные атрофии характеризуются дегенерацией периферических двигательных альфа-нейронов спинного мозга и ствола головного мозга. СМА представляют собой гетерогенную группу прогрессирующих заболеваний генетической природы, которые имеют чаще аутосомно-рецессивный (А-Р), реже — аутосомно-доминантный (А-Д) или Х-сцепленный тип наследования. Частота СМА 1 на 6000–10 000 новорожденных.
Врачи, выявляющие симптомы слабости и диффузной гипотонии у детей, должны иметь в виду высокую вероятность диагноза СМА. Дегенерация мотонейронов в спинном мозге, двигательных ядрах ствола мозга приводит к возникновению симметричного вялого паралича поперечнополосатых мышц конечностей и туловища. В классических вариантах отмечаются преимущественное преобладание слабости в проксимальных группах мышц, чем в дистальных, большая слабость в ногах, чем в руках, симметричность снижения силы, отсутствие нарушений чувствительности, снижение или отсутствие сухожильных рефлексов. Как правило, выраженность слабости коррелирует с возрастом начала заболевания.
Наибольшую распространенность имеют проксимальные формы с аутосомно-рецессивным типом наследования, которые составляют 80–85 % от всех наследственных СМА. Дистальные спинальные амиотрофии составляют не менее 10 % всех СМА. Учитывая, что распространение мышечной слабости при дистальных СМА сходно с таковым при поражении периферических нервов, ряд авторов обозначает дистальные СМА как дистальные наследственные моторные нейронопатии (dHMN). Отличительными особенностями дистальных СМА от наследственных моторно-сенсорных нейропатий являются: отсутствие чувствительных нарушений, длительная сохранность сухожильных рефлексов, нормальные скорости проведения импульса по периферическим нервам и отсутствие изменения сенсорного потенциала.
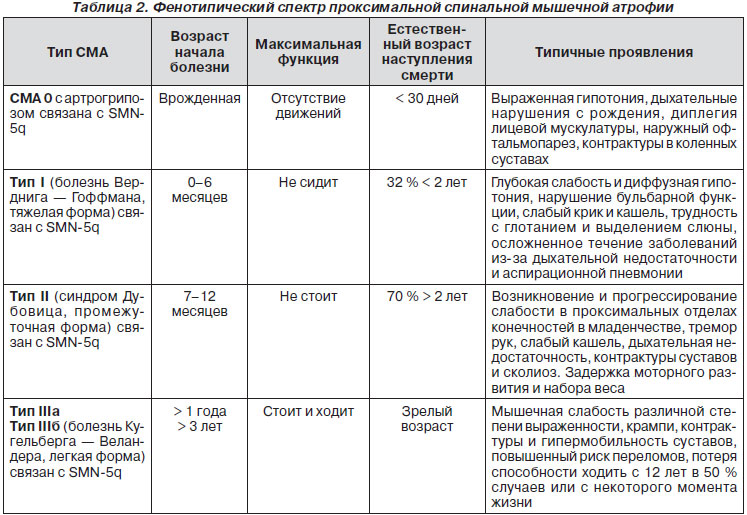
Диагностические критерии основных СМА, варианты инфантильных форм СМА, терапевтическая стратегия и модификация, основанные на результатах картирования генов и предродового диагноза, были предложены International SMA Consortium, 2007, 2012 (ISMAC). Наиболее адекватной классификацией является та, в основе которой лежит принцип различия генных мутаций, в том числе в так называемом SMN-гене (ген выживания мотонейрона) (табл. 2).
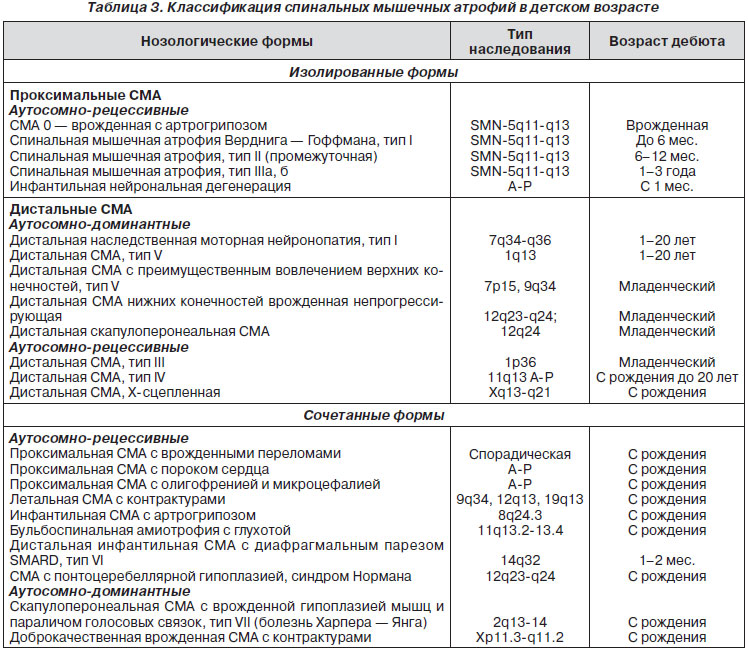
Для удобства описания проводится также условное выделение 2 основных групп СМА: изолированные и сочетанные (табл. 3).
Изолированные СМА включают все нозологические формы, при которых симптомокомплекс поражения передних рогов спинного мозга служит ведущим и в большинстве случаев единственным клиническим проявлением. В рамках этой группы традиционно выделяют подгруппы, различающиеся по локализации мышечных атрофий.
Под сочетанными СМА подразумеваются те редкие клинические варианты заболеваний, которые характеризуются комбинацией периферического вялого паралича с другой неврологической симптоматикой, а также поражением других органов и систем и необычной комбинацией симптомов.
Электронейромиографический (ЭНМГ) маркер СМА: характерные признаки денервации, вследствие поражения мотонейронов — спонтаннная ритмическая активность («ритм частокола»), потенциалы фибрилляций, потенциалы фасцикуляций, положительные острые волны, изменение потенциалов двигательных единиц с формированием гигантских полифазных потенциалов, уменьшение числа двигательных единиц.
При морфологическом исследовании мышц выявляются специфические признаки мышечного поражения в виде избыточной неравномерности диаметра мышечных волокон: скопления уменьшенных в размере волокон (пучковая атрофия), чередуются с участками гипертрофированных волокон.
Проксимальные спинальные мышечные атрофии I, II и III типа
Заболевание встречается в трех аллельных вариантах, различающихся возрастом начала и тяжестью клинического течения. I вариант описан G. Werdnig в 1891 году, II промежуточный вариант предложил Dubowitz, III вариант — E. Kugelberg и L. Welander в 1956 году. Тип наследования — аутосомно-рецессивный.
Гены, ответственные за возникновение всех трех вариантов заболевания, картированы в области хромосомы 5q12.2-q13.3. Эта область представлена инвертированным повтором и включает по крайней мере четыре гена, мутации в которых могут иметь значение в развитии заболевания или модифицировать тяжесть его течения. Ген SMN (теломерная копия, MIM: 600354) имеет 9 экзонов, из которых один (8-й экзон) не транслируется. Более 95 % больных с I–III вариантами СМА имеют делецию 7-го и/или 8-го экзона теломерной копии SMN-гена в гомозиготном состоянии. Остальные пациенты являются компаунд-гетерозиготами и имеют делецию в одном из этих генов, в то время как в другом гене, расположенном на гомологичной хромосоме, обнаруживаются сплайсинговые или миссенс-мутации. Мутация в теломерной копии SMN-гена может быть необходимым, но недостаточным условием возникновения заболевания, так как описаны здоровые люди, имеющие такую мутацию в гомозиготном состоянии.
Второй ген, расположенный в этой области, — NAIP (ген ингибитора нейронального апоптоза, MIM: 600355) также имеет копии. Данный ген содержит 16 экзонов. Делеции одного или нескольких экзонов этого гена в гомозиготном состоянии встречаются у 40–70 % больных с I типом СМА и у 14–22 % больных с II и III типом СМА. У подавляющего числа больных, имеющих делецию 7-го и 8-го экзонов SMN-гена в гомозиготном состоянии, обнаруживается также делеция и в гене NAIP.
Еще один ген, обозначаемый как H4F5 (MIM: 603011), расположенный в непосредственной близости от гена SMN, оказывается делетированным у 90 % больных со спинальной амиотрофией I типа. Предполагается, что этот ген участвует в модификации тяжести клинического течения различных типов проксимальных СМА.
Четвертый ген, вовлеченный в процесс возникновения заболевания, — ВTF2p44 также представлен несколькими копиями. Показано, что 15 % больных с различными типами СМА имеют делецию этого гена в гетерозиготном состоянии.
Таким образом, ведущим этиологическим фактором проксимальных СМА является наличие делеции в гомозиготном состоянии в теломерной копии SMN-гена. Факторами, модифицирующими тяжесть течения заболевания и приводящими к возникновению аллельных вариантов проксимальных СМА, являются: 1) количество центромерных копий SMN-гена (две при I типе СМА и от трех до пяти при II и III типах СМA); 2) наличие делеций в генах NAIP и H4F5. Не исключено существование других модифицирующих механизмов.
Кодируемый геном SMN белок содержит 294 аминокислотных остатка и экспрессируется во всех тканях организма. Наибольшее количество белка обнаружено в мотонейронах спинного мозга. В цитоплазме и ядре соматических клеток SMN ассоциирован с другим белком — SIP1. Вполне вероятно, что этот белок необходим для регенерации и повторных циклов образования мРНК, поскольку при наличии мутации в SMN-гене этот процесс у больных нарушен.
I тип проксимальных СМА с аутосомно-рецессивным типом наследования — болезнь Верднига — Гофманна возникает с рождения до 6-месячного возраста и характеризуется тяжелым злокачественным течением. Первые признаки заболевания можно отметить еще во внутриутробном периоде по слабому шевелению плода. При врожденном варианте болезни уже в неонатальном периоде отмечаются выраженная мышечная гипотония, гипотрофия с преимущественным поражением проксимальных отделов ног, угасание сухожильных рефлексов, фибриллярные подергивания мышц языка и пальцев кистей. Дети никогда не держат голову и не переворачиваются. Отмечается своеобразная поза ребенка (поза лягушки): конечности отведены в плечевых и тазобедренных суставах и согнуты в локтевых и коленных. Первыми поражаются мышцы проксимальных отделов нижних конечностей, процесс имеет восходящее распространение. Вовлечение дыхательной мускулатуры (межреберных мышц и диафрагмы) приводит к возникновению деформации грудной клетки по типу седловидной, воронкообразной или килевидной, а также сколиоза и кифоза в грудопоясничном отделе позвоночника. По мере прогрессирования заболевания поражение распространяется на мышцы гортани и глотки вследствие вовлечения в процесс ядер каудальной группы черепных нервов. При этом варианте СМА возможно появление первых признаков болезни в более старшем возрасте, но не позже 6 месяцев. В этих случаях дети могут держать голову и даже переворачиваются, однако никогда самостоятельно не садятся. Отмечена корреляция между временем появления первых признаков заболевания и продолжительностью жизни. Большинство больных с врожденным вариантом болезни погибают при явлениях сердечной или дыхательной недостаточности, а также от присоединившихся инфекций на первом году жизни. В целом при этой форме СМА продолжительность жизни ограничена 2 годами. Считается, что только 10–12 % больных переживают пятилетний возраст.
II тип заболевания характеризуется более поздним началом (от 6 до 12 месяцев) и менее злокачественным течением. Для больных характерен период нормального раннего развития: больные удерживают голову, самостоятельно садятся, однако самостоятельно не ходят. Для этой формы заболевания характерны фасцикулярные подергивания кистей, языка, плечевого и тазового пояса, тремор кончиков пальцев вытянутых рук, контрактуры в суставах и деформации позвоночника. Продолжительность жизни больных увеличена по сравнению с I типом болезни и в среднем составляет 10–12 лет.
III тип проксимальных СМA — болезнь Кугельберга — Веландера возникает в широком возрастном диапазоне от 12 месяцев до 20 лет. Наиболее часто первые признаки болезни появляются в возрасте 2–7 лет в проксимальных группах мышц тазового пояса. Больные начинают испытывать трудности при ходьбе, беге, подъеме по лестнице и подъеме из положения на корточках. В этот период клинические проявления заболевания имеют значительное сходство с таковыми при прогрессирующей мышечной дистрофии Беккера. Сходство дополняется возникновением у 18–25 % больных этим вариантом СМА псевдогипертрофий икроножных мышц, а также выраженного лордоза в поясничном отделе позвоночника. Поражения проксимальных отделов рук и плечевого пояса возникают спустя несколько лет после начала заболевания. Так же как и для II типа, характерны возникновение фасцикулярного тремора кистей, фасцикуляций различных мышечных групп и деформация грудной клетки.
ЭНМГ: выявляются специфические признаки поражения передних рогов спинного мозга в виде формирования «ритма частокола» — спонтанной ритмической активности.
При морфологическом исследовании биоптатов мышечных волокон выявляются атрофированные и гипертрофированные волокна I и II типа. Характерным признаком является скопление мелких круглых волокон, чередующихся с гипертрофированными волокнами (пучковая атрофия). При патоморфологическом исследовании выявляются набухание, сморщивание или атрофия мотонейронов передних рогов спинного мозга, а в ряде случаев — ядер черепных нервов.
Проводится дородовая диагностика с использованием методов ДНК-анализа, направленных на обнаружение делеций 7-го и 8-го экзонов SMN-гена в гомозиготном состоянии. Возможно обнаружение гетерозиготного носительства делеции в гене SMN.
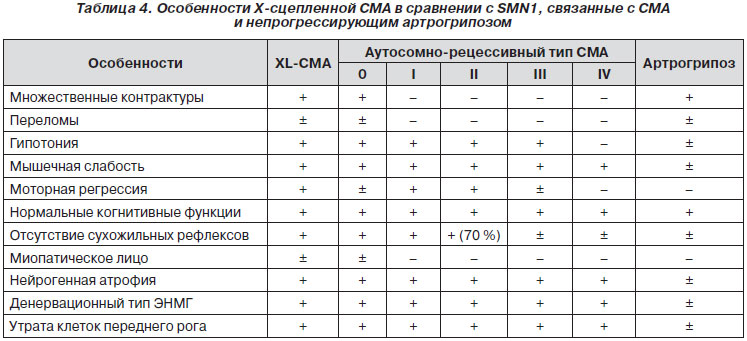
Спинальная амиотрофия Х-сцепленная летальная
Впервые описана Baumbach и соавт. в 1994 году. Учитывая, что это вторая форма спинальных амиотрофий с Х-сцепленным рецессивным типом наследования, описанная после спинобульбарной амиотрофии Кеннеди, эту форму иногда обозначают как СМА-Х2. Тип наследования — Хр-сцепленный рецессивный.
Клинические проявления возникают с рождения и характеризуются симптомами вялого паралича с преимущественным поражением мышц плечевого и тазового пояса и проксимальных отделов конечностей в сочетании с врожденными или появляющимися в период новорожденности контрактурами крупных суставов. В целом клинические проявления заболевания, а также морфологические и ЭНМГ-признаки полностью соответствуют таковым при проксимальной спинальной амиотрофии Верднига — Гоффмана.
Врожденная цервикальная спинальная мышечная атрофия
Редкая форма врожденной патологии впервые описана в 1981 году. Заболевание обнаруживается сразу после рождения и проявляется в виде атрофии мышц рук, мышечной гипотонии, ограничения двигательной активности и отсутствия сухожильных рефлексов. Мышцы нижних конечностей не страдают.
Инфантильная нейрональная дегенерация
Это заболевание принято описывать как инфантильную спинальную мышечную атрофию, сочетающуюся с дегенеративными изменениями в мозжечке и таламусе. В клинической картине на первый план выступают гипотония и арефлексия, диспноэ, слабый крик, затрудненные сосание и глотание. Если симптомы болезни обнаруживаются с рождения, смерть наступает в пределах 5 мес.
Инфантильная СМА с артрогрипозом (врожденный нейрогенный артрогрипоз)
Термин «нейрогенный артрогрипоз» подразу-мевает сочетание артрогрипоза с инфантильной спинальной мышечной атрофией, обусловленной первичной дегенерацией клеток передних рогов спинного мозга, передних корешков и/или периферических нервов. Большинство описанных случаев спорадические. В клинической картине у новорожденных общая гипотония, отсутствие движений, респираторные расстройства, трудности сосания и глотания (аспирация), фациальная диплегия, наружная офтальмоплегия, деформация суставов рук и ног, ограничивающая движения. Выражен респираторный дистресс с парезом диафрагмы. Сухожильные рефлексы снижены или отсутствуют. Переломы с рождения, фациальные дисморфии. Продолжительность жизни менее 2 лет. Рентгенологически — релаксация купола диафрагмы.
Спинальная амиотрофия Рюкю
Впервые описали Кondo и соавт. в 1970 году у 32 больных из высокоинбредной популяции на островах Рюкю в Японском море.
Тип наследования аутосомно-рецессивный. Заболевание не сцеплено ни с одним из известных генов, приводящих к возникновению спинальных амиотрофий. Первые признаки заболевания появляются вскоре после рождения и характеризуются симметричной слабостью мышц проксимальных отделов ног и фасцикуляциями. Отсутствие рефлексов. Ноги поражаются больше рук. По мере прогрессирования заболевания отмечается распространение патологического процесса на мышцы дистальных отделов ног с формированием полой стопы. Дети сидят, стоят и иногда ходят.
Мышцы проксимальных отделов рук поражаются спустя несколько месяцев. У 8 больных выявлены фибрилляции мышц. В большинстве случаев у больных обнаруживаются микроцефалия, кифосколиоз и частичная кожная синдактилия на кистях и стопах. Частые респираторные заболевания. Микрокрания, когнитивных нарушений нет.
На ЭНМГ выявляются типичные признаки поражения мотонейронов спинного мозга.
СМА с понтоцеребеллярной гипоплазией, А-Р, болезнь Нормана
Клинические признаки: дебют пренатально или с рождения, слабое шевеление плода, гипотония, мышечная слабость, снижение спонтанной двигательной активности, арефлексия, психомоторная ретардация, атаксия, нистагм. Могут быть контрактуры, иногда — признаки артрогрипоза. Трудности вскармливания. Различают 2 типа болезни Нормана: тип 1 — глобальная церебеллярная гипоплазия, смерть к 1-му году; тип 2 — прогрессирующая микроцефалия, экстрапирамидная дискинезия, эпилепсия, ментальная ретардация. МРТ: мозжечковая и понтинная гипотрофия, кортикальная атрофия.
Проксимальная СМА I типа с врожденными переломами
Клинические признаки: гипотония. Респираторные трудности. Гипотрофия мышц. Костные аномалии: генерализованная остеопения, врожденные переломы. Множественные контрактуры. Врожденный порок сердца. Гипертрихоз. Смерть в младенчестве.
Общая характеристика дистальной СМА
Первые симптомы появляются в 6–24 мес. в виде билатерального пареза ног. Дистальная слабость перонеальных мышц и разгибателей пальцев ног, гипотония и атрофии, снижение и/или отсутствие сухожильных рефлексов. Деформации стоп. Трудности при ходьбе и частые падения. Заболевание медленно прогрессирует с распространением на проксимальные отделы конечностей ног и рук, мышцы туловища и диафрагмы. Однако всегда слабость превалирует в ногах и дистальных отделах конечностей. Дыхательные нарушения прогрессируют до острого респираторного дистресса. Парез мышц туловища ведет к гиперлордозу, сколиозу. Деформации грудной клетки нет. Больные имеют нормальный интеллект. Краниальные мышцы интактны, чувствительных нарушений, фасцикуляций, пирамидных знаков нет.
Спинальная амиотрофия врожденная непрогрессирующая с преимущественным поражением ног
Впервые описана Frijns et al. в 1994 году. Тип наследования — аутосомно-доминантный. Ген локализован в хромосоме 12 q23-q24.
Первые проявления заболевания обычно выявляют к 15–18 месяцам жизни по задержке темпов приобретения навыков самостоятельной ходьбы. Обычно дети начинают самостоятельно ходить после полутора лет и имеют варусную деформацию стоп. Походка больных напоминает степпаж. По мере прогрессирования заболевания формируется эквиноварусная установка стоп и отмечается восходящий тип распространения мышечной слабости с постепенным вовлечением отводящих мышц бедер и формированием контрактур в коленных суставах. Сухожильные рефлексы не изменены. Чувствительных нарушений не выявляется. Ни у одного больного не отмечено слабости мышц рук и туловища. У ряда больных спустя 15–20 лет от начала заболевания может появляться умеренно выраженная слабость лицевой мускулатуры и сгибателей шеи.
Характерным ЭНМГ-признаком заболевания являются гигантские моторные потенциалы действия при нормальных значениях скоростей проведения импульса по моторным и сенсорным волокнам периферических нервов.
У ряда больных обнаруживаются пограничные с нормой значения активности креатинфосфокиназы. При морфологическом исследовании биоптатов мышц выявляется характерная для спинальных амиотрофий пучковая атрофия волокон, преимущественно I типа.
Спинальная амиотрофия с глазодвигательными нарушениями и эпилепсией
Заболевание описано Oка с соавт. в 1995 году. Тип наследования — аутосомно-рецессивный.
Первые проявления отмечаются в период новорожденности и характеризуются прогрессирующей генерализованной спинальной амиотрофией с характерными фасцикуляциями скелетных мышц и языка, сухожильной гипорефлексией и гипотонией. У детей часто возникают колебания температуры тела. К 6 годам к указанным симптомам присоединяются глазодвигательные нарушения в виде наружной офтальмоплегии и тонико-клонические судороги. При проведении магнитно-резонансного исследования мозга обнаруживаются гипоплазия мозжечка и генерализованная атрофия коры головного мозга. Интеллект больных снижен.
На ЭНМГ выявляются типичные изменения мотонейронов передних рогов спинного мозга.
Морфология: избыточная неравномерность диаметра мышечных волокон.
Врожденная скапулоперонеальная спинальная амиотрофия
Впервые описал De Long & Siddique в 1992 году. Тип наследования — аутосомно-доминантный. Ген заболевания, обозначаемый как SPSMA (скапулоперонеальная спинальная мышечная атрофия), картирован на хромосоме 12q24.1-24.31.
Заболевание возникает с рождения и характеризуется врожденной гипоплазией мышц, симптомами спинальной амиотрофии, наиболее выраженными в области надостных и подостных мышц и мышц перонеальной группы. У большинства больных возникает стридорозное дыхание, обусловленное параличом голосовых связок. По мере прогрессирования заболевания признаки мышечной слабости и атрофии распространяются на мышцы дистальных отделов рук и ног. Во 2-й или 3-й декаде жизни возникают контрактуры в крупных суставах, чаще всего нижних конечностей. Течение заболевания умеренно прогрессирующее. У мужчин заболевание течет тяжелее, чем у женщин. В сегрегирующих семьях наблюдается антиципация.
На ЭНМГ выявляются типичные изменения мотонейронов передних рогов спинного мозга.
Морфология: избыточная неравномерность диаметра мышечных волокон.
Дородовая диагностика возможна в сегрегирующих семьях на основании изучения сцепления с ДНК-маркерами области хромосомы 12q24.
Инфантильная спинальная амиотрофия с параличом диафрагмы — SMARD
Впервые описали Mellins и соавт. в 1976 году. Тип наследования — аутосомно-рецессивный. Ген заболевания является геном иммуноглобулин-связывающего белка (IGHMBP2, MIM: 600502) и картирован на хромосоме 11q13-q13.4. Основное количество мутаций найдено в экзоне 5 (миссенс, нонсенс, сдвиг рамки считывания).
Заболевание составляет 1 % от всех случаев инфантильных спинальных амиотрофий. Первые проявления заболевания возникают с рождения или в периоде новорожденности и характеризуются симптомами вялого паралича или пареза, наиболее выраженными в мышцах дистальных отделов верхних конечностей. В ряде случаев первые признаки заболевания отмечаются еще во внутриутробном периоде и характеризуются снижением двигательной активности плода. Отличительными особенностями этой формы болезни являются паралич и эвентрация диафрагмы, приводящие к возникновению выраженных дыхательных расстройств, а также фасцикуляции языка.
Дыхательные нарушения могут быть столь значительными, что требуют искусственной вентиляции легких и являются основной причиной гибели больных в возрасте до 3 месяцев. У большинства больных уже в период новорожденности формируются контрактуры в коленных и голеностопных суставах.
На ЭНМГ выявляются признаки поражения клеток переднего рога спинного мозга.
Истощение и гибель мотонейронов спинного мозга. В биоптате мышечных волокон выявляется феномен пучковой атрофии мышечных волокон без признаков реиннервации. Возможна дородовая диагностика.
Бульбоспинальная амиотрофия с глухотой (болезнь Брауна — Виалетто — ван Лэре)
У детей представлен аутосомно-рецессивный вариант SLC52A2; 8q24 с нарушением транспорта рибофлавина. Первые симптомы появляются в 2–5 лет. Выявляют билатеральную сенсоневральную глухоту, атрофию зрительного нерва, клинику поражения 7-й, 9–12-й пар черепных нервов (бульбарный синдром), фасцикуляции языка, гиповентиляцию. С течением времени паралич распространяется на плечевой пояс, руки, грудную клетку. Возникает диафрагмальная слабость, отсутствуют рефлексы. Формируется сколиоз. ЭНМГ: денервация с элементами аксональной полиневропатии. Снижен уровень карнитина. В терапию необходимо включать рибофлавин 100–500 мг/день.
Бульбарный парез Фацио — Лонде
Эта форма представлена аутосомно-доминантным и аутосомно-рецессивным вариантами SLC52A3; 20p13. Заболевание возникает в возрасте от 1 года до 12 лет и характеризуется симптомами бульбарного паралича или пареза, слабостью лицевой мускулатуры, птозом и нарушением подвижности диафрагмы. При аутосомно-рецессивном варианте заболевания отмечаются прогрессирующий стридор, выраженные дыхательные расстройства, значительное слюнотечение, генерализованная гиперрефлексия, паралич диафрагмы. Этот вариант характеризуется более ранним началом и злокачественным течением, приводящим к смерти больного в течение двух лет от начала заболевания. При аутосомно-доминантном типе наследования заболевание возникает позднее и характеризуется нерезко выраженными дизартрией и дисфагией, умеренным птозом, слабостью мышц лица, отсутствием дыхательных нарушений и медленным прогрессированием.
На ЭМГ выявляются признаки денервации и увеличение амплитуды М-ответа. При проведении патоморфологического исследования выявляются дегенерация и истощение нейронов черепно-мозговых нервов, спинного мозга и мозжечка.
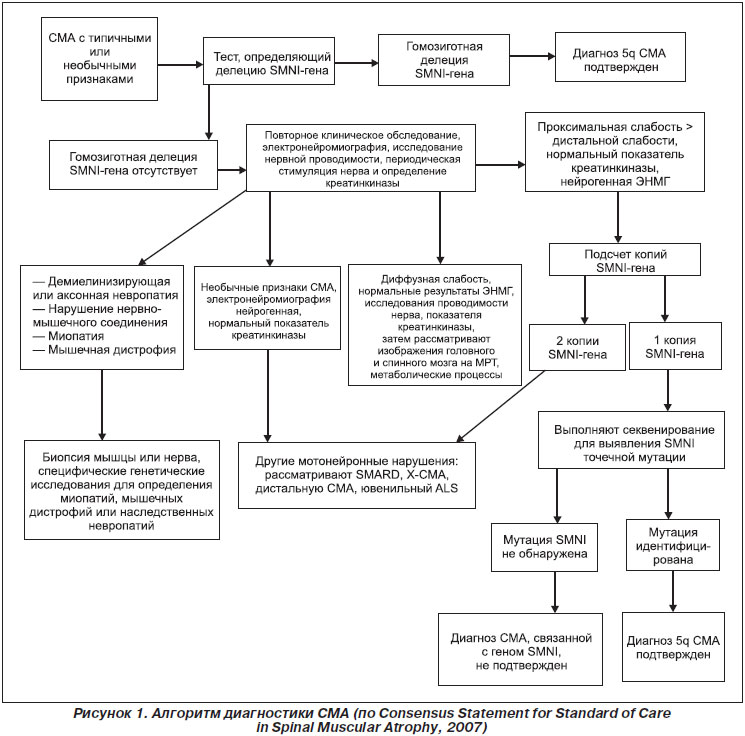
Алгоритм диагностики СМА представлен на рис. 1.
Дифференциальная диагностика инфантильных и детских форм СМА
— Дефицит кислой мальтазы (гликогеноз II типа).
— Адренолейкодистрофия.
— Ботулизм.
— Наследственные мотосенсорные невропатии.
— Синдром Дауна.
— GM1-англиозидоз.
— Синдром Хурлера.
— Болезнь Гоше.
— Синдромы Марфана и Прадера — Вилли.
— Метаболические болезни (органические ацидурии и митохондриальные болезни).
— Неонатальная и врожденная миастения.
— Периферические невропатии.
— Гликогеноз (болезнь Помпе).
— Полиомиелит.
— Поражение спинного мозга.
Лечение СМА предполагает использование средств, направленных на сохранение мотонейрона (рилузол, вальпроевая кислота), улучшение энергетической обеспеченности (L-карнитин, коэнзим Q10), применение клеточной терапии.
2. Болезнь двигательного нейрона у детей — боковой амиотрофический склероз
В последнее время отмечены тенденции к росту заболеваемости БДН во всех возрастных группах. Распространенность БДН в мире в среднем составляет 2–5/100 тыс. человек в год. Согласно классификации F. Norris, в 80 % случаев БДН представлена боковым амиотрофическим склерозом (БАС), в 10 % — прогрессирующим бульбарным параличом, а также двумя редкими формами: в 8 % — прогрессирующей мышечной атрофией (изолированное медленно прогрессирующее поражение периферических мотонейронов (ПМН)) и в 2 % — первичным боковым склерозом (изолированное медленно прогрессирующее поражение центрального двигательного нейрона). К клиническим проявлениям БДН относят признаки поражения ПМН, такие как парезы и атрофии скелетных мышц с фасцикуляциями в них, а также признаки поражения центральных мотонейронов (ЦМН), такие как спастичность, гиперрефлексия, патологические пирамидные знаки при длительной сохранности брюшных рефлексов (за исключением определенных фенотипов болезни). БДН в дебюте заболевания или по мере ее прогрессирования сопутствуют бульбарный и псевдобульбарный синдромы, признаками которых являются вялая или спастическая дизартрия, дисфагия, атрофия языка и фасцикуляции в нем, возможны повышение нижнечелюстного и глоточного рефлексов, ларингоспазм и насильственный смех и плач. Распределение и выраженность симптоматики поражения ПМН и ЦМН в значительной степени зависят от формы, дебюта и варианта болезни. На завершающей стадии болезни у пациентов развиваются стволовые или спинальные дыхательные нарушения, которые наряду с дисфагией и алиментарной недостаточностью являются причиной летального исхода.
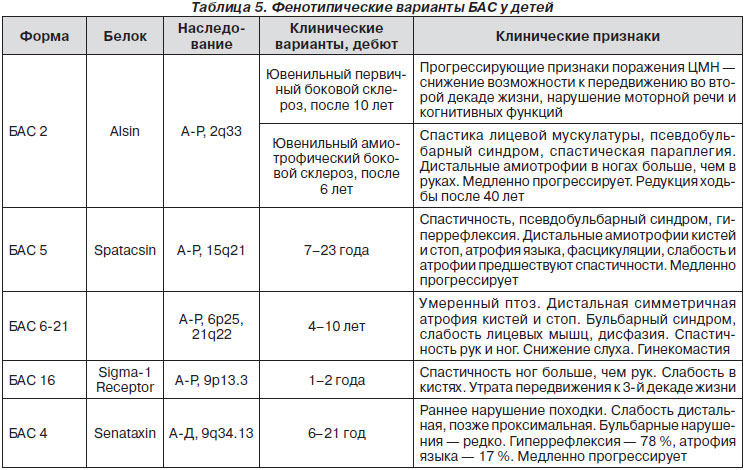
У детей БДН ассоциируется с генетическими мутациями, представленными в табл. 5.
Диагноз БДН необходимо подтвердить инструментально с помощью ЭНМГ и МР-визуализации. Задачей этих методов является исключение других заболеваний центральной и периферической нервной системы, которые потенциально излечимы и имеют доброкачественный прогноз.
ЭНМГ: при игольчатой миографии на трех уровнях (голова или шея, рука, нога) в наиболее пораженных мышцах выявляется спонтанная активность в виде потенциалов фасцикуляций, фибрилляций и положительных острых волн, а также тенденция к увеличению длительности, амплитуды и количества фаз потенциалов двигательных единиц (признаки нейрональной денервации). В начальных стадиях болезни спонтанная активность с преобладанием фасцикуляций сочетается со снижением длительности потенциалов двигательных единиц. На начальных стадиях при глобальной миографии в покое, тонических пробах и расслаблении в мышцах больных регистрируются потенциалы фасцикуляций с частотой 1–2 Гц при нормальном интерференционном паттерне кривой максимального усилия.
В развернутой стадии болезни в покое, при тонических пробах и расслаблении отмечаются ритмичные высокоамплитудные потенциалы фасцикуляций, а при максимальном усилии — «ритм частокола». Выбирая мышцы для исследования методом игольчатой ЭНМГ, следует помнить, что прежде всего при БДН страдают мышцы разгибательной группы (группа локтевого и лучевого нервов на руке и малоберцового нерва на ноге). При стимуляционной ЭНМГ на трех уровнях отмечаются снижение амплитуд М-ответов, уменьшение скоростей проведения по двигательным волокнам периферических нервов, но не более чем на 30 %, сохранность потенциалов действия нервов и скоростей проведения по чувствительным волокнам (критерии ЭНМГ-диагностики БДН Ламберта) и увеличение соотношения амплитуд Н-рефлекса и М-ответа в икроножных мышцах, что отражает наличие пирамидного синдрома.
Больным необходимо проводить МРТ хотя бы двух отделов центральной нервной системы (на уровне, пораженном в дебюте заболевания, и уровне, наиболее близком к дебюту заболевания).
Дифференциальная диагностика БАС
— СМА.
— Болезнь Тея — Сакса.
— Миастения.
— Плексопатия.
— ОМАН.
— Полиомиелитические синдромы.
— Синдром Хопкинса.
— Паранеопластические синдромы.
— Токсическое влияние (свинец).
Терапия БАС является посиндромной: защита мотонейрона (рилутек), уменьшение спастичности (баклофен, мемантин), слюнотечение (имипрамин), улучшение метаболизма (L-карнитин, коэнзим Q-10).
Курирующий врач также должен составить вместе с семьей план многопрофильного наблюдения ребенка. Этот план обычно включает консультирование и получение помощи у пульмонолога, гастроэнтеролога/диетолога, ортопеда/реабилитолога, а также детского невролога (если ребенок наблюдается педиатром или семейным врачом, а не неврологом), медицинского генетика (при необходимости решения вопросов планирования семьи).
Пациенты с БМН с течением времени постепенно теряют мышечную силу и подвижность. Комплексная реабилитация поможет задержать или предотвратить вторичные нарушения, включая мышечные контрактуры, замедлит прогрессирование заболевания, а также сохранит или потенциально улучшит мышечную силу и двигательные функции. В реабилитационные мероприятия при СМА и БДН включают физиотерапию, трудотерапию, логопедию, использование ортопедического и другого адаптивного оборудования, общеукрепляющие упражнения и упражнения на равновесие, растяжение или увеличивающие диапазон движений, а также водную терапию, физическую и социальную активность. Реабилитационные мероприятия должны обеспечить дополнительную помощь, направленную на улучшение дыхательной функции и питания.