Журнал «Травма» Том 26, №4, 2025
Вернуться к номеру
Потенціювальний вплив транскутанного введення вуглекислого газу на протизапальний ефект диклофенаку натрію та хондроїтину сульфату в експериментальній моделі остеоартриту
Авторы: Штробля В.В.
ДВНЗ «Ужгородський національний університет», м. Ужгород, Україна
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
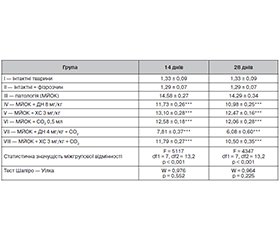
Актуальність. Остеоартрит є хронічним дегенеративно-запальним захворюванням суглобів, яке згідно з сучасними уявленнями може супроводжуватися активацією низькорівневого запалення за участю прозапальних цитокінів, зокрема інтерлейкіну-6 (IL-6). У цьому контексті зростає інтерес до ад’ювантних терапевтичних стратегій, зокрема до застосування транскутанного вуглекислого газу (карбокситерапії) як потенційного модулятора запальної відповіді, з одночасним зниженням фармакологічного навантаження. Мета: оцінити вплив транскутанного вуглекислого газу в комбінації з диклофенаком натрію або хондроїтину сульфатом на рівень IL-6 у моделі остеоартриту, індукованого монойодоцтовою кислотою. Матеріали та методи. В експерименті використано 80 статевозрілих білих безпородних щурів-самців, у яких моделювали остеоартрит внутрішньосуглобовим введенням монойодоцтової кислоти. Тварини отримували диклофенак (8 або 4 мг/кг), хондроїтину сульфат (3 мг/кг), СО2 (0,5 мл підшкірно) або їх комбінації. Концентрацію IL-6 у сироватці визначали на 14-й і 28-й день за допомогою ELISA. Статистичний аналіз проведено з використанням однофакторного дисперсійного аналізу з post-hoc тестом Тьюкі. Результати. Комбінація СО2 із половинною дозою диклофенаку знизила рівень IL-6 на 6,77 пг/мл (46,4 %; p < 0,001) на 14-й день і на 8,22 пг/мл (57,5 %; p < 0,001) на 28-й день, що вірогідно перевищувало ефект повної дози диклофенаку (p < 0,001). Подібна тенденція, хоча й менш виражена, спостерігалася для комбінації хондроїтину з СО2. Монотерапія СО2 була порівнянною за ефектом із хондроїтину сульфатом (p = 0,479). Висновки. Транскутанний вуглекислий газ потенційно посилює протизапальний ефект диклофенаку та хондроїтину сульфату, сприяючи зниженню рівня IL-6 у динаміці. Такий підхід може бути корисним для зменшення дози НПЗП у лікуванні остеоартриту.
Background. Osteoarthritis is a chronic degenerative-inflammatory joint disease that, according to current concepts, may be accompanied by the activation of low-grade inflammation involving pro-inflammatory cytokines, particularly interleukin-6 (IL-6). In this context, there is growing interest in adjuvant therapeutic strategies, especially the use of transcutaneous carbon dioxide (carboxytherapy) as a potential modulator of the inflammatory response while simultaneously reducing the pharmacological burden. The purpose was to evaluate the effect of transcutaneous carbon dioxide in combination with sodium diclofenac or chondroitin sulfate on IL-6 level in a monoiodoacetate-induced model of osteoarthritis. Materials and methods. The experiment involved 80 sexually mature outbred male white rats in which osteoarthritis was induced by intra-articular injection of monoiodoacetic acid. The animals received diclofenac (8 or 4 mg/kg), chondroitin sulfate (3 mg/kg), CO2 (0.5 ml subcutaneously), or their combinations. The serum concentration of IL-6 was measured on days 14 and 28 using enzyme-linked immunosorbent assay. Statistical analysis was performed with one-way analysis of variance followed by Tukey post hoc test. Results. The combination of CO2 with a half-dose of diclofenac reduced IL-6 levels by 6.77 pg/ml (46.4 %; p < 0.001) on day 14 and by 8.22 pg/ml (57.5 %; p < 0.001) on day 28, which significantly exceeded the effect of the full diclofenac dose (p < 0.001). A similar but less pronounced trend was observed for the combination of chondroitin with CO2. CO2 alone produced an effect comparable to that of chondroitin sulfate (p = 0.479). Conclusions. Transcutaneous carbon dioxide potentially enhances the anti-inflammatory effects of diclofenac and chondroitin sulfate by contributing to the reduction in IL-6 levels over time. This approach may be beneficial for decreasing the required dose of nonsteroidal anti-inflammatory drugs in the treatment of osteoarthritis.
остеоартрит; інтерлейкін-6; диклофенак натрію; хондроїтину сульфат; вуглекислий газ; транскутанна терапія; експериментальна модель; запалення
osteoarthritis; interleukin-6; sodium diclofenac; chondroitin sulfate; carbon dioxide; transcutaneous therapy; experimental model; inflammation