Журнал «Здоровье ребенка» Том 20, №5, 2025
Вернуться к номеру
Мультисистемний вплив пробіотичних препаратів: оцінка комплексного лікування гострого тонзиліту у дітей
Авторы: Крючко Т.О., Ткаченко О.Я., Соннік Н.Б., Пшенишна О.В., Щербак В.В., Климко Д.О.
Полтавський державний медичний університет, м. Полтава, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
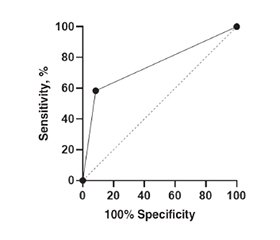
Актуальність. Тонзиліт становить приблизно 0,4 % амбулаторних звернень у країнах Європи та США. Зазвичай причиною захворювання є вірусна інфекція, а передача збудника відбувається повітряно-краплинним шляхом від пацієнтів із гострим тонзилітом. Бета-гемолітичний стрептокок групи А (group A beta-hemolytic streptococcus) є причиною тонзиліту у 15–30 % дітей віком від 5 до 15 років, що збільшує ризик виникнення системних ускладнень. Метою дослідження стало вивчення ефективності застосування комплексного пробіотика, що містить культури живих бактерій Streptococcus salivarius K12 і Lactobacillus rhamnosus LGG та вітамін D у вигляді холекальциферолу, у комплексному лікуванні гострого тонзиліту у дітей. Матеріали та методи. У дослідженні взяло участь 48 дітей віком від 5 до 14 років, які шляхом випадкової вибірки були розподілені на дві групи: до основної увійшло 28 дітей, які протягом 20 днів у комплексному лікуванні отримували пробіотичну добавку; до контрольної групи увійшло 20 дітей, яким призначали стандартну терапію без пробіотика. Усім дітям проводилась оцінка за шкалою McIsaac, що дозволило визначити обсяг обстеження та лікування. Результати. Бактеріальна природа захворювання була верифікована у 12 (42,86 %) та 7 (35 %) дітей основної і контрольної груп відповідно. Дітям призначено антибактеріальний препарат. За віком, статтю, тривалістю захворювання та клінічним перебігом тонзиліту на початку спостереження пацієнти не відрізнялися (р > 0,05). У хворих обох груп з однаковою частотою спостерігалися біль у горлі, набряк/нашарування на мигдаликах, лімфаденопатія, лихоманка. Характеризуючи динаміку локальних симптомів у ході лікування, слід зауважити, що більш ніж у третини дітей, які отримували пробіотичну добавку, біль в горлі зник вже на 3-й день, на відміну від пацієнтів контрольної групи, де майже кожен третій пацієнт (30 %) продовжував скаржитися на біль в горлі навіть на 7-й день захворювання. Середня тривалість болю в горлі у дітей основної групи становила 2,67 ± 0,62 дня, у хворих контрольної групи — 4,91 ± 1,16 дня (p < 0,05). Аналогічну динаміку ми отримали, оцінюючи наявність чи відсутність набряку та нашарувань на мигдаликах. Через 6 місяців були оцінені такі критерії, як рецидив тонзиліту та частота гострих респіраторних захворювань, проведений аналіз чинників, які корелюють з ними. Слід зауважити, що стан на 7-й день лікування виявився найбільш сильним предиктором розвитку рецидиву (R2 = 0,78). Тобто досягнення повної клінічної ремісії до 7-го дня перебігу гострого тонзиліту суттєво знижує формування схильності до хронізації та виникнення повторних епізодів. Другим важливим критерієм був прийом пробіотика, який також асоціюється зі зниженням ризику повторних рецидивів (p = 0,0128). Висновки. Призначення пробіотика у лікуванні гострого тонзиліту збільшує ймовірність клінічного одужання до 7-го дня захворювання та відповідно знижує частоту рецидивів у найближчому майбутньому. Дана модель має добру прогностичну цінність (AUC = 0,75, 95% ДІ 0,6495–0,8505; p < 0,0001) та свідчить, що застосування пробіотика Streptococcus salivarius K12 і Lactobacillus rhamnosus LGG та вітаміну D знижує ризик повторного епізоду тонзиліту у дітей.
Background. Tonsillitis accounts for approximately 0.4 % of outpatient visits in Europe and the United States. The disease is usually caused by a viral infection, and the pathogen is transmitted by airborne droplets from patients with acute tonsillitis. Group A beta-hemolytic streptococcus is the cause of tonsillitis in 15–30 % of children aged 5 to 15 years, which increases the risk of systemic complications. The purpose of the study was to investigate the effectiveness of a complex probiotic containing live cultures of Streptococcus salivarius K12 and Lactobacillus rhamnosus LGG bacteria and vitamin D (cholecalciferol) in the comprehensive treatment of acute tonsillitis in children. Materials and methods. The study involved 48 children aged 5 to 14 years who were randomly divided into two groups: the main group included 28 patients who received a probiotic supplement for 20 days in comprehensive treatment; the control group consisted of 20 children who were prescribed standard therapy without a probiotic. All children were assessed using the McIsaac scale, which allowed us to determine the scope of examination and treatment. Results. The bacterial cause of the disease was verified in 12 (42.86 %) and 7 (35 %) children of the main and control groups, respectively, and an antibacterial drug was prescribed. The patients did not differ in age, sex, disease duration, and clinical course of tonsillitis at baseline (p > 0.05). Sore throat, swelling/patches on the tonsils, lymphadenopathy, and fever were observed with equal frequency in patients of both groups. Describing the dynamics of local symptoms during treatment, it should be noted that in more than a third of children receiving a probiotic supplement, sore throat disappeared on the third day, unlike the control group, where almost every third patient (30 %) continued to complain of sore throat even on day 7 of the disease. The average duration of sore throat in the main group was 2.67 ± 0.62 days, in the control group — 4.91 ± 1.16 days (p < 0.05). We obtained similar dynamics by assessing the presence or absence of edema and patches on the tonsils. After 6 months, the following criteria were evaluated: recurrence of tonsillitis and the frequency of acute respiratory diseases, and the analysis of factors correlated with them was conducted. It should be noted that condition on day 7 of treatment was the strongest predictor of relapse (R2 = 0.78). That is, the achievement of complete clinical remission by day 7 of acute tonsillitis significantly reduces the formation of a tendency to chronicity and the occurrence of repeated episodes. The second important criterion was taking a probiotic, which is also associated with a reduced risk of recurrence (p = 0.0128). Conclusions. The use of probiotics in the treatment of acute tonsillitis increases the likelihood of clinical recovery by day 7 of the disease and, accordingly, reduces the frequency of recurrence in the near future. This model has a good predictive value (AUC = 0.75, 95% CI 0.6495–0.8505, p < 0.0001) and indicates that the use of Streptococcus salivarius K12 and Lactobacillus rhamnosus LGG probiotic and vitamin D reduces the risk of recurrent tonsillitis in children.
гострий тонзиліт; діти; пробіотик Streptococcus salivarius K12 і Lactobacillus rhamnosus LGG
acute tonsillitis; children; Streptococcus salivarius K12 and Lactobacillus rhamnosus LGG probiotic
Вступ
Матеріали та методи
/22.jpg)
Результати та обговорення
/26.jpg)
Висновки
- Windfuhr JP, Toepfner N, Steffen G, Waldfahrer F, Berner R. Clinical practice guideline: tonsillitis I. Diagnostics and nonsurgical management. Eur Arch Otorhinolaryngol. 2016 Apr;273(4):973-87. doi: 10.1007/s00405-015-3872-6. Epub 2016 Jan 11. PMID: 26755048; PMCID: PMC7087627.
- Anderson J, Paterek E. Tonsillitis. [Updated 2023 Aug 8]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. 2025 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK544342/.
- Patangia DV, Anthony Ryan C, Dempsey E, Paul Ross R, Stanton C. Impact of antibiotics on the human microbiome and consequences for host health. Microbiologyopen. 2022 Feb;11(1):e1260. doi: 10.1002/mbo3.1260. PMID: 35212478; PMCID: PMC8756738.
- Hsueh PR, Huang WK, Shyr JM, Lau YJ, Liu YC, Luh KT. Multicenter surveillance of antimicrobial resistance of Streptococcus pyogenes, Streptococcus pneumoniae, Haemophilus influenzae, and Moraxella catarrhalis to 14 oral antibiotics. J Formos Med Assoc. 2004 Sep;103(9):664-70. PMID: 15361938.
- Bertuccioli A, Cardinali M, Micucci M, Rocchi MBL, Palaz–zi CM, Zonzini GB, Annibalini G, Belli A, Sisti D. Efficacy of Streptococcus salivarius Blis K12 in the Prevention of Upper Respiratory Tract Infections in Physically Active Individuals: A Randomized Controlled Trial. Microorganisms. 2024;12:2164.
- Di Pierro F, Colombo M, Zanvit A, Risso P, Rottoli AS. Use of Streptococcus salivarius K12 in the prevention of streptococcal and viral pharyngotonsillitis in children. Drug Healthc Patient Saf. 2014 Feb 13;6:15-20. doi: 10.2147/DHPS.S59665. PMID: 24600248; PMCID: PMC3928062.
- Wilcox CR, et al. Effectiveness of the probiotic Streptococcus salivarius K12 for the treatment and/or prevention of sore throat: a systematic review. Clinical Microbiology and Infection. 2019;25(6):673-680.
- Chiappini E, Simeone G, Bergamini M, et al. Treatment of acute pharyngitis in children: an Italian intersociety consensus (SIPPS-SIP-SITIP-FIMP-SIAIP-SIMRI-FIMMG). Ital J Pediatr. 2024;50:235.
- Kanagasabai A, Evans C, Jones HE, Hay AD, Dawson S, Savović J, Elwenspoek MMC. Systematic review and meta-analysis of the accuracy of McIsaac and Centor score in patients presenting to secondary care with pharyngitis. Clin Microbiol Infect. 2024 Apr;30(4):445-452. doi: 10.1016/j.cmi.2023.12.025. Epub 2024 Jan 3. PMID: 38182052.
- Martens PJ, Gysemans C, Verstuyf A, Mathieu AC. Vitamin D’s Effect on Immune Function. Nutrients. 2020 Apr 28;12(5):1248. doi: 10.3390/nu12051248. PMID: 32353972; PMCID: PMC7281985.
- Abboud M, Rizk R, AlAnouti F, Papandreou D, Haidar S, Mahboub N. The Health Effects of Vitamin D and Probiotic Co-Supplementation: A Systematic Review of Randomized Controlled Trials. Nutrients. 2020 Dec 30;13(1):111. doi: 10.3390/nu13010111. PMID: 33396898; PMCID: PMC7824176.
- Kostenko V, Akimov O, Gutnik O, Kostenko H, Kostenko V, Romantseva T, et al. Modulation of redox-sensitive transcription factors with polyphenols as pathogenetically grounded approach in therapy of systemic inflammatory response. Heliyon. 2023;9(5):e15551. doi: 10.1016/j.heliyon.2023.e15551.
- McFarland LV, Ozen M, Dinleyici EC, Goh S. Comparison of pediatric and adult antibiotic-associated diarrhea and Clostridium difficile infections. World J Gastroenterol. 2016 Mar 21;22(11):3078-104. doi: 10.3748/wjg.v22.i11.3078. PMID: 27003987; PMCID: PMC4789985.
- Theriot CM, Young VB. Interactions Between the Gastrointestinal Microbiome and Clostridium difficile. Annu Rev Microbiol. 2015;69:445-61. doi: 10.1146/annurev-micro-091014-104115. PMID: 26488281; PMCID: PMC4892173.
- Konstantinidis T, Tsigalou C, Karvelas A, Stavropoulou E, Voidarou C, Bezirtzoglou E. Effects of Antibiotics upon the Gut Microbiome: A Review of the Literature. Biomedicines. 2020 Nov 16;8(11):502. doi: 10.3390/biomedicines8110502. PMID: 33207631; PMCID: PMC7696078.
- Patangia DV, Anthony Ryan C, Dempsey E, Paul Ross R, Stanton C. Impact of antibiotics on the human microbiome and consequences for host health. Microbiologyopen. 2022 Feb;11(1):e1260. doi: 10.1002/mbo3.1260. PMID: 35212478; PMCID: PMC8756738.
- Mathipa-Mdakane MG, Thantsha MS. Lacticaseibacillus rhamnosus: A Suitable Candidate for the Construction of Novel Bioengineered Probiotic Strains for Targeted Pathogen Control. Foods. 2022 Mar 8;11(6):785. doi: 10.3390/foods11060785. PMID: 35327208; PMCID: PMC8947445.
- Waitzberg D, Guarner F, Hojsak I, Ianiro G, Polk DB, Sokol H. Can the Evidence-Based Use of Probiotics (Notably Saccharomyces boulardii CNCM I-745 and Lactobacillus rhamnosus GG) Mitigate the Clinical Effects of Antibiotic-Associated Dysbiosis? Adv Ther. 2024 Mar;41(3):901-914. doi: 10.1007/s12325-024-02783-3. Epub 2024 Jan 30. PMID: 38286962; PMCID: PMC10879266.
- Hempel S, Newberry SJ, Maher AR, Wang Z, Miles JN, Shanman R, Johnsen B, Shekelle PG. Probiotics for the prevention and treatment of antibiotic-associated diarrhea: a systematic review and meta-analysis. JAMA. 2012 May 9;307(18):1959-69. doi: 10.1001/jama.2012.3507. PMID: 22570464.
- Savchenko L, Mykytiuk M, Cinato M, Tronchere H, Kunduzova O, Kaidashev I. IL-26 in the induced sputum is associated with the level of systemic inflammation, lung functions and body weight in COPD patients. Int J Chron Obstruct Pulmon Dis. 2018;13:2569-2575. doi: 10.2147/COPD.S164833.

/23.jpg)
/24.jpg)
/25.jpg)