Журнал "Гастроэнтерология" Том 59, №2, 2025
Вернуться к номеру
Нові підходи до діагностики та ведення хворих на метаболічно асоційовану стеатотичну хворобу печінки з імунною відповіддю до SARS-CоV-2
Авторы: Діденко В.І., Меланіч С.Л., Кленіна І.А., Татарчук О.М., Петішко О.П., Бочаров Г.І.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
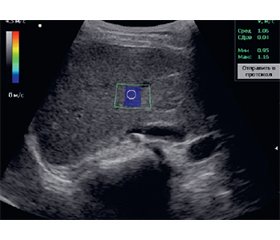
Актуальність. Згубна взаємодія складних запальних шляхів, які хронічно присутні при метаболічно асоційованій стеатотичній хворобі печінки (МАСХП), може різко посилюватися в умовах COVID-19, сприяючи розвитку фіброзу печінки. На сьогодні немає єдиної точки зору щодо застосування замість біопсії печінки сироваткових показників як критеріїв прогнозування несприятливого перебігу МАСХП у хворих з імунною відповіддю до SARS-CoV-2. Мета: оптимізація діагностики та ведення пацієнтів з МАСХП та імунною відповіддю до SARS-CoV-2 на підставі визначення предикторів несприятливого перебігу. Матеріали та методи. Під спостереженням перебували 105 пацієнтів з МАСХП, які мали підвищений рівень антитіл класу IgG, специфічних до SARS-CoV-2, більше 40 BAU/мл відносно контрольного значення, що дало змогу дійти висновку про імунну відповідь у цих хворих. Оцінку жорсткості паренхіми печінки проводили методом зсувнохвильової еластографії (SWE) з використанням УЗ-сканера експертного класу Soneus P7 (Ultrasign, Україна, Швейцарія). Усім хворим у сироватці крові визначали показники імунологічного профілю, функціонального стану печінки та протромботичного середовища. Статистичне опрацювання результатів здійснювали за допомогою пакета прикладних програм Statistica 10. Результати. За результатами SWE у 49 (46,7 %) пацієнтів фіброз печінки був відсутній, у 40 (38,1 %) хворих діагностовано легкий фіброз (5,79–7,5 кПа) з середнім показником (6,08 ± 0,13) кПа, у 16 (15,2 %) — помірний фіброз (7,5–10,0 кПа) з середнім значенням (7,65 ± 0,38) кПа. У хворих з несприятливим перебігом МАСХП рівень АСТ становив (50,1 ± 14,9) Од/л і був у 2 рази вищим, ніж у контрольній групі — (23,4 ± 10,3) Од/л (р < 0,001) та у хворих без фіброзу печінки — (27,0 ± 9,1) Од/л (р < 0,001). На 11 % (р < 0,001) порівняно з контрольною групою та групою пацієнтів без фіброзу печінки збільшувалося значення MPV при розвитку несприятливого перебігу МАСХП у пацієнтів з імунною відповіддю до SARS-CоV-2. Аналогічні зміни визначені і при оцінці рівня абсолютної кількості СD16+, а саме у хворих з несприятливим перебігом МАСХП цей показник становив (0,42 ± 0,15) × 109 кл/л, що на 45 % вище, ніж в контрольній групі — (0,29 ± 0,21) × 109 кл/л (р < 0,001) та на 40 % більше, ніж у групі пацієнтів без фіброзу печінки — (0,30 ± 0,09) × 109 кл/л (р < 0,001). У хворих на МАСХП з імунною відповіддю до SARS-CoV-2 були виявлені найбільш показові кореляції показника жорсткості паренхіми печінки за даними SWE зі значенням абсолютної кількості СD16+ (r = 0,568; p < 0,0001), рівнем АСТ (r = 0,503; p = 0,0001), середнім об’ємом тромбоцитів (r = 0,513; p = 0,0001). За результатами логістичного регресійного аналізу були визначені порогові значення предикторів розвитку несприятливого перебігу МАСХП у хворих з імунною відповіддю до SARS-CоV-2: абсолютна кількість СD16+ понад 0,35 (чутливість — 82,1 %, специфічність — 92,9 %), рівень АСТ більший за 49 Од/л (чутливість — 71,4 %, специфічність — 96,4 %) та MPV понад 8,5 фемтолітра (чутливість — 89,3 %, специфічність — 67,9 %). Висновки. Тактика ведення хворих на МАСХП з імунною відповіддю до SARS-CоV-2 має включати оцінку ризику розвитку несприятливого перебігу МАСХП, що дозволить вчасно застосовувати профілактично-лікувальні заходи для запобігання розвитку вираженого фіброзу печінки та покращення якості життя пацієнтів.
Background. The detrimental interaction of complex inflammatory pathways, which are chronically present in metabolic-associated steatotic liver disease (MASLD), can be dramatically exacerbated in the setting of COVID-19, contributing to the development of liver fibrosis. To date, there is no consensus on the use of serum parameters instead of liver biopsy as criteria for predicting the unfavorable course of MASLD in patients with an immune response to severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2). The purpose of the study was to optimize the diagnosis and management of patients with MASLD and an immune response to SARS-CoV-2 by identifying predictors of adverse outcome. Materials and methods. The study included 105 patients with MASLD who had an elevated level of IgG antibodies specific to SARS-CoV-2 of more than 40 BAU/ml compared to the control value, which allowed us to conclude that these patients had an immune response. The stiffness of the liver parenchyma was assessed by shear wave elastography (SWE) using an expert-class ultrasound scanner Soneus P7 (Ultrasign, Ukraine, Switzerland). All patients’ serum parameters of immunological profile, liver function, and prothrombotic environment were determined. The results were statistically analyzed using the Statistica 10 software package. Results. According to the results of SWE, 49 (46.7 %) patients had no liver fibrosis, 40 (38.1 %) were diagnosed with mild fibrosis (5.79–7.5 kPa) with an average value of (6.08 ± 0.13) kPa, and 16 (15.2 %) had moderate fibrosis (7.5–10.0 kPa) with an average value of (7.65 ± 0.38) kPa. In patients with unfavorable course of MASLD, the level of aspartate aminotransferase was (50.1 ± 14.9) U/L and was 2 times higher than in the control group — (23.4 ± 10.3) U/L (p < 0.001) and in patients without liver fibrosis — (27.0 ± 9.1) U/L (p < 0.001). In the development of unfavorable course of MASLD in patients with an immune response to SARS-CoV-2, the mean platelet volume increased by 11 % (p < 0.001) compared to the controls and group without liver fibrosis. Similar changes were found when assessing the absolute number of CD16+, namely, in patients with unfavorable course of MASLD, this indicator was (0.42 ± 0.15) · 109 c/L, which is 45 % higher than in the control group — (0.29 ± 0.21) · 109 c/L (p < 0.001) and 40 % higher than in patients without liver fibrosis — (0.30 ± 0.09) · 109 c/L (p < 0.001). In patients with MASLD and an immune response to SARS-CoV-2, the most significant correlations of liver parenchymal stiffness (based on SWE data) were observed with the absolute number of CD16+ cells (r = 0.568; p < 0.0001), aspartate aminotransferase levels (r = 0.503; p = 0.0001), and mean platelet volume (r = 0.513; p = 0.0001). According to the results of logistic regression analysis, the threshold values of predictors for adverse course of MASLD in patients with an immune response to SARS-CoV-2 were determined: absolute number of CD16+ more than 0.35 (sensitivity 82.1 %, specificity 92.9 %), aspartate aminotransferase level above 49 U/L (sensitivity 71.4 %, specificity 96.4 %) and MPV more than 8.5 fL (sensitivity 89.3 %, specificity 67.9 %). Conclusions. The management of patients with MASLD and an immune response to SARS-CoV-2 should include an assessment of the risk of adverse course of MASLD, which will allow for timely application of preventive and therapeutic measures to prevent the development of severe liver fibrosis and improve the quality of life of patients.
метаболічно асоційована стеатотична хвороба печінки; імунна відповідь до SARS-CоV-2; несприятливий перебіг; предиктори
metabolic-associated steatotic liver disease; immune response to SARS-CoV-2; unfavorable course; predictors
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Xie M, Chen Q. Insight into 2019 novel coronavirus — An updated interim review and lessons from SARS-CoV and MERS-CoV. IntJ. Infect. Dis. 2020. Vol. 94. Р. 119-124. doi: 10.1016/j.ijid.2020.03.071.
- Nardo AD, et al. Pathophysiological mechanisms of liver injury in COVID-19. Liver International. 2021. Vol. 41. Р. 20-32. doi: 10.1111/liv.14730.
- Younossi ZM, et al. The global epidemiology of nonalcoholic fatty liver disease (NAFLD) and nonalcoholic steatohepatitis (NASH): a systematic review. Hepatology. 2023. Vol. 77(4). P. 1335-1347. doi: 10.1097/HEP.0000000000000004.
- Cusi K, et al. American Association of Clinical Endocrinology Clinical Practice Guideline for the Diagnosis and Management of Nonalcoholic Fatty Liver Disease in Primary Care and Endocrinology Clinical Settings Co-Sponsored by the American Association for the Study of Liver Diseases (AASLD). Endocrine Practice. 2022. Vol. 28. P. 528-562. doi: 10.1016/j.eprac.2022.03.010.
- Nowroozi A, Momtazmanesh S, Rezaei N. COVID-19 and MAFLD/NAFLD: An updated review. Front. Med. 2023. Vol. 10. P. 1126491. doi: 10.3389/fmed.2023.1126491.
- Marjot T, et al. COVID-19 and liver disease: mechanistic and clinical perspectives. Nat Rev Gastroenterol Hepatol. 2021. Vol. 18. Р. 348-364. doi: 10.1038/s41575-021-00426-4.
- Wattacheril JJ, Abdelmalek MF, Lim JK, Sanyal AJ. AGA Clinical Practice Update on the Role of Noninvasive Biomarkers in the Evaluation and Management of Nonalcoholic Fatty Liver Disease: Expert Review. Gastroenterology. 2023. Vol. 165. P. 1080-1088. doi: 10.1053/j.gastro.2023.06.013.
- Guerra-Ruiz AR, et al. Biochemical assessment of metabolic associated fatty liver disease. Adv Lab Med. 2021, Mar 15. Vol. 2(2). P. 199-219. doi: 10.1515/almed-2021-0009.
- Sviklāne L, et al. Fatty liver index and hepatic steatosis index predict non-alcoholic fatty liver disease in type 1 diabetes. J. Gastroenterol Hepatol. 2018. Vol. 33, No 1. P. 270-276. doi: 10.1111/jgh.13814.
- Castera L, Friedrich-Rust M, Loomba R. Noninvasive Assessment of Liver Disease in Patients with Nonalcoholic Fatty Liver Disease. Gastroenterology. 2019. Vol. 156, No 5. P. 1264-1281.e4. doi: 10.1053/j.gastro.2018.12.036.
- Huang C, et al. Modified AST to platelet ratio index improves APRI and better predicts advanced fibrosis and liver cirrhosis in patients with non-alcoholic fatty liver disease. Clin Res Hepatol Gastroenterol. 2021. Vol. 45, No 4. P. 101528. doi: 10.1016/j.clinre.2020.08.006.
- Lee J, et al. Prognostic accuracy of FIB-4, NAFLD fibrosis score and APRI for NAFLD-related events: A systematic review. Liver Int. 2021. Vol. 41, No 2. P. 261-270. doi: 10.1111/liv.14669.
- Schmitz SM, et al. Evaluation of NAFLD and fibrosis in obese patients — a comparison of histological and clinical scoring systems. BMC gastroenterology. 2020. Vol. 20, No 1. P. 254. doi: 10.1186/s12876-020-01400-1.
- Ballestri S, et al. Liver Fibrosis Biomarkers Accurately Exclude Advanced Fibrosis and Are Associated with Higher Cardiovascular Risk Scores in Patients with NAFLD or Viral Chronic Liver Disease. Diagnostics (Basel). 2021. Vol. 11, No 1. P. 98. doi: 10.3390/diagnostics11010098.
- Kupčová V, et al. Overview of the Pathogenesis, Genetic, and Non-Invasive Clinical, Biochemical, and Scoring Methods in the Assessment of NAFLD. Int J Environ Res Public Health. 2019. Vol. 16, No 19. P. 3570. doi: 10.3390/ijerph16193570.
- Rosato V, Masarone M, Aglitti A, Persico M. The diagnostic conundrum in non-alcoholic fatty liver disease. Explor Med. 2020. No 1. P. 259-286. doi: 10.37349/emed.2020.00018.
- Vali Y, et al. FibroTest for Evaluating Fibrosis in Non-Alcoholic Fatty Liver Disease Patients: A Systematic Review and Meta-Analysis. J Clin Med. 2021. Vol. 10, No 11. P. 2415. doi: 10.3390/jcm10112415.
- Lardi LL, et al. Fibromax and inflamatory markers cannot replace liver biopsy in the evaluation of non-alcoholic fatty liver disease. Minerva Gastroenterol (Torino). 2022. Vol. 68, No 1. P. 85-90. doi: 10.23736/S2724-5985.20.02746-4.
- Drescher HK, Weiskirchen S, Weiskirchen R. Current Status in Testing for Nonalcoholic Fatty Liver Disease (NAFLD) and Nonalcoholic Steatohepatitis (NASH). Cells. 2019. Vol. 8, No 8. P. 845. doi: 10.3390/cells8080845.
- Okanoue T, et al. A simple scoring system using type IV collagen 7S and aspartate aminotransferase for diagnosing nonalcoholic steatohepatitis and related fibrosis. J Gastroenterol. 2018. Vol. 53, No 1. P. 129-139. doi: 10.1007/s00535-017-1355-9.
- Yu-tian Cao, et al. Accuracy of controlled attenuation parameter (CAP) and liver stiffness measurement (LSM) for assessing steatosis and fibrosis in non-alcoholic fatty liver disease: A systematic review and meta-analysis. eClinicalMedicine. 2022. Vol. 51. P. 101547. doi: 10.1016/j.eclinm.2022.101547.
- Jiang M, et al. The diagnostic value of novel ultrasound attenuation analysis in detecting liver steatosis identified by the controlled attenuation parameter: a diagnostic accuracy study. Ann. Transl. Med. 2023. Vol. 11(2). Р. 38. doi: 10.21037/atm-22-5821.
- Zayadeen AR, et al. Comparing shear wave elastography with liver biopsy in the assessment of liver fibrosis at King Hussein Medical Center. Egyptian Liver Journal. 2022. No 12. P. 24. doi: 10.1186/s43066-022-00186-z.
- Nogami A, et al. Diagnostic comparison of vibration-controlled transient elastography and MRI techniques in overweight and obese patients with NAFLD. Sci. Rep. 2022. Vol. 12(1). Р. 21925. doi: 10.1038/s41598-022-25843-6.
- Oyelade T, Alqahtani J, Canciani G. Prognosis of COVID-19 in patients with liver and kidney diseases: an early systematic review and meta-analysis. Trop Med Infect Dis. 2020. Vol. 5. P. 80. doi: 10.3390/tropicalmed5020080.
- Roehlen N, Crouchet E, Baumert TF. Liver Fibrosis: Mechanistic Concepts and Therapeutic Perspectives. Cells. 2020. Vol. 9, No 4. P. 875. doi: 10.3390/cells9040875.
- Alahyari S, et al. Immunological evaluation of patients with 2019 novel coronavirus pneumonia: CD4+ and CD16+ cells may predict severity and prognosis PLoS One. 2022. Vol. 17, No 8. P. e0268712. doi: 10.1371/journal.pone.0268712.
- Younossi Z, et al. The conundrum of cryptogenic cirrhosis: adverse outcomes without treatment options. J Hepatol. 2018. Vol. 69, No 6. P. 1365e1370. doi: 10.1016/j.jhep.2018.08.013.
- Guarino M, et al. COVID-19 and Fatty Liver Disorders. Review. J. Clin. Med. 2023. Vol. 12(13). P. 4316. doi: 10.3390/jcm12134316.
- Michalak A, et al. Plateletcrit and Mean Platelet Volume in the Evaluation of Alcoholic Liver Cirrhosis and Nonalcoholic Fatty Liver Disease Patients. Biomed Res Int. 2021. Vol. 2021. P. 8867985. doi: 10.1155/2021/8867985.
- Li L, Yu J, Zhou Z. Association between platelet indices and non-alcoholic fatty liver disease: a systematic review and meta-analysis. Rev Esp Enferm Dig. 2024. Vol. 116, No 5. P. 264-273. doi: 10.17235/reed.2022.9142/2022.