Международный эндокринологический журнал Том 21, №2, 2025
Вернуться к номеру
Метаболічний статус та генетичні особливості одновуглецевого метаболізму у хворих на псоріаз на тлі антиметаболітної терапії
Авторы: K.V. Misiura (1), L.V. Roschenyuk (2), T.V. Tyzhnenko (1), V.M. Vorontsov (2), P.P. Ryzhko (2), N.H. Puzik (3), T.E. Tkachyk (4), O.M. Fedota (5)
(1) - V. Danilevsky Institute for Endocrine Pathology Problems of NAMSU, Kharkiv, Ukraine
(2) - Kharkiv Regional Clinical Dermatological and Venereological Dispensary 1, Kharkiv, Ukraine
(3) - Kharkiv National Medical University, Kharkiv, Ukraine
(4) - CooperSurgical, Inc., Sugar Land, Texas, USA
(5) - AMS LLC, Kharkiv, Ukraine
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
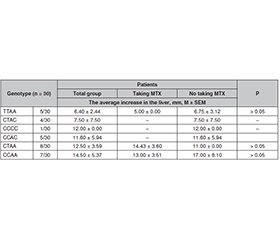
Актуальність. Мета: оцінити метаболічний статус хворих на псоріаз залежно від генотипу за однонуклеотидними поліморфізмами (SNP) C677T та A1298C гена MTHFR при лікуванні метотрексатом. Матеріали та методи. Під спостереженням перебувало 77 хворих на псоріаз. Їхні генотипи за поліморфними варіантами C677T та A1298C гена MTHFR встановлено методом ПЛР-ПДРФ. Біохімічні показники оцінено до та після лікування метотрексатом. Статистичний аналіз проведено за допомогою тестів Колмогорова — Смирнова, Шапіро — Вілка, Вілкоксона і Т-критерію. Розраховані коефіцієнти кореляції Пірсона. Результати. Різниця, встановлена між рівнями аланінамінотрансферази до (0,60 ± 0,04) та після (0,74 ± 0,06) лікування в пацієнтів із генотипом СТ за SNP C677T гена MTHFR, які отримували метотрексат, значуща (р < 0,008); у хворих із генотипами СС та ТТ значущої різниці не зазначено. Між рівнями аспартатамінотрансферази до та після лікування метотрексатом в учасників зі всіма генотипами (СС, СТ та ТТ) значущої різниці не виявлено. Також у хворих із генотипом СТ за C677T MTHFR після лікування метотрексатом спостерігалося зростання вмісту білірубіну, креатиніну, сечовини. У пацієнтів із генотипом ТТ за C677T MTHFR після застосування метотрексату також відзначалося значуще підвищення білірубіну, креатиніну, альфа-амілази, сечовини. В учасників із генотипом АА за A1298C MTHFR після терапії метотрексатом усі біохімічні показники сироватки крові продемонстрували значущу динаміку: рівні альфа-амілази та загального білка знизились, інші показники підвищились. Рівень аланінамінотрансферази після лікування метотрексатом збільшився майже в 1,3 разa. У хворих із генотипом АС після терапії не спостерігалося істотних змін жодного з показників. Проведено аналіз зв’язку між патологічним збільшенням печінки (гепатомегалією) та дифузними захворюваннями печінки й генотипами за SNP C677T і A1298C MTHFR в осіб із псоріазом. Встановлено негативну кореляцію між кількістю поліморфних алелів у генотипі пацієнта й гепатомегалією (r = –0,91; p = 0,009). Найсуттєвіше (14.50 ± 5.37 мм) збільшення розміру печінки спостерігається у хворих iз генотипом CCAA, який є прогностично найбільш сприятливим для розвитку псоріазу та його ускладнень. Найменше збільшення печінки (6.40 ± 2.44 мм) виявлено в пацієнтів із генотипом TTAA, що є фактором ризику розвитку псоріазу й побічних ефектів при терапії метотрексатом. Аналіз як окремого локусу, так і гаплотипу свідчить про те, що поліморфізм гена MTHFR має певний вплив під час терапії метотрексатом у хворих на псоріаз. Важливим є прогнозування результатів фармакотерапії з урахуванням персональних молекулярно-генетичних маркерів. Висновки. Оцінка стану печінки після лікування метотрексатом показала обернену залежність між збільшенням її розмірів та наявністю поліморфних алелів у генотипі пацієнтів. Найбільше збільшення розмірів печінки спостерігається у хворих із генотипом CCAA. Ймовірно, генотип, зокрема СС, дозволяє певний час приймати метотрексат без суттєвих ускладнень, що з часом позначається на стані та характеристиках печінки.
Background. The purpose was to evaluate the metabolic status of patients with psoriasis depending on the genotype of single-nucleotide polymorphisms (SNP) C677T and A1298C of the MTHFR gene with methotrexate treatment. Materials and methods. 77 patients with psoriasis were included in the study. Their genotypes based on polymorphic variants of the MTHFR gene were determined by the PCR-RFLP. Biochemical indicators were evaluated before and after treatment with methotrexate. Correspondence to the law of normal distribution was verified before further statistical analysis using the T-test, Kolmogorov-Smirnov, Shapiro-Wilk, Wilcoxon tests; Pearson correlation coefficients were calculated. Results. The difference between ALT levels before (0.60 ± 0.04) and after (0.74 ± 0.06) treatment in patients with CT genotype for SNP C677T of the MTHFR gene who received methotrexate is significant (p < 0.008), while in those with CC and TT genotypes, no significant difference was noted. No significant difference was found between AST levels before and after methotrexate treatment in patients with all genotypes — CC, CT and TT. Also, in participants with CT genotype for C677T MTHFR, a significant increase in bilirubin, creatinine, urea was noted after treatment with methotrexate. Carriers of genotype TT on C677T polymorphism of the MTHFR gene after treatment with methotrexate also showed a significant increase in bilirubin, creatinine, α-amylase, urea. In patients with the AA genotype for A1298C polymorphism of the MTHFR gene, the level of all serum biochemical indicators after methotrexate therapy changed significantly (p < 0.05–0.001): α-amylase and total protein decreased, and the levels of other indicators increased. Our study demonstrated that AA genotype on MTHFR A1298C is associated with elevated level of ALT after methotrexate treatment — by almost 1.3 times. No significant changes in any of the indicators were observed in patients with AC genotype after treatment. An analysis was carried out of the relationship between pathological enlargement of the liver — hepatomegaly, diffuse liver diseases and genotypes for SNP C677T and A1298C MTHFR in patients with psoriasis. A negative correlation was found between the number of polymorphic alleles in the patient’s genotype and hepatomegaly (r = –0.91, p = 0.009). The highest increase (14.50 ± 5.37 mm) in the size of the liver is observed in patients with the CCAA genotype, which is prognostically most favorable for the development of psoriasis and its complications. The smallest enlargement of the liver (6.40 ± 2.44 mm) was found in patients with the TTAA genotype, which is a risk factor for the development of psoriasis and side effects during methotrexate therapy. Both single-locus and haplotype analysis suggest that the MTHFR gene polymorphism has an effect during methotrexate therapy in psoriasis patients. It is important to predict the results of pharmacotherapy taking into account personal molecular genetic markers. Conclusions. Assessment of the condition of the liver after treatment with methotrexate showed an inverse relation between an increase in its size and the presence of polymorphic alleles in the patients’ genotype. The highest increase in liver size is observed in patients with the CCAA genotype. Probably, the genotype, in particular CC, allows taking methotrexate for a certain time without significant complications, which affects the condition and characteristics of the liver over time.
псоріаз; метаболічний статус; ген MTHFR; однонуклеотидний поліморфізм; метотрексат
psoriasis; metabolic status; MTHFR gene; single-nucleotide polymorphism; methotrexate
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Leis K, Mazur E, Jabłońska MJ, Kolan M, Gałązka P. Endocrine systems of the skin. Postepy Dermatol Alergol. 2019 Oct;36(5):519-523. doi: 10.5114/ada.2019.89502.
- Datta D, Madke B, Das A. Skin as an endocrine organ: A narrative review. Indian J Dermatol Venereol Leprol. 2022 Sep-Oct;88(5):590-597. doi: 10.25259/IJDVL_533_2021.
- Reichrath J. The skin: A powerful hormone factory. Dermatoendocrinol. 2012 Jan 1;4(1):1. doi: 10.4161/derm.20016.
- Roman II, Constantin AM, Marina ME, Orasan RI. The role of hormones in the pathogenesis of psoriasis vulgaris. Clujul Med. 2016;89(1):11-8. doi: 10.15386/cjmed-505.
- Brożyna AA, Slominski RM, Nedoszytko B, Zmijewski MA, Slominski AT. Vitamin D Signaling in Psoriasis: Pathogenesis and Therapy. Int J Mol Sci. 2022 Aug 2;23(15):8575. doi: 10.3390/ijms23158575.
- Pannu S, Rosmarin D. Psoriasis in Patients with Metabolic Syndrome or Type 2 Diabetes Mellitus: Treatment Challenges. Am J Clin Dermatol. 2021 May;22(3):293-300. doi: 10.1007/s40257-021-00590-y.
- Wu Y, Huang M, Chen X, Wu J, Li L, et al. A genome-wide cross-trait analysis identifies shared loci and causal relationships of obesity and lipidemic traits with psoriasis. Front Immunol. 2024 Mar 14;15:1328297. doi: 10.3389/fimmu.2024.1328297.
- Olejnik-Wojciechowska J, Boboryko D, Bratborska AW, Rusińska K, Ostrowski P, Baranowska M, Pawlik A. The Role of Epigenetic Factors in the Pathogenesis of Psoriasis. International Journal of Molecular Sciences. 2024;25(7):3831. doi: 10.3390/ijms25073831.
- Berna-Rico E, Perez-Bootello J, Abbad-Jaime de Aragon C, Gonzalez-Cantero A. Genetic Influence on Treatment Response in Psoriasis: New Insights into Personalized Medicine. Int J Mol Sci. 2023 Jun 7;24(12):9850. doi: 10.3390/ijms24129850.
- Wang CY, Wang CW, Chen CB, Chen WT, Chang YC, Hui RC, Chung WH. Pharmacogenomics on the Treatment Response in Patients with Psoriasis: An Updated Review. Int J Mol Sci. 2023 Apr 15;24(8):7329. doi: 10.3390/ijms24087329.
- Hamed KM, Dighriri IM, Baomar AF, Alharthy BT, Alenazi FE, et al. Overview of Methotrexate Toxicity: A Comprehensive Literature Review. Cureus. 2022 Sep 23;14(9):e29518. doi: 10.7759/cureus.29518.
- Yazıcıoğlu B, Kaya Z, Güntekin Ergun S, Perçin F, Koçak Ü, Yenicesu İ, Gürsel T. Influence of Folate-Related Gene Polymorphisms on High-Dose Methotrexate-Related Toxicity and Prognosis in Turkish Children with Acute Lymphoblastic Leukemia. Turk J Haematol. 2017 Jun 5;34(2):143-150. doi: 10.4274/tjh.2016.0007.
- Bello AE, Perkins EL, Jay R, Efthimiou P. Recommendations for optimizing methotrexate treatment for patients with rheumatoid arthritis. Open Access Rheumatol. 2017 Mar 31;9:67-79. doi: 10.2147/OARRR.S131668.
- Malaviya AN. Landmark papers on the discovery of metho–trexate for the treatment of rheumatoid arthritis and other systemic inflammatory rheumatic diseases: a fascinating story. Int J Rheum Dis. 2016 Sep;19(9):844-51. doi: 10.1111/1756-185X.12862.
- Fedota OM, Roschenyuk LV, Tyzhnenko TV, Puzik NG, Vorontsov VM, Ryzhko PP. Methotrexate effect on biochemical indices of psoriasis patients depends on MTHFR gene polymorphism. The Ukrainian Biochemical Journal. 2020;92(1):66-74. doi: 10.15407/ubj92.01.066.
- Fedota O, Roschenyuk L, Tyzhnenko T, Merenkova I, Vorontsov V. Pharmacogenetic effects of methotrexate (MTX) in Ukrainian patients depending on the MTHFR genotypes (clinical cases). Georgian Med News. 2018 Jun;(279):111-117.
- Mikkelsen TS, Thorn CF, Yang JJ, Ulrich CM, French D, et al. PharmGKB summary: methotrexate pathway. Pharmacogenet Genomics. 2011 Oct;21(10):679-86. doi: 10.1097/FPC.0b013e328343dd93.
- Warren RB, Smith RL, Campalani E, Eyre S, Smith CH, et al. Outcomes of methotrexate therapy for psoriasis and relationship to genetic polymorphisms. Br J Dermatol. 2009 Feb;160(2):438-41. doi: 10.1111/j.1365-2133.2008.08898.x.
- Qiu Q, Huang J, Lin Y, Shu X, Fan H, et al. Polymorphisms and pharmacogenomics for the toxicity of methotrexate monotherapy in patients with rheumatoid arthritis: A systematic review and meta-ana–lysis. Medicine (Baltimore). 2017 Mar;96(11):e6337. doi: 10.1097/MD.0000000000006337.
- Poursadegh Zonouzi A, Chaparzadeh N, Asghari Estiar M, Mehrzad Sadaghiani M, et al. Methylenetetrahydrofolate Reductase C677T and A1298C Mutations in Women with Recurrent Spontaneous Abortions in the Northwest of Iran. ISRN Obstet Gynecol. 2012;2012:945486. doi: 10.5402/2012/945486.
- Vanilla S, Dayanand CD, Kotur PF, Kutty MA, Vegi PK. Evidence of Paternal N5, N10-Methylenetetrahydrofolate Reductase (MTHFR) C677T Gene Polymorphism in Couples with Recurrent Spontaneous Abortions (RSAs) in Kolar District, A South West of India. J Clin Diagn Res. 2015 Feb;9(2):BC15-8. doi: 10.7860/JCDR/2015/10856.5579.
- Statistical Methods in Medical Research. Editorial. Stat Methods Med Res. 2010 Oct;19(5):427-8. doi: 10.1177/0962280210379173.
- Unified clinical protocol of primary, secondary (specialized), tertiary (highly specialized) medical aid. Psoriasis, including psoriatic arthropathies. Kyiv: Publishing House “KIM”, 2016. 68 p. (in Ukrainian).
- Guerra Ruiz AR, Crespo J, López Martínez RM, Iruzubieta P, Casals Mercadal G, et al. Measurement and clinical usefulness of bilirubin in liver disease. Adv Lab Med. 2021 Jul 9;2(3):352-372. doi: 10.1515/almed-2021-0047.
- Sparks JA, Vanni KMM, Sparks MA, Xu C, Santacroce LM, et al. Effect of Low-Dose Methotrexate on eGFR and Kidney Adverse Events: A Randomized Clinical Trial. J Am Soc Nephrol. 2021 Dec 1;32(12):3197-3207. doi: 10.1681/ASN.2021050598.
- Zappacosta B, Graziano M, Persichilli S, Di Castelnuovo A, Mastroiacovo P, Iacoviello L. 5,10-Methylenetetrahydrofolate reductase (MTHFR) C677T and A1298C polymorphisms: genotype frequency and association with homocysteine and folate levels in middle-–southern Italian adults. Cell Biochem Funct. 2014 Jan;32(1):1-4. doi: 10.1002/cbf.3019.
- Ménézo Y, Patrizio P, Alvarez S, Amar E, Brack M, et al. MTHFR (methylenetetrahydrofolate reductase: EC 1.5.1.20) SNPs (single-nucleotide polymorphisms) and homocysteine in patients referred for investigation of fertility. J Assist Reprod Genet. 2021 Sep;38(9):2383-2389. doi: 10.1007/s10815-021-02200-6.
- Molaqanbari MR, Zarringol S, Talari HR, Taghizadeh M, Bahmani F, et al. Effects of Folic Acid Supplementation on Liver Enzymes, Lipid Profile, and Insulin Resistance in Patients with Non-Alcoholic Fatty Liver Disease: A Randomized Controlled Trial. Adv Biomed Res. 2023 Apr 27;12:103. doi: 10.4103/abr.abr_90_22.
- Yang L, Hu X, Xu L. Impact of methylenetetrahydrofolate reductase (MTHFR) polymorphisms on methotrexate-induced toxicities in acute lymphoblastic leukemia: a meta-analysis. Tumour Biol. 2012 Oct;33(5):1445-54. doi: 10.1007/s13277-012-0395-2.
- Li WX, Li W, Cao JQ, Yan H, Sun Y, et al. Folate Deficiency Was Associated with Increased Alanine Aminotransferase and Glutamyl Transpeptidase Concentrations in a Chinese Hypertensive Population: A Cross-Sectional Study. J Nutr Sci Vitaminol (Tokyo). 2016;62(4):265-271. doi: 10.3177/jnsv.62.265.
- Bath RK, Brar NK, Forouhar FA, Wu GY. A review of metho–trexate-associated hepatotoxicity. J Dig Dis. 2014;15(10):517-524. doi: 10.1111/1751-2980.12184.
- Berkani LM, Rahal F, Allam I, Mouaki Benani S, Laadjouz A, Djidjik R. Association of MTHFR C677T and A1298C gene polymorphisms with methotrexate efficiency and toxicity in Algerian rheumatoid arthritis patients. Heliyon. 2017 Dec 1;3(11):e00467. doi: 10.1016/j.heliyon.2017.e00467.
- Ghodke-Puranik Y, Puranik AS, Shintre P, Joshi K, Patwardhan B, et al. Folate metabolic pathway single nucleotide polymorphisms: a predictive pharmacogenetic marker of methotrexate response in In–dian (Asian) patients with rheumatoid arthritis. Pharmacogenomics. 2015 Dec;16(18):2019-34. doi: 10.2217/pgs.15.145.
- Mutlak QM, Kasim AA. Association of the rs1801133 and rs1801131 polymorphisms in the MTHFR gene and the adverse drug reac–tion of methotrexate treatment in a sample of Iraqi rheumatoid arthritis patients. Pharmacia. 2024;71:1-8. doi: 10.3897/pharmacia.71.e113597.
- Maybury CM, Jabbar-Lopez ZK, Wong T, Dhillon AP, Bar–ker JN, Smith CH. Methotrexate and liver fibrosis in people with psoriasis: a systematic review of observational studies. Br J Dermatol. 2014 Jul;171(1):17-29. doi: 10.1111/bjd.12941.