Международный эндокринологический журнал Том 20, №8, 2024
Вернуться к номеру
Вивчення кардіоваскулярного ризику у хворих на цукровий діабет 2-го типу у гострій фазі коронавірусної інфекції та постковідному періоді на тлі терапії із застосуванням інгібіторів натрійзалежного котранспортера глюкози-2
Авторы: Кушнарьова Н.М. (1), Зінич О.В. (1), Шупрович А.А. (1), Комісаренко К.П. (2, 3)
(1) - ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України», м. Київ, Україна
(2) - Медичний центр «Адоніс-Лаб» (Adonis-Lab), м. Київ, Україна
(3) - Медичний центр «Top Clinic Denis» (ТОВ «Клініка Денис»), м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
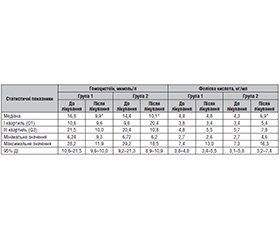
Актуальність. Актуальність пошуку оптимальних методів лікування осіб з цукровим діабетом 2-го типу (ЦД2), які перенесли коронавірусну хворобу, зумовлена тим, що ці стани мають низку загальних патогенетичних механізмів, що призводять до взаємного обтяження. Мета: у пацієнтів з ЦД2 у постковідному періоді оцінити ефект дії цукрознижувальної терапії з використанням інгібіторів натрійзалежного котранспортера глюкози-2 (іНЗКТГ-2) на рівень серцево-судинних маркерів — пептиду ST2 та гомоцистеїну — порівняно зі стандартною терапією (метформін/похідні сульфонілсечовини). Матеріали та методи. Обстежено 43 хворі на ЦД2 віком 44–85 років у гострий період COVID-19 та через 9 місяців після одужання. Група 1 (n = 25) отримувала додатково до метформіну лікування препаратами іНЗКТГ-2, група 2 (n = 18) продовжувала прийом комбінації метформін/похідні сульфонілсечовини. Групу 3 (контрольну) становили 32 пацієнти без порушення вуглеводного обміну, які перехворіли на COVID-19. Строк спостереження становив 9–12 місяців після одужання від COVID-19. Результати. Через 9 місяців лікування відзначено вірогідне зниження підвищеного в гострому періоді COVID-19 рівня в сироватці крові гомоцистеїну, який досяг нормальних значень (у групі 1 — від 16,8 до 9,9; у групі 2 — від 14,4 до 10,1 мкмоль/л; р < 0,05). Крім того, в постковідному періоді виявлено вірогідне зниження рівня біомаркера серцево-судинної патології ST2 в сироватці крові хворих групи 1 (від 5,4 до 4,8 нг/мл; р < 0,05), на відміну від групи 2, де рівень ST2 підвищився (від 4,9 до 5,7 нг/мл; р < 0,05). Пацієнти групи 3, на відміну від хворих на ЦД2 обох груп, мали значно нижчий середній рівень ST2 (р < 0,05), що не змінився через 9 місяців після перенесеної коронавірусної інфекції (p > 0,05). Висновки. Отримані результати підтверджують позитивний ефект прийому препаратів групи іНЗКТГ-2 на рівні маркерів серцево-судинного ризику у пацієнтів з ЦД2, які отримували терапію гліфлозинами протягом 9 місяців після одужання від COVID-19, на відміну від групи хворих, які приймали метформін/похідні сульфонілсечовини.
Background. The relevance of finding optimal methods for treatment of people with type 2 diabetes (T2DM) who had coronavirus disease 2019 (COVID-19) is due to the fact that these conditions have a number of common pathogenetic mechanisms that cause complications of both diseases. The purpose of the study was to assess the effect of antidiabetic therapy using sodium-glucose cotransporter-2 inhibitors (SGLT2i) on serum level of cardiovascular markers, ST2 peptide and homocysteine, in patients with T2DM in the post-COVID period compared to standard therapy (metformin/sulfonylurea derivatives). Materials and methods. Forty-three T2DM patients aged 44–85 were examined during the acute period of COVID-19 and nine months after recovery. Group 1 (n = 25) received treatment with SGLT2i in addition to metformin; group 2 (n = 18) continued taking a combination of metformin and sulfonylurea derivatives. Group 3 (control) consisted of 32 people without an impaired carbohydrate metabolism who have had COVID-19. The follow-up period was 9–12 months after recovery from COVID-19. Results. In 9 months of treatment, a significant decrease was noted in serum level of homocysteine, which was elevated in the acute period of COVID-19 and reached normal values: in group 1, from 16.8 to 9.9; in group 2, from 14.4 to 10.1 μmol/l; p < 0.05. In addition, in the post-COVID period, there was a significant decrease in the serum level of ST2, the biomarker of cardiovascular pathology, in patients of group 1 (from 5.4 to 4.8 ng/ml; p < 0.05), in contrast to group 2, where ST2 increased (from 4.9 to 5.7; p < 0.05). Patients of group 3, unlike individuals with T2DM from both groups, had a significantly lower average level of ST2 (p < 0.05), which did not change 9 months after the coronavirus infection (p > 0.05). Conclusions. The results obtained confirm the positive effect of taking SGLT2i on the level of cardiovascular risk markers in patients with T2DM who had received gliflozin therapy for 9 months after recovery from COVID-19, in contrast to the group of patients who received metformin/sulfonylurea derivatives.
коронавірусна хвороба; цукровий діабет; постковідний період; ендотеліальна дисфункція; серцево-судинні захворювання; серцева недостатність; ST2-пептид; гомоцистеїн; фолієва кислота; інгібітори натрійзалежного котранспортера глюкози-2
coronavirus disease; type 2 diabetes mellitus; post-COVID period; endothelial dysfunction; cardiovascular diseases; heart failure; ST2 peptide; homocysteine; folic acid; sodium-glucose cotransporter-2 inhibitors
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Seferović PM, Petrie MC, Filippatos GS, Anker SD, Rosano G, Bauersachs J, et al. Type 2 diabetes mellitus and heart failure: a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2018 May;20(5):853-872. doi: 10.1002/ejhf.1170.
- Ceriello A, Catrinoiu D, Chandramouli C, Cosentino F, Dombrowsky AC, Itzhak B, et al.; D&CVD EASD Study Group. Heart failure in type 2 diabetes: current perspectives on screening, diagnosis and management. Cardiovasc Diabetol. 2021 Nov 6;20(1):218. doi: 10.1186/s12933-021-01408-1.
- Palazzuoli A, Iacoviello M. Diabetes leading to heart failure and heart failure leading to diabetes: epidemiological and clinical evidence. Heart Fail Rev. 2023 May;28(3):585-596. doi: 10.1007/s10741-022-10238-6.
- Shi S, Qin M, Shen B, Cai Y, Liu T, Yang F, et al. Association of cardiac injury with mortality in hospitalized patients with COVID 19 in Wuhan, China. JAMA Cardiol. 2020 Jul 1;5(7):802-810. doi: 10.1001/jamacardio.2020.0950.
- Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020;395 (10229):1054-1062. doi: 10.1016/s0140 6736 (20)30566-3.
- Yu Y, Gupta A, Wu C, et al. Outcomes of patients hospitali–zed for heart failure in China: the China PEACE retrospective heart failure study. J Am Heart Assoc. 2019; 8:e012884. doi: 10.1161/JAHA.119.012884.
- Bozkurt B, Coats AJS, Tsutsui H, Abdelhamid M, Adamopoulos S, Albert N, et al. Universal Definition and Classification of Heart Failure: A Report of the Heart Failure Society of America, Heart Fai–lure Association of the European Society of Cardiology, Japanese Heart Failure Society and Writing Committee of the Universal Definition of Heart Failure. J Cardiac Fail 2021 Mar 1:S1071-9164(21)00050-6. doi: 10.1016/j.cardfail.2021.01.022.
- Wu Z, McGoogan J. Characteristics of and important lessons from the Coronavirus disease 2019 (COVID-19) outbreakin China: Summary of a report of 72 314 cases from the Chinese center for disease control and prevention. JAMA. 2020;323(13):1239. dx.doi.org/–10.1001/jama.2020.2648.
- Chen N, Zhou M, Dong X, Qu J, Gong F, Han Y, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumoniain Wuhan, China: a descriptive study. Lancet. 2020; 395(10223):507-13. dx.doi.org/10.1016/s0140-6736(20)30211-7.
- DeFilippis EM, Reza N, Donald E, Givertz MM, Lindenfeld J, Jessup M. Considerations for Heart Failure Care During the COVID-19 Pandemic. JACC HeartFail. 2020 Aug;8(8):681 691. doi: 10.1016/j.jchf.2020.05.006.
- Rolek B, Haber M, Gajewska M, Rogula S, Pietrasik A, Gąsecka A. SGLT2 Inhibitors vs. GLP-1 Agonists to Treat the Heart, the Kidneys and the Brain. J Cardiovasc Dev Dis. 2023 Jul 30;10(8):322. doi: 10.3390/jcdd10080322.
- Mahaffey KW, Jardine MJ, Bompoint S, Cannon CP, Neal B, Heerspink HJL, et al. Canagliflozin and Cardiovascular and Renal Outcomes in Type 2 Diabetes Mellitus and Chronic Kidney Disease in Primary and Secondary Cardiovascular Prevention Groups. Circulation. 2019 Aug 27;140(9):739-750. doi: 10.1161/CIRCULATIONAHA.119.042007.
- García-Seara J, González Melchor L, Rodríguez García J, Gude F, Martínez Sande JL, Rodríguez Mañero M, Fernández López XA, et al. Role of Soluble ST2 Biomarker in Predicting Recurrence of Atrial Fibrillation after Electrical Cardioversion or Pulmonary Vein Isolation. Int J Mol Sci. 2023 Sep 13;24(18):14045. doi: 10.3390/ijms241814045. PMID: 37762349; PMCID: PMC10531224.
- Hermann A, Sitdikova G. Homocysteine: Biochemistry, Molecular Biology and Role in Disease. Biomolecules. 2021 May 15;11(5):737. doi: 10.3390/biom11050737.
- Heidenreich PA, Bozkurt B, Aguilar D, Allen LA, Byun JJ, Colvin MM, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2022 May 3;145(18):e895-e1032. doi: 10.1161/CIR.0000000000001063.
- Biaggi P, Ammann C, Imperiali M, Hammerer-Lercher A, Breidthardt T, Muller C, et al. Soluble ST2 — a new biomarker in heart failure. CardiovascMed. 2019;22:w 02008.
- Arkhypkina T, Bondarenko V, Lyubimovа L, Misiura K. Level of homocysteine and polymorphism of genes involved in folate metabolism in women with polycystic ovary syndrome. International Journal of Endocrinology (Ukraine). 2023;19(7):529-535. https://doi.org/–10.22141/2224-0721.19.7.2023.1331.
- Chen P, Zhang J, Du J, Shi D, Zhang H. Predictive value of soluble suppression of tumorigenicity 2 in atrial fibrillation: a systematic review and meta-analysis. Front Cardiovasc Med. 2024 Jan 11;10:1308166. doi: 10.3389/fcvm.2023.1308166. PMID: 38274310; PMCID: PMC10808625.