1. Вступ
Місцеве застосування лікарських засобів — це метод введення лікарських засобів через шкіру для досягнення місцевих терапевтичних ефектів, що має кілька переваг перед системним введенням лікарських засобів, наприклад, знижені системні побічні ефекти та поліпшення дотримання пацієнтами встановлених вимог [1]. Зокрема, місцеве застосування нестероїдних протизапальних лікарських засобів, як-от диклофенак (DIC), є клінічно успішним методом протидії болю безпосередньо у місці його походження [2]. Ефективність таких засобів для місцевого застосування критично залежить від самої форми лікарського препарату (наприклад, різні солі [3]), а також від допоміжних інгредієнтів [4–6].
/76.jpg)
Основною перешкодою для ефективного місцевого (і трансдермального) введення лікарських засобів є зовнішній шар шкіри — роговий шар (SC), зокрема його позаклітинний ліпідний матрикс з високою гідрофобністю. Відповідно, методи поліпшення місцевого або трансдермального введення лікарських засобів, як-от хімічні підсилювачі просочування (інші назви — підсилювачі проникнення, каталізатори, промотори всмоктування), впливають на ці високовпорядковані та щільні ліпіди (в ідеалі — оборотно) [7–9]. Олеїнова кислота та олеїловий спирт — це два підсилювачі, що були ретельно вивчені та комерційно використовуються для місцевого введення лікарських засобів [10–20]. Олеїнова кислота — це мононенасичена ω-9 жирна кислота, що природно міститься у багатьох рослинних оліях, зокрема в оливковій олії, а олеїловий спирт — це жирний спирт, що отримується з олеїнової кислоти (pис. 1). Обидва підсилювачі мають однаковий 18-вуглецевий ланцюг з цис-подвійним зв’язком посередині, що спричиняє характерний злам ланцюга, який не допускає ефективного пакування ланцюга та забезпечує їх рідкий стан при кімнатній температурі (точки плавлення 13 °C для олеїнової кислоти та 5 °C для олеїлового спирту). Обидва вони також є високоліпофільними (log P > 7) та спорідненими з ліпідами рогового шару шкіри. Вони відрізняються за структурою полярної голови, карбоксильною функцією (олеїнова кислота) та гідроксильною функцією (олеїловий спирт). Карбоксил є більш об’ємним, ніж гідроксил, формує більше водневих зв’язків та може бути іонізований до негативно зарядженого карбоксилату при фізіологічно відповідних значеннях pH. Повідомлялося, що олеїнова кислота призводить до порушення структури ліпідів SC та/або формує дискретні зони, що сприяють просочуванню лікарських засобів [10–16]. Також повідомлялося про наявність більшої кількості рідинних ланцюгів у шкірі, обробленій олеїловим спиртом [21]. Повідомлялося про подразнення шкіри при застосуванні олеїнової кислоти 4,5–10% [16, 22, 23], тоді як застосування олеїлового спирту до 10 % не призвело до помітних змін у гістологічній структурі оголеної шкіри мишей [23].
Комерційно доступні безрецептурні препарати диклофенаку (DIC), що містять олеїловий спирт або олеїнову кислоту, продемонстрували еквівалентний трансдермальний транспорт DIC in vitro за 24 години [24], але незрозуміло, чи однаково діють ці два підсилювачі з точки зору їх просочування та утримання в SC залежно від часу взаємодії з компонентами шкірного бар’єра, впливу на втрату води та швидкості відновлення пошкодженого шкірного бар’єра після видалення продукту. Усі ці фактори важливо враховувати при формулюванні лікарських засобів для місцевого застосування, що повинні мати добру переносимість навіть у разі частого та/або тривалого використання. Окрім кількості лікарського засобу, що просочується через шкіру, також важливо розуміти вплив цих підсилювачів на утримання лікарського препарату в шкірі (створення резервуару) — фактор, що має важливе значення для безперервного вивільнення та дії лікарських засобів для місцевого застосування [25–27].
Наша мета — краще зрозуміти різницю між ефектами підсилення просочування від олеїнової кислоти та олеїлового спирту з точки зору їх взаємодії з бар’єром шкіри людини. Ми порівняли вплив олеїлового спирту та олеїнової кислоти при концентрації, наявній у комерційно доступних гелях місцевого застосування (0,75% w/v), на просочування та утримання 2,32% (w/v) диклофенаку діетиламіну (DIC-DEA; еквівалентно 2 % вільного DIC) у людській шкірі ex vivo. Ми також дослідили вплив цих підсилювачів на два показники функції шкірного бар’єра — трансепідермальну втрату води (TEWL) та електричний опір шкіри, як і на оборотність зазначених параметрів з часом після видалення підсилювачів з поверхні шкіри. Окрім того, було досліджено взаємодію олеїнової кислоти та олеїлового спирту зі шкірним бар’єром протягом тривалого часу методом інфрачервоної Фур’є-спектроскопії з перетворенням (FTIR) на людській шкірі, обробленій дейтерованими підсилювачами (для відокремлення піків поглинання, пов’язаних з ендогенними ліпідами SC та підсилювачами). Для цієї мети було синтезовано дейтерований олеїловий спирт-d33.
2. Експериментальний розділ
2.1. Хімічні речовини. Хімічні речовини були придбані у Sigma-Aldrich (Шнельдорф, Німеччина) та використовувались у тому вигляді, у якому вони були отримані. ТШХ було проведено на алюмінієвих пластинах Merck із силікагелем 60 F254. Для колонкової хроматографії використовувався Merck Kieselgel 60 (0,040–0,063 мм). Для очищення води використовувалась система очищення Millipore Q.
2.2. Синтез дейтерованої олеїнової кислоти-d33 (A). Олеїнову кислоту-d34 (23 мг; 0,073 ммоль) сушили у високому вакуумі, розчиняли в 1 мл сухого ТГФ та охолоджували на крижаній бані до 0 °C. Було додано 220 мкл (0,22 ммоль) розчину 1 M LiAlH4 у ТГФ у вигляді крапель, після чого реакційну суміш додатково перемішували протягом 1 години при 0 °C та протягом 30 хвилин при кімнатній температурі. Реакцію гасили шляхом повільного додавання 3 мл води та 1 мл 1 M HCl. Реакційну суміш екстрагувати діетиловим ефіром (4 × 10 мл), а органічну фазу сушили сульфатом натрію та випарювали досуха. Сирий продукт очищували з використанням колонкової хроматографії на кремнеземі з рухомою фазою гексан/етилацетат 10 : 1 (v/v), у результаті було отримано 18 мг (82%) продукту у вигляді білої напівтвердої речовини. Rf (гексан/етилацетат; 4 : 1, v/v) = 0,4. FTIR (ATR): νmax = 2198, 2096, 1088, 1050 см–1.
2.3. Шкіра людини. Людську шкіру було отримано від 7 жінок європеоїдної раси (28–59 років), яким було проведено абдомінопластику, на підставі їх письмової інформованої згоди. Дослідження було затверджено комітетом з етики хірургічного центру Sanus (03.11.2022 р.) відповідно до принципів Гельсінської декларації. Підшкірний жир було обережно видалено з тканини. Отримані фрагменти шкіри повної товщини промивали водою та фізіологічним розчином, витирали насухо та зберігали при –20 °C. Перед експериментом з просочування заморожену людську шкіру повільно розморожували та розрізали до товщини приблизно 400 мкм з використанням дерматома Acculan 3TI (Aesculap).
2.4. Зразки DIC-DEA для експериментів з просочування. Зразки DIC-DEA для експериментів з просочування містили DIC-DEA (2,32 %) у суміші ізопропіловий спирт/пропіленгліколь/вода (20 : 6 : 74, v/v/v) з олеїловим спиртом або олеїновою кислотою 0,75% (w/v) або без них. Усі зразки ретельно перемішували та інкубували при 32 °C протягом 24 годин. Розчинність DIC-DEA у цій суміші становить ~100 мг/мл та дещо зростає у разі наявності олеїлового спирту та олеїнової кислоти (118 та 129 мг/мл) без істотної різниці між підсилювачами. Таким чином, концентрація DIC-DEA 2,32 % відповідає 23, 20 та 18% насиченості в контролі, зразках олеїлового спирту та зразках олеїнової кислоти відповідно. Таким чином, термодинамічна активність лікарського засобу в препаратах, що досліджуються, аналогічна.
2.5. Експерименти з просочування через шкіру. Властивості підсилювачів щодо підсилення просочування досліджувались на людській шкірі у дифузійних камерах Франца. Дерматовану людську шкіру було розрізано на фрагменти 2 × 2 см, закріплено у тефлонових тримачах з круглою зоною просочування 1 см2 та розміщено у камерах Франца епідермісом вгору. Відсік акцептора (7,0 ± 0,5 мл) було заповнено фосфатним буферним розчином (PBS) з pH 7,4, з вмістом 0,005% гентаміцину. Було проведено візуальний огляд камер на предмет наявності витоків та бульбашок повітря (до та під час експерименту), після чого їх було розміщено на магнітній мішалці на водяній бані при 32 ± 1,0 °C. Цілісність шкіри оцінювалась за електричним опором. Зібрані камери Франца врівноважували протягом 30 хвилин, після чого на поверхню SC шкіри наносили 500 мкл PBS. Після 1 години балансування визначався електричний опір зразків шкіри (див. нижче). Всі фрагменти шкіри відповідали попередньо визначеному пороговому значенню опору > 10 кОм × см2. Після вимірювання опору PBS обережно видаляли з поверхні SC шкіри та висушували тканину ватними тампонами.
Потім кожен зі зразків DIC-DEA (10 мкл/см2) наносили на поверхню 12 фрагментів шкіри (3 донори шкіри, 4 повторення на кожного донора) без оклюзії для максимального відтворення реальних умов застосування. Для зручності 300 мкл аліквоти з рідини акцептора відбирали через 2, 4, 6 і 8 годин після введення у межах одного експерименту та через 12, 15, 18, 21 і 24 години у межах іншого експерименту. Концентрацію DIC-DEA було визначено методом високоефективної рідинної хроматографії (ВЕРХ).
Загальну кількість DIC-DEA, що просочилася через шкіру, було скориговано з урахуванням заміни фази акцептора і об’єму акцептора та показано залежно від часу. Після експерименту з просочування камери демонтували, шкіру акуратно промивали PBS, а зону просочування на шкірі (1 см2) вирізали. Після нагрівання фрагментів шкіри до 80 °C протягом 1 хвилини епідерміс відокремлювали від дерми, окремо зважували та екстрагували 1 мл екстракційного розчинника (ідентичного рухомій фазі для аналізу ВЕРХ, див. нижче) протягом 24 годин [28]. Шкіру нагрівали в алюмінієвій фользі (не у водному середовищі) для недопущення екстракції лікарського засобу під час ізоляції епідермісу. Хоча не можна виключати можливості незначного поширення лікарського засобу в епідермісі та дермі під час цієї процедури (1 хв), на нашу думку, це не впливає на результат експерименту, оскільки в епідермісі та дермі було виявлено аналогічні тенденції.
2.6. Високоефективна рідинна хроматографія (ВЕРХ). Вміст DIC-DEA було визначено методом ізократичної зворотно-фазової ВЕРХ з використанням приладу Shimadzu Prominence (Shimadzu, Японія) на колонці LiChroCART 250-4 (LiChrospher 100 RP-18, 5 мкм) при 30 °C із застосуванням суміші ацетонітрилу/води/оцтової кислоти (90 : 60 : 5, v/v/v) при 2,0 мл/хв. Об’єм введення — 20 мкл; стік вимірювали на 275 нм, час утримання — 3,6 хвилини. Калібрування — лінійне, у діапазоні 0,5–60 мкг/мл.
2.7. Оборотність впливу підсилювачів на трансепідермальну втрату води (TEWL) та електричний опір. Людську шкіру було розміщено у дифузійних камерах Франца аналогічно до розміщення при дослідженні просочування. Після 1 години балансування реєструвалися базальні значення TEWL та опору (більш низьке значення опору означає більш низький опір проходженню змінного електричного струму). Після цього на шкіру наносили 0,75% олеїловий спирт або олеїнову кислоту в суміші ізопропіловий спирт/пропіленгліколь/вода (20 : 6 : 74, v/v/v) та суміш ізопропілового спирту, пропіленгліколю та води як контроль (150 мкл/см2).
Через 24 години решту зразку DIC-DEA змивали за допомогою PBS, а поверхню шкіри обережно сушили ватним диском. Через 1, 4, 8, 12 та 24 години після видалення зразка реєструвались значення TEWL та опору. TEWL вимірювалася приладом AquaFlux AF 200 (Biox Systems Ltd., Лондон, Велика Британія), методом конденсаторної камери, при 27,0 ± 1,0 °C та 44 ± 3 % відносної вологості повітря. Електричний опір вимірювався LCR-метром 4080 (Conrad Electronic, Хіршау, Німеччина), що працював у паралельному режимі зі змінною частотою 120 Гц [29, 30].
2.8. Інфрачервона Фур’є-спектроскопія з перетворенням (FTIR). Спектри FTIR отримували при температурі навколишнього середовища, зі шкіри, обробленої зразками з дейтерованими підсилювачами (0,75 % у суміші розчинників, зазначеній вище) або без них, у дифузійних камерах Франца (умови, аналогічні умовам експерименту з просочування), з використанням спектрометра Nicolet 6700 FTIR (Thermo Scientific, Waltham), обладнаного кристалом MIRacle ZnSe з одним відображенням для порушеного повного внутрішнього відбивання. Спочатку зразки підсилювача або розчину наносили на шкіру в дозі, що використовувалася в експериментах з просочування (10 мкл/см2), протягом 8 або 24 годин, або в дозі, що використовувалася в експериментах з оборотності (150 мкл/см2) протягом 24 годин. Після цього отримували спектри FTIR через 1, 4, 8 та 12 годин після видалення зразка підсилювача або розчину. Спектри утворювались шляхом об’єднання 128 сканів, зроблених при роздільній здатності 2 см-1 [31]. Пікові значення та значення інтенсивності визначались після коригування базової лінії гумовою стрічкою без розгладжування. Для відносної кількісної оцінки вибраних компонентів ми використовували значення інтенсивності піка після коригування базової лінії.
2.9. Аналіз даних. Статистичний аналіз ANOVA з тестом Даннетта було проведено з використанням GraphPad Prism 6.07 (програмне забезпечення GraphPad). Враховуючи відносно невелику кількість донорів, придатних для експериментального дослідження, дані наведено як середнє значення ± стандартне відхилення (SD).
3. Результати та обговорення
3.1. Олеїловий спирт і олеїнова кислота 0,75% мають подібний вплив на просочування DIC-DEA за 24 години після нанесення однієї дози та на просочування DIC-DEA за 48 годин після нанесення чотирьох доз, але олеїнова кислота викликає більш швидке просочування протягом перших 8 годин. Профілі просочування зразків, що містять два підсилювачі, суттєво відрізнялися протягом перших 2–8 годин (рис. 1A). Олеїнова кислота спричинила більш швидке просочування DIC-DEA порівняно з олеїловим спиртом та конт–ролем, а в акцепторі з олеїновою кислотою через 8 годин було виявлено більшу сукупну кількість –DIC-DEA (5,4 ± 4,1 мкг/см2) порівняно з олеїловим спиртом (0,85 ± 1,2 мкг/см2) та контролем (0,85 ± 0,66 мкг/см2). Однак ця початкова різниця з часом вирівнялася. На рис. 1A, B показано схожий вплив олеїлового спирту та олеїнової кислоти на кількість DIC-DEA, що просочується крізь людську шкіру ex vivo у відсік акцептора за 24 години. Олеїловий спирт і олеїнова кислота підвищили сукупну кількість DIC-DEA в акцепторі у 2,8 раза (23,0 ± 3,1 мкг/см2) та у 2,6 раза (21,0 ± 9,2 мкг/см2) відповідно порівняно з контролем (лише розчинник; 8,2 ± 5,8 мкг/см2). Кількість DIC-DEA, виявлена в акцепторі через 24 години, відповідає 3,5; 9,9 та 9,1 % нанесеної дози (232 мкг/см2 DIC-DEA) в контрольному зразку та в зразках з олеїловим спиртом і олеїновою кислотою відповідно.
/79.jpg)
У зв’язку з повторним місцевим застосуванням DIC-DEA (як правило, двічі на день) ми перевірили просочування DIC-DEA після повторного застосування. Враховуючи обмеження, пов’язані з експериментом in vitro, ми застосовували 4 дози через кожні 12 годин та контролювали вміст DIC-DEA в акцепторі протягом 48 годин (рис. 1E-H). На відміну від разових доз багаторазове застосування кожні 12 годин призвело до майже лінійного зростання сукупного вмісту лікарського засобу в розчині акцептора. Олеїловий спирт і олеїнова кислота збільшували сукупну кількість –DIC-DEA в акцепторі в 2,7 раза (135 ± 46 мкг/см2) та в 3,1 раза (153 ± 31 мкг/см2) відповідно порівняно з конт–ролем (лише розчинник; 50 ± 24 мкг/см2). Кількість –DIC-DEA, виявлена в акцепторі через 24 години, відповідає 5,4; 14,5 та 16,5 % нанесеної дози (4 × 232 мкг/см2 DIC-DEA) у контрольному зразку та в зразках з олеїловим спиртом і олеїновою кислотою відповідно. Таким чином, вплив підсилювачів, що досліджуються, на просочування DIC-DEA після нанесення однієї та чотирьох доз на шкіру дуже схожий, без відмінностей між ними.
3.2. Олеїловий спирт має більш високий рівень утримання DIC-DEA, ніж олеїнова кислота, при одноразовому та багаторазовому нанесенні. Кількість DIC-DEA у шкірі через 24 години була більшою при спільному застосуванні з олеїловим спиртом, ніж при спільному застосуванні з олеїновою кислотою, як в епідермісі (9,58 ± 3,21 мкг/мг для олеїлового спирту та 6,16 ± 1,54 мкг/мг для олеїнової кислоти, рис. 1C), так і в дермі (1,15 ± 0,38 мкг/мг для олеїлового спирту та 0,62 ± 0,29 мкг/мг для олеїнової кислоти, рис. 1D). Таким чином, 61, 53 та 30 % дози DIC-DEA, нанесеної на шкіру, було виявлено в шкірі (епідерміс + дерма) після нанесення контролю, зразку олеїлового спирту та зразку олеїнової кислоти. Зокрема, олеїнова кислота знизила кількість DIC-DEA, що утримується у шкірі, порівняно з контрольною сумішшю розчинників.
Аналогічні результати було отримано після чотирьох доз. Кількість DIC-DEA у шкірі через 48 годин була більшою при спільному застосуванні з олеїловим спиртом, ніж при спільному застосуванні з олеїновою кислотою, як в епідермісі (16,7 ± 7,2 мкг/мг для олеїлового спирту та 8,1 ± 3,2 мкг/мг для олеїнової кислоти, рис. 1G), так і в дермі (1,00 ± 0,26 мкг/мг для олеїлового спирту та 0,62 ± 0,18 мкг/мг для олеїнової кислоти, рис. 1H). Таким чином, 14, 17 та 8 % дози DIC-DEA, нанесеної на шкіру, було виявлено в шкірі (епідерміс + дерма) після нанесення контролю, зразку олеїлового спирту та зразку олеїнової кислоти (чотири дози). Отже, багаторазове застосування збільшує кількість DIC-DEA, що досягає акцептора, але не призводить до значного зростання кількості, що утримується в шкірі.
Більш високе утримання DIC-DEA у шкірі під впливом олеїлового спирту порівняно з олеїновою кислотою потенційно може бути корисним, оскільки резервуар з препаратом, що утворюється у шкірі НПЗП для місцевого застосування, має важливе значення для стійкого, тривалого виділення препарату в підлеглі тканини [4, 32–34]. Звичайно, переведення до ситуації in vivo необхідно робити з обережністю, оскільки при експериментах in vitro завжди існуватиме проблема очищення у зв’язку з відсутністю мікроциркуляції. Через це багаторазове застосування дозволило нам отримати досить цікаві дані, оскільки концентрація препарату в шкірі залишалася майже такою ж, що й при одноразовому застосуванні, а зросла лише концентрація препарату у фазі акцептора. Відповідно, відносно великий об’єм акцептора з перемішуванням речовини, що дозволяє належним чином розчинити препарат, імовірно, забезпечить очищення шкіри (як мінімум часткове).
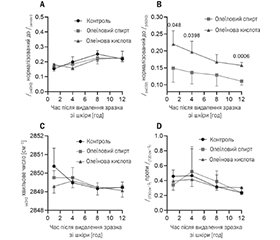
3.3. На відміну від олеїнової кислоти дія олеїлового спирту з підсилення просочування не має негативного впливу на TEWL та електричний опір шкіри. Після цього ми порівняли вплив олеїлового спирту та олеїнової кислоти (при 0,75 % щодо розчинника) на два показники цілісності шкірного бар’єра — трансепідермальну втрату води (TEWL; рис. 2A) та електричний опір шкіри (рис. 2C), а також оборотність зазначеного впливу (рис. 2B, D). При нанесенні на шкіру дози 10 мкл/см2 ці два методи були недостатньо чутливими для виявлення змін (кратна зміна близька до 1; дані не показано). Для виявлення відмінностей ми нанесли зразок у більшому об’ємі, ніж для експериментів з просочування (150 мкл/см2), на 24 години. Нам відомо, що така доза є надлишковою, але ми вважаємо застосування такої дози прийнятним для визначення потенційного ризику або для розмежування ефекту від двох препаратів. Потім ми видалили зразки (відповідно до попередньо затвердженої процедури [28]) та контролювали TEWL і опір протягом наступних 24 годин. Застосування олеїнової кислоти протягом 24 годин призвело до більшого зростання TEWL, ніж застосування олеїлового спирту або лише розчинника (рис. 2A). Після видалення зі шкіри всіх трьох зразків для місцевого застосування їх ефект був оборотним; тобто TEWL зменшувалась до значень, які можна порівняти з тими, що існували до застосування (рис. 2B). Олеїнова кислота мала значно більший вплив на електричний опір, ніж олеїловий спирт і контроль (рис. 2C), який не зник повністю через 24 години після видалення зразків зі шкіри (рис. 2D). Відповідно, при застосуванні олеїнової кислоти порушення шкірного бар’єра тривало (як мінімум частково) протягом кількох годин після припинення обробки.
/80.jpg)
3.4. Через 8 годин після нанесення олеїнова кислота (на відміну від олеїлового спирту) призводить до псевдозрідження ліпідів шкірного бар’єра, тоді як через 24 години основний механізм дії обох підсилювачів передбачає формування зон рідини. Для одночасного конт–ролю підсилювачів та порядку ланцюга ліпідів SC ми використовували дейтеровані підсилювачі. Олеїловий спирт-d33 було отримано з олеїнової кислоти-d34 шляхом відновлення LiAlH4 (рис. 3A) [35]. Слід відзначити, що перший атом вуглецю в олеїловому спирті-d33 не є дейтерованим, оскільки атоми водню надходять з LiAlH4; відповідно, обидва дейтеровані підсилювачі мають 33 зв’язки C-D. Ми наносили 0,75% розчини олеїнової кислоти-d34 та олеїлового спирту-d33 на шкіру та конт–ролювали їх ефект методом FTIR (після змивання та висушування поверхні шкіри). У межах першого експерименту FTIR використовувались зразки у дозі, що була для експерименту з просочування, тобто 10 мкл/см2 без оклюзії. Застосування було припинене через 8 годин (час, коли ми спостерігали ефект підсилення просочування виключно для олеїнової кислоти) та через 24 години (час, коли обидва підсилювачі мали однаковий вплив на трансдермальне просочування DIC-DEA).
Після застосування протягом 8 годин олеїнова кислота спричинила значне червоне зміщення позиції вібрації симетричного метиленового розтягування порівняно з контролем та олеїловим спиртом, що свідчить про псевдозрідження алкільних ланцюгів ліпідів SC (рис. 3B та S1A). Аналогічний результат було отримано при застосуванні асиметричного метиленового розтягування (додатковий рис. S2A). Хвильові числа метиленового розтягування, отримані при дослідженні шкіри, обробленої розчинником та олеїловим спиртом, аналогічні числам, отриманим перед застосуванням у межах даної конфігурації. Раніше повідомлялося про таке псевдозрідження під впливом олеїнової кислоти у поверхневих шарах SC [12] та модельних моношарах ліпідів SC [10]. Знижену пропорцію кристалічних ліпідів також було виявлено у модельних ліпідах SC методом твердотільної 2H NMR [11]. Mak et al. повідомляли про псевдозрідження ланцюгів ліпідів у поверхневих шарах SC через 0,5 години після нанесення 1% олеїнової кислоти в етанолі, що поширювалося на більш глибокі шари протягом 1,5 години [14]. З іншого боку, Ongpipattanakul et al. виявили, що олеїнова кислота підвищує конформаційну свободу ліпідів SC виключно при температурі, що перевищує їх температуру переходу [13, 36].
Через 24 години після нанесення позиція вібрації метиленового розтягування була практично ідентичною для всіх трьох нанесених речовин (рис. 3C та S1B). Аналогічний результат було отримано при застосуванні асиметричного метиленового розтягування (додатковий рис. S2B). Співвідношення значень інтенсивності вібрації симетричного метиленового розтягування та вібрації аміду I при обробці різними речовинами також було близьким (аналогічний результат було отримано при застосуванні більш високих доз підсилювачів, рис. 4A), що свідчить про те, що застосування зразків 10 мкл протягом 24 годин не викликає значної екстракції ліпідів з SC. Ми спостерігали слабкі вібрації дейтерованих підсилювачів в зоні розтягування CD2, при хвильових числах, що відповідають їх рідкій формі (аналогічний результат було отримано при більш високих дозах підсилювачів, див. нижче та додатковий рис. S3). Таким чином, очевидно, що основним механізмом дії двох підсилювачів через 24 години після нанесення є формування зон рідини в ліпідах SC. Таке розділення фаз відповідає попереднім повідомленням щодо дії олеїнової кислоти [11–13]. У зв’язку з дуже низькою інтенсивністю зазначених вібрацій CD2 ми не намагалися їх додатково аналізувати. Для цього ми провели інший експеримент, у межах якого збільшили дозу, що застосовується.
/81.jpg)
3.5. Відносна кількість олеїнової кислоти в ліпідах SC вища, ніж відносна кількість олеїлового спирту, навіть через 12 годин після видалення з поверхні шкіри. Для додаткової характеристики взаємодії двох підсилювачів з ліпідами бар’єра SC ми нанесли на поверхню шкіри олеїловий спирт, олеїнову кислоту та розчинник у тих же кількостях, які ми використовували при дослідженні їх впливу на TEWL та електричний опір (150 мкл/см2). Речовини було нанесено на 24 години, після чого розчини обережно видаляли, поверхню шкіри сушили ватним диском та отримували спектри FTIR через 1, 4, 8 та 12 годин (рис. 4 та S3). Відповідно до вищеза–значених результатів FTIR ми не спостерігали відмінностей у відносному співвідношенні ліпідів та білків (рис. 4A), ланцюговій конформації ліпідів SC (рис. 4C та S4) та відносному вмісті орторомбічної фази з жорсткими, щільно упакованими ланцюгами (рис. 4D). Однак спостерігалася статистично значуща різниця між відносним вмістом підсилювачів у ліпідах SC (рис. 4B), визначеним як співвідношення значень інтенсивності симетричних вібрацій розтягування CD2 та CH2. Хвильові числа вібрацій CD2 (приблизно 2097 –см–1) були практично аналогічні числам чистої олеїнової кислоти та чистого олеїлового спирту, що підтверджує відокремлення фази зазначених підсилювачів та формування зон рідини з високим вмістом підсилювачів.
/82.jpg)
Такі невпорядковані зони з високим вмістом підсилювачів забезпечують можливість більш легкого просочування ліків порівняно з нативними ліпідами SC як через самі зони, так і через їх зв’язки із сусідніми ліпідами. Дані на рис. 4B свідчать про те, що відносна частка зон рідини, що формуються олеїновою кислотою, більша, ніж аналогічний показник олеїлового спирту. На рис. 4B також показано, що підсилювачі повільно вимиваються з SC після припинення застосування, а відносна концентрація олеїнової кислоти в ліпідах вища, ніж відносна концентрація олеїлового спирту, що може бути поясненням того, що вплив олеїнової кислоти на електричний опір не є повністю оборотним (на відміну від олеїлового спирту).
4. Висновки
Олеїнова кислота та олеїловий спирт широко використовуються як підсилювачі просочування/проникнення через шкіру в лікарських засобах для місцевого застосування. Відповідно, детальне розуміння їх механізмів дії та впливу на функцію шкірного бар’єра має важливе значення для вибору між ними на ранніх етапах розробки лікарських засобів місцевого застосування. Хоча у літературі є багато повідомлень щодо кожного з цих підсилювачів, ці дані складно порівняти, оскільки їх було отримано за різних умов. У межах цього дослідження вперше здійснено порівняння способів дії та оборотності впливу олеїнової кислоти й олеїлового спирту на функцію шкірного бар’єра в комерційних концентраціях. Окрім того, ми вперше порівняли безпосередньо два підсилювачі у дейтерованій формі, що дозволило нам розмежувати спектральні сигнатури ліпідів шкіри та ланцюгів підсилювача.
У межах цього дослідження було показано, що дія олеїлового спирту і олеїнової кислоти та їх взаємодія з бар’єром людської шкіри відрізняються за кількома важливими параметрами, при цьому ці відмінності залежать від часу. Пермеабілізація шкіри під впливом олеїнової кислоти відбувається швидше, ніж під впливом олеїлового спирту, імовірно, у зв’язку з початковим псевдозрідженням ліпідів SC олеїновою кислотою. Через 12–24 години псевдозрідження ліпідів не спостерігається, обидва підсилювачі формують окремі зони рідини в ліпідах шкірного бар’єра, а їх вплив на просочування DIC-DEA є ідентичним, незважаючи на те, що відносне утримання олеїлового спирту в ліпідах SC є нижчим, ніж аналогічний показник олеїнової кислоти. Що важливо, в межах експерименту з одноразовим застосуванням вдалося досить добре спрогнозувати результат повторного застосування (4 дози з інтервалом у 12 годин); тобто вдалося спрогнозувати, що олеїловий спирт і олеїнова кислота підвищують просочування DIC-DEA через шкіру приблизно однаково (майже у 3 рази), а утримання DIC-DEA у шкірі при застосуванні олеїнової кислоти є нижчим, ніж при застосуванні олеїлового спирту.
Що стосується підсилювачів, утримання DIC-DEA у шкірі через 24 години для олеїлового спирту є вищим, ніж для олеїнової кислоти. Більш високий вміст олеїнової кислоти, що утримується в SC (порівняно з олеїловим спиртом), зберігається протягом як мінімум 12 годин після видалення підсилювача з поверхні шкіри, а її негативний вплив на показники цілісності шкірного бар’єра (TEWL та електричний опір) не є повністю оборотним. Такі зміни у бар’єрі несуть у собі невід’ємний ризик втрати ендогенних речовин тіла, порушення гомеостазу епідермісу або просочування речовин із зовнішнього середовища та їх небажаної взаємодії в тілі.
Таким чином, олеїловий спирт відкриває шкірний бар’єр достатньо для проникнення лікарського засобу через шкіру в досить великих кількостях без тривалого негативного впливу на цілісність шкірного бар’єра. Вибір підсилювача з більш м’якою дією має важливе значення при багаторазовому застосуванні лікарського засобу місцево, особливо для ніжної шкіри.
Хоча ми використовували DIC-DEA як репрезентативний препарат для місцевого застосування, отримані нами результати є актуальними для інших препаратів для місцевого застосування, якщо полегшення їх просочування через шкірний бар’єр сприяло б їх застосуванню. Більш глибоке розуміння взаємодії допоміжних речовин препаратів місцевого застосування зі шкірою та їх захисних функцій має важливе значення для розумного вибору препаратів для місцевого застосування у майбутньому.
Інформація про авторів
Відповідальний автор
Katerina Vávrová — група дослідження шкірного бар’єра, Карлів університет, фармацевтичний факультет у Hradec Králové, 50005 Hradec Králové, Чеська Республіка; ID orcid.org/0000-0002-г8502-4372; е-mail: katerina.vavrova@faf.cuni.cz
Автори
Andrej Kováčik — група дослідження шкірного бар’єра, Карлів університет, фармацевтичний факультет у Hradec Králové, 50005 Hradec Králové, Чеська Республіка; ID orcid.org/0000-0002-5597-3155
Monika Kopečná — група дослідження шкірного бар’єра, Карлів університет, фармацевтичний факультет у Hradec Králové, 50005 Hradec Králové, Чеська Республіка
Iva Hrdinová — група дослідження шкірного бар’єра, Карлів університет, фармацевтичний факультет у Hradec Králové, 50005 Hradec Králové, Чеська Республіка
Lukáš Opálka — група дослідження шкірного бар’єра, Карлів університет, фармацевтичний факультет у Hradec Králové, 50005 Hradec Králové, Чеська Республіка
Mila Bončheva Bettex — HALEON CH SARL, Nyon 1260, Швейцарія
Повна контактна інформація доступна за адресою: https://pubs.acs.org/10.1021/acs.molpharmaceut.3c00648.
Внесок авторів. K.V. та M.B.B. розробили це дослідження. A.K., M.K. та I.H. провели дослідження просочування та оборотності. L.O. синтезував дейтерований олеїловий спирт. A.K. та I.H. зібрали та проаналізували інфрачервоні спектри. A.K. підготував зображення. K.V. проаналізувала дані та написала статтю разом з усіма іншими авторами.
Примітки. Автори заявляють про наявність таких конкурентних фінансових інтересів: фінансову підтримку дослідження було забезпечено Haleon Czech Republic s.r.o.
Подяка. Автори висловлюють подяку Zuzana Országhová з Haleon Czech Republic s.r.o. за пропозицію щодо порівняльного дослідження. Вони також висловлюють подяку доктору Robert Cáp з хірургічного центру Sanus за надання тканини шкіри від людей-донорів. I.H. отримала часткову підтримку від Карлового університету (SVV 260 661), а K.V. — від EFSA-CDN No. CZ.02.1.01/0.0/0.0/16_019/ 0000841, що фінансується Європейським Союзом.
Скорочення. DIC — диклофенак; DIC-DEA — диклофенаку діетиламін; SC — роговий шар; TEWL — трансепідермальна втрата води; FTIR — інфрачервона Фур’є-спектроскопія з перетворенням; ВЕРХ — високоефективна рідинна хроматографія; PBS — фосфатний буферний розчин.
/76.jpg) Основною перешкодою для ефективного місцевого (і трансдермального) введення лікарських засобів є зовнішній шар шкіри — роговий шар (SC), зокрема його позаклітинний ліпідний матрикс з високою гідрофобністю. Відповідно, методи поліпшення місцевого або трансдермального введення лікарських засобів, як-от хімічні підсилювачі просочування (інші назви — підсилювачі проникнення, каталізатори, промотори всмоктування), впливають на ці високовпорядковані та щільні ліпіди (в ідеалі — оборотно) [7–9]. Олеїнова кислота та олеїловий спирт — це два підсилювачі, що були ретельно вивчені та комерційно використовуються для місцевого введення лікарських засобів [10–20]. Олеїнова кислота — це мононенасичена ω-9 жирна кислота, що природно міститься у багатьох рослинних оліях, зокрема в оливковій олії, а олеїловий спирт — це жирний спирт, що отримується з олеїнової кислоти (pис. 1). Обидва підсилювачі мають однаковий 18-вуглецевий ланцюг з цис-подвійним зв’язком посередині, що спричиняє характерний злам ланцюга, який не допускає ефективного пакування ланцюга та забезпечує їх рідкий стан при кімнатній температурі (точки плавлення 13 °C для олеїнової кислоти та 5 °C для олеїлового спирту). Обидва вони також є високоліпофільними (log P > 7) та спорідненими з ліпідами рогового шару шкіри. Вони відрізняються за структурою полярної голови, карбоксильною функцією (олеїнова кислота) та гідроксильною функцією (олеїловий спирт). Карбоксил є більш об’ємним, ніж гідроксил, формує більше водневих зв’язків та може бути іонізований до негативно зарядженого карбоксилату при фізіологічно відповідних значеннях pH. Повідомлялося, що олеїнова кислота призводить до порушення структури ліпідів SC та/або формує дискретні зони, що сприяють просочуванню лікарських засобів [10–16]. Також повідомлялося про наявність більшої кількості рідинних ланцюгів у шкірі, обробленій олеїловим спиртом [21]. Повідомлялося про подразнення шкіри при застосуванні олеїнової кислоти 4,5–10% [16, 22, 23], тоді як застосування олеїлового спирту до 10 % не призвело до помітних змін у гістологічній структурі оголеної шкіри мишей [23].
Основною перешкодою для ефективного місцевого (і трансдермального) введення лікарських засобів є зовнішній шар шкіри — роговий шар (SC), зокрема його позаклітинний ліпідний матрикс з високою гідрофобністю. Відповідно, методи поліпшення місцевого або трансдермального введення лікарських засобів, як-от хімічні підсилювачі просочування (інші назви — підсилювачі проникнення, каталізатори, промотори всмоктування), впливають на ці високовпорядковані та щільні ліпіди (в ідеалі — оборотно) [7–9]. Олеїнова кислота та олеїловий спирт — це два підсилювачі, що були ретельно вивчені та комерційно використовуються для місцевого введення лікарських засобів [10–20]. Олеїнова кислота — це мононенасичена ω-9 жирна кислота, що природно міститься у багатьох рослинних оліях, зокрема в оливковій олії, а олеїловий спирт — це жирний спирт, що отримується з олеїнової кислоти (pис. 1). Обидва підсилювачі мають однаковий 18-вуглецевий ланцюг з цис-подвійним зв’язком посередині, що спричиняє характерний злам ланцюга, який не допускає ефективного пакування ланцюга та забезпечує їх рідкий стан при кімнатній температурі (точки плавлення 13 °C для олеїнової кислоти та 5 °C для олеїлового спирту). Обидва вони також є високоліпофільними (log P > 7) та спорідненими з ліпідами рогового шару шкіри. Вони відрізняються за структурою полярної голови, карбоксильною функцією (олеїнова кислота) та гідроксильною функцією (олеїловий спирт). Карбоксил є більш об’ємним, ніж гідроксил, формує більше водневих зв’язків та може бути іонізований до негативно зарядженого карбоксилату при фізіологічно відповідних значеннях pH. Повідомлялося, що олеїнова кислота призводить до порушення структури ліпідів SC та/або формує дискретні зони, що сприяють просочуванню лікарських засобів [10–16]. Також повідомлялося про наявність більшої кількості рідинних ланцюгів у шкірі, обробленій олеїловим спиртом [21]. Повідомлялося про подразнення шкіри при застосуванні олеїнової кислоти 4,5–10% [16, 22, 23], тоді як застосування олеїлового спирту до 10 % не призвело до помітних змін у гістологічній структурі оголеної шкіри мишей [23]./80.jpg)
/82.jpg)

/79.jpg)
/81.jpg)