Журнал "Гастроэнтерология" Том 57, №1, 2023
Вернуться к номеру
Оцінка стану мікрофлори товстого кишечника у хворих на неалкогольну жирову хворобу печінки з імунною відповіддю на SARS-CoV-2
Авторы: Степанов Ю.М., Діденко В.І., Кленіна І.А., Татарчук О.М., Вішнаревська Н.С., Петішко О.П.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
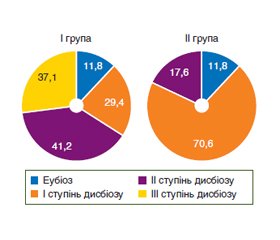
Актуальність. Поширеність неалкогольної жирової хвороби печінки (НАЖХП) на сьогодні зростає в усьому світі та становить серйозну проблему, що обумовлює цікавість до її вивчення, особливо у хворих з імунною відповіддю на SARS-CoV-2. Дослідження останніх років присвячені вивченню впливу мікрофлори на розвиток та прогресування НАЖХП. Мета: визначити рівень дисбіотичних порушень мікробіоценозу товстої кишки у хворих на НАЖХП з імунною відповіддю на SARS-CoV-2. Матеріали та методи. Обстежено 34 хворі на НАЖХП, у яких виявлено IgG до SARS-CoV-2. Усі обстежені хворі були розподілені на дві групи: І групу становили 17 пацієнтів, у яких в анамнезі не виявлений SARS-CoV-2 за даними ПЛР; ІІ — 17 хворих, у яких в анамнезі був виявлений SARS-CoV-2 за даними ПЛР. Контрольну групу становили 10 практично здорових осіб. Проводили хроматографічне визначення вмісту коротколанцюгових жирних кислот, видового та кількісного складу мікрофлори товстої кишки. Результати. Проведені мікробіологічні дослідження виявили наявність змін якісного та кількісного складу мікрофлори товстої кишки у 88,2 % хворих на НАЖХП, з переважанням дисбіозу ІІ у 41,2 % хворих І групи та дисбіозу І у 70,6 % хворих ІІ групи. Ці зміни були обумовлені зменшенням кількості біфідо- та лактофлори, підвищенням концентрації умовно-патогенних мікроорганізмів, грибів роду Candida spp. Мікробіом кишечника пацієнтів з НАЖХП, які перенесли SARS-CоV-2, показав порушення біосинтезу КЛЖК у копрофільтраті, що проявлялося у підвищенні медіани оцтової та пропіонової кислот та зниженні медіани масляної кислоти у пацієнтів І групи. Медіана анаеробного індексу (АІ) мала статистично вірогідне зниження у пацієнтів І групи в 1,5 раза (р < 0,05) та тенденцію до зниження у пацієнтів ІІ групи. Виявлено вірогідні міжгрупові відмінності АІ, медіана якого в 1,4 раза була вищою в ІІ групі (р < 0,05) порівняно з І групою. Висновки. Встановлено зниження рівня представників нормофлори, підвищення умовно-патогенних мікроорганізмів, тенденцію до зниження концентрації масляної кислоти, підвищення оцтової та пропіонової кислот в калі пацієнтів з НАЖХП, які перенесли SARS-CоV-2.
Background. The prevalence of non-alcoholic fatty liver disease (NAFLD) is currently increasing worldwide and is a serious problem that causes interest in its study, especially in patients with an immune response to severe acute respiratory syndrome-related coronavirus 2 (SARS-CoV-2). In recent years, studies have been investigating the influence of microflora on the development and progression of NAFLD. The purpose of the study was to determine the level of dysbiotic disorders of the colonic microbiocenosis in patients with NAFLD with an immune response to SARS-CoV-2. Materials and methods. We examined 34 patients with NAFLD who were found to have IgG to SARS-CoV-2. All examined patients were divided into two groups: group I consisted of 17 patients with no history of SARS-CoV-2 according to the polymerase chain reaction (PCR) data; group II — 17 patients with a history of SARS-CoV-2 by PCR. The control group consisted of 10 practically healthy individuals. Chromatographic determination of the content of short-chain fatty acids, species and quantitative composition of the colonic microflora was performed. Results. The microbiological studies revealed changes in the qualitative and quantitative composition of the colonic microflora in 88.2 % of patients with NAFLD, with a predominance of dysbiosis II in 41.2 % of patients in group I and dysbiosis I in 70.6 % of patients in group II. These changes were due to a decrease in the number of bifidobacteria and lactobacilli, an increase in the concentration of opportunistic pathogens, fungi of the genus Candida spp. The intestinal microbiome of patients with NAFLD who had SARS-CoV-2 showed impaired biosynthesis of short-chain fatty acids in the coprofiltrate, which was manifested by an increase in the median acetic and propionic acids and a decrease in the median butyric acid in patients of group I. The median anaerobic index had a statistically significant decrease in patients of group I by 1.5 times (p < 0.05) and a tendency to a decrease in patients of group II. Significant intergroup differences were found for anaerobic index, its median was 1.4 times higher in group II (p < 0.05) compared with group I. Conclusions. A decrease in the level of normoflora representatives, an increase in opportunistic pathogens, a tendency to a decrease in the concentration of butyric acid, an increase in acetic and propionic acids in the feces were found in patients with NAFLD who had SARS-CoV-2.
неалкогольна жирова хвороба печінки, COVID-19, мікробіота товстої кишки, коротколанцюгові жирні кислоти.
non-alcoholic fatty liver disease; COVID-19; colonic microbiota; short-chain fatty acids
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Prospective evaluation of a primary care referral pathway for patients with non-alcoholic fatty liver disease / A. Srivastava et al. Hepatol. 2019. Vol. 71. № 2. P. 371-378.
- Younossi Z.M. Non-Alcoholic Fatty Liver Disease — A Global Public Health Perspective. J Hepatol. 2019. Vol. 70. № 3. P. 531-544.
- High Prevalence of Liver Fibrosis Among European Adults With Unknown Liver Disease: A Population-Based Study / L. Caballería et al. Clin Gastroenterol Hepatol. 2018. Vol. 16. № 7. P. 1138-1145.e5.
- Assay Validation and Clinical Performance of Chronic Inflammatory and Chemokine Biomarkers of NASH Fibrosis / S. Kar et al. PloS One. 2019. Vol. 14. № 7. P. 1-14.
- Assessment of the intestinal microbiota and fecal short-chain fatty acids content in children with non-alcoholic fatty liver disease / N.Yu. Zavhorodnia et al. Gastroenterology. 2020. Vol. 54. № 1. P. 68-74.
- Завгородня Н.Ю., Лук’яненко О.Ю., Коненко І.С. Стан панкреатобіліарної системи та інтестинальної мікрофлори в дітей із неалкогольною жировою хворобою печінки. Гастроентерологія. 2016. Т. 62. № 4. С. 37-42.
- Сірчак Є.С., Грига В.І., Петричко О.І., Пічкар Й.І. Ефективність використання Bifidobacterium infantis 35624 для лікування хворих на неалкогольну жирову хворобу печінки. Гастроентерологія. 2020. Т. 54. № 1. С. 8-17.
- Фадеенко Г.Д., Соломенцева Т.А. Возможности немедикаментозной коррекции кишечной микробиоты у больных неалкогольной жировой болезнью печени. Сучасна гастроентерологія. 2020. № 5. С. 71-78.
- The role of gut microbiota in non-alcoholic fatty liver disease: Pathways of mechanisms / C. Jasirwan et al. Biosci Microbiota Food Health. 2019. Vol. 38. № 3. P. 81-88.
- Chu H., Duan Y., Yang L., Schnabl B. Small metabolites, possible big changes: a microbiota-centered view of non-alcoholic fatty liver disease. Gut. 2019. Vol. 68. № 2. P. 359-370.
- Prolonged Impairment of Short-Chain Fatty Acid and L-Isoleucine Biosynthesis in Gut Microbiome in Patients With COVID-19 / F. Zhang et al. Gastroenterology. 2022. Vol. 162. № 2. P. 548-561.e4.
- Critical appraisal of the mechanisms of gastrointestinal and hepatobiliary infection by COVID-19 / E. Levy et al. Am J Physiol Gastrointest Liver Physiol. 2021. Vol. 321. № 2. P. G99-G112.
- Potential effects of SARS-CoV-2 on the gastrointestinal tract and liver / H.Y. Lei et al. Biomed Pharmacother. 2021. № 133. P. 111064.
- COVID-19: A Multidisciplinary Review / N. Chams et al. Front Public Health. 2020. № 8. P. 383.
- Lost microbes of COVID-19: Bifidobacterium, Faecalibacterium depletion and decreased microbiome diversity associated with SARS-CoV-2 infection severity / S. Hazan et al. BMJ Open Gastroenterol. 2022. Vol. 9. № 1. P. e000871.
- Ahlawat S., Asha, Sharma K.K. Immunological coordination between gut and lungs in SARS-CoV-2 infection. Virus Res. 2020. № 286. P. 198103.
- Follmer C. Viral Infection-Induced Gut Dysbiosis, Neuroinflammation, and α-Synuclein Aggregation: Updates and Perspectives on COVID-19 and Neurodegenerative Disorders. ACS Chem Neurosci. 2020. Vol. 24. № 11. P. 4012-4016.
- Janda L., Mihalčin M., Šťastná M. Is a healthy microbiome responsible for lower mortality in COVID-19? Biologia (Bratisl). 2021. Vol. 76. № 2. P. 819-829.
- Probiotics at War Against Viruses: What Is Missing From the Picture? / S.K. Tiwari et al. Front Microbiol. 2020. № 11. P. 1877.
- Sajdel-Sulkowska E.M. Neuropsychiatric Ramifications of COVID-19: Short-Chain Fatty Acid Deficiency and Disturbance of Micro–biota-Gut-Brain Axis Signaling. Biomed Res Int. 2021. № 2021. P. 7880448.
- Włodarczyk J., Czerwiński B., Fichna J. Short-chain fatty acids-microbiota crosstalk in the coronavirus disease (COVID-19). Pharmacol. Rep. 2022. Vol. 74. № 6. P. 1198-1207.
- Zhang C., Shi L., Wang F.S. Liver injury in COVID-19: ma–nagement and challenges Lancet Gastroenterol. Hepatol. 2020. Vol. 5. № 5. P. 428-430.
- Патогенетичні аспекти впливу надлишкового бактеріального росту на метаболізм жирних кислот у хворих на хронічні дифузні захворювання печінки / Ю.М. Степанов та ін. Сучасна гастроентерологія. 2019. № 6(110). С. 21-27.
- Safari Z., Gérard P. The links between the gut microbiome and non-alcoholic fatty liver disease (NAFLD). Cell. Mol. Life Sci. 2019. № 76. P. 1541-1558.