Журнал «Боль. Суставы. Позвоночник» Том 12, №4, 2022
Вернуться к номеру
Вивчення безпечності та ефективності ородиспергуючої форми мелоксикаму (Мовіксикам® ОДТ) у хворих з болем у нижній частині спини
Авторы: Бистрицька М.А., Мусієнко А.С., Заверуха Н.В., Солоненко Т.Ю., Григор’єва Н.В.
ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України», м. Київ, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
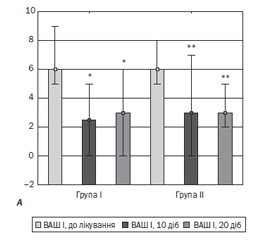
Актуальність. Застосування нестероїдних протизапальних засобів є невід’ємною частиною лікування болю в нижній частині спини (БНС). Одним із шляхів його удосконалення є розробка новітніх форм відомих засобів. Метою дослідження було вивчення ефективності та безпечності ородиспергуючої форми мелоксикаму (Мовіксикам® ОДТ, компанії «Мові Хелс») у пацієнтів з БНС на тлі дегенеративно-дистрофічних змін хребта порівняно з таблетованою формою мелоксикаму. Матеріали та методи. Обстежено 40 жінок віком 50–75 років з БНС, які приймали мелоксикам у дозі 15 мг 1 раз на добу 10 діб: І група — ородиспергуючу форму мелоксикаму (Мовіксикам® ОДТ); ІІ група — таблетовану форму. Обстеження проводили перед початком терапії, на 10-ту добу лікування та на 10-ту добу після завершення лікування. Результати. Застосування обох препаратів виявилося безпечним, проте через 20 діб рівні АЛТ та АСТ у пацієнтів, які приймали Мовіксикам® ОДТ, були вірогідно нижчими, ніж у групі ІІ. Інтенсивність БНС вірогідно зменшувалась у двох групах вже через 3 доби терапії й залишалася нижчою через 10 діб після її завершення. У І групі біль знижувався швидше. У першу добу лікування вже через годину після вживання Мовіксикаму® ОДТ біль у пацієнтів групи І був вірогідно менш вираженим (t = 2,18, p = 0,03), ніж у групі ІІ. Обмеження життєдіяльності за даними опитувальників Роланда — Морріса та Освестрі, якість життя за опитувальником EuroQul 5D вірогідно поліпшувалися в обох групах під впливом лікування без відмінностей між групами. Жодних побічних ефектів чи небажаних явищ під час лікування зафіксовано не було. Висновки. Застосування мелоксикаму в лікуванні пацієнтів з БНС є ефективним та безпечним, проте у разі застосування ородиспергуючої форми виявилось більш безпечним щодо печінки, рівні АЛТ та АСТ у пацієнтів, які приймали Мовіксикам® ОДТ, були вірогідно нижчими, ніж у групі ІІ, що приймала таблетований мелоксикам. Знеболювання настає швидше, і вже за годину після прийому препарату зафіксоване вірогідно більш виражене зниження інтенсивності больового синдрому.
Background. The use of non-steroidal anti-inflammatory drugs is an integral part of the treatment of lower back pain (LBP). One of the ways of its improvement is the development of the newest forms of known agents. The aim of the study was to evaluate the effectiveness and safety of the orodispersible form of meloxicam (Movixicam® ODT, Movi Health) in patients with LBP against the background of osteoarthritis of the spine in comparison with meloxicam tablets. Materials and methods. Forty women aged 50–75 years with LBP were examined, they received meloxicam at a dose of 15 mg once a day for 10 days: group I — orodispersible form of meloxicam (Movixicam® ODT); group II — tablet form. Examinations were carried out before the therapy, on the tenth day of treatment and 10 days after the end of treatment. Results. The use of both drugs proved to be safe, but after 20 days, the levels of alanine aminotransferase and aspartate aminotransferase in patients taking Movixicam® ODT were significantly lower than in group II. The severity of LBP reduced significantly in both groups after three days of therapy and remained lower 10 days after its completion. In group I, the pain decreased faster. On the first day of treatment, already one hour after taking Movixicam® ODT, the pain in patients of group I was significantly lower (t = 2.18, p = 0.03) than in group II. Functional limitations according to the Roland-Morris Disability Questionnaire and Oswestry Disability Index, quality of life indices according to the EuroQol 5D questionnaire were significantly improved in both groups under the influence of treatment, without differences between groups. No side effects or adverse events were recorded during the therapy. Conclusions. The use of meloxicam in the treatment of patients with LBP is effective and safe; however, in case of using the orodispersible form, it turned out to be safer for the liver, the levels of alanine aminotransferase and aspartate aminotransferase in patients who took Movixicam® ODT were significantly lower than in group II, which took meloxicam tablets. Аnalgesia occurs faster, and already one hour after taking the drug, a significantly more pain decrease was recorded in group I compared to group II.
біль у нижній частині спини; мелоксикам; ородиспергуюча таблетка
lower back pain; meloxicam; orodispersible tablet
Вступ
Матеріали та методи
Результати
/44.jpg)
Обговорення
Висновки
- Williamson O.D., Cameron P. The global burden of low back pain. In: Int. Assoc. study pain. 2021. Режим доступу: https://www.iasp-pain.org/resources/fact-sheets/the-global-burden-of-low-back-pain.
- Kopec J.A., Sayre E.C., Cibere J., Li L.C., Wong H., Okhmatovskaia A., Esdaile J.M. Reducing the burden of low back pain: results from a new microsimulation model. BMC Musculoskelet. Disord. 2022 Aug 23. 23(1). 804. doi: 10.1186/s12891-022-05747-2. PMID: 35996103; PMCID: PMC9396830.
- Kikuchi S. The Recent Trend in Diagnosis and Treatment of Chronic Low Back Pain. Spine Surg. Relat. Res. 2017 Dec 20. 1(1). 1-6. doi: 10.22603/ssrr.1.2016-0022. PMID: 31440605; PMCID: PMC6698534.
- WHO global strategy on people-centred and integrated health services: interim report. World Health Organization. Режим доступу: https://apps.who.int/iris/handle/10665/155002.
- van der Gaag W.H., Roelofs P.D., Enthoven W.T., van Tulder M.W., Koes B.W. Non-steroidal anti-inflammatory drugs for acute low back pain. Cochrane Database Syst. Rev. 2020 Apr 16. 4(4). CD013581. doi: 10.1002/14651858.CD013581. PMID: 32297973; PMCID: PMC7161726.
- Low back pain. In: NIH National Institute of Neurological Disorders and Stroke. 2020. Режим доступу: https://www.ninds.nih.gov/health-information/patient-caregiver-education/fact-sheets/low-back-pain-fact-sheet.
- Guidance for Industry Orally Disintegrating Tablets. Fed. Regist. 2008. Режим доступу: https://www.federalregister.gov/documents/2008/12/16/E8-29688/guidance-for-industry-on-orally-disintegrating-tablets-availability.
- Ghourichay M.P., Kiaie S.H., Nokhodchi A., Javadzadeh Y. Formulation and Quality Control of Orally Disintegrating Tablets (ODTs): Recent Advances and Perspectives. Biomed. Res. Int. 2021 Dec 24. 2021. 6618934. doi: 10.1155/2021/6618934. PMID: 34977245; PMCID: PMC8719989.
- Wang C., Hu S., Sun C.C. Expedited Development of Diphenhydramine Orally Disintegrating Tablet through Integrated Crystal and Particle Engineering. Mol. Pharm. 2017 Oct 2. 14(10). 3399-3408. doi: 10.1021/acs.molpharmaceut.7b00423. Epub 2017 Sep 6. PMID: 28825961.
- Guhmann M., Preis M., Gerber F., Pöllinger N., Breitkreutz J., Weitschies W. Design, development and in-vitro evaluation of diclofenac taste-masked orodispersible tablet formulations. Drug Dev. Ind. Pharm. 2015 Apr. 41(4). 540-51. doi: 10.3109/03639045.2014.884122. Epub 2014 Feb 5. PMID: 24495274.
- Chinwala M. Recent Formulation Advances and Therapeutic Usefulness of Orally Disintegrating Tablets (ODTs). Pharmacy (Basel). 2020 Oct 10. 8(4). 186. doi: 10.3390/pharmacy8040186. PMID: 33050437; PMCID: PMC7712969.
- Dehghani H., Taheri A., Homayouni A. Design, Optimization and Evaluation of Orally Disintegrating Tablet of Meloxicam Using Its Menthol Based Solid Dispersions. Curr. Drug Deliv. 2017. 14(5). 709-717. doi: 10.2174/1567201813666160504100532. PMID: 27142108.
- Svedlund J., Sjödin I., Dotevall G. GSRS — a clinical rating scale for gastrointestinal symptoms in patients with irritable bowel syndrome and peptic ulcer disease. Dig. Dis. Sci. 1988 Feb. 33(2). 129-34. doi: 10.1007/BF01535722. PMID: 3123181.
- Panchyshyn Y.M., Osiik I.M. Нестероїдні протизапальні препарати: відомі та нові проблеми. Racion Pharmakother. 2014. 4. 15-18.
- Орос М.М., Кошмякова Т.В. Таблетка чи ін’єкція: що та коли краще? Здоров’я України. 2021. № 1(494). С. 41-42.
- Ozyılmaz D.E., Pozharani L., Alhadi M., Ochany A.E. Orally Disintegrating Tablets: A Short Review. EMUJ Pharm. Sci. 2018. 3. 76-82. doi: 10.15744/2348-9782.3.303.
- McLaughlin R., Grother L., Bayru M. Orally disintegrating tablets: A dosage form designed for difficult patient populations. Am. Pharm. Rev. 2016. December 1. Режим доступу: https://www.americanpharmaceuticalreview.com/
- Featured-Articles/331620-Orally-Disintegrating-Tablets-A-Dosage-Form-Designed-for-Difficult-Patient-Populations.
- Aghazadeh-Habashi A., Jamali F. Pharmacokinetics of meloxicam administered as regular and fast dissolving formulations to the rat: influence of gastrointestinal dysfunction on the relative bioavailability of two formulations. Eur. J. Pharm. Biopharm. 2008 Nov. 70(3). 889-94. doi: 10.1016/j.ejpb.2008.07.013. Epub 2008 Jul 31. PMID: 18715548.
- Шуба Н.М., Воронова Т.Д., Крилова А.С. Порівняльна оцінка ефективності ородиспергуємого мелоксикаму з пероральною формою мелоксикаму у хворих із синдромом болю в нижній частині спини. Здоров’я України. 2017. № 18(415). С. 6-7.

/42.jpg)
/43.jpg)
/44_2.jpg)
/45.jpg)