Международный эндокринологический журнал Том 18, №5, 2022
Вернуться к номеру
Вплив вітаміну D на рівень BDNF у сироватці крові у пацієнтів з гіпотиреозом, спричиненим автоімунним тиреоїдитом
Авторы: Камишна І.І.
Тернопільський національний медичний університет імені І.Я. Горбачевського, м. Тернопіль, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
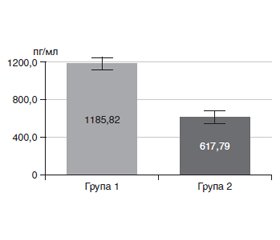
Актуальність. Тиреоїдит Хашимото — хронічне автоімунне захворювання щитоподібної залози (ЩЗ), спричинене підвищенням тиреоїдних антитіл. Зростаюча кількість досліджень свідчить про те, що пацієнти з тиреоїдитом Хашимото можуть страждати від когнітивних порушень. Тому важливо визначити фактори ризику, що сприяють розвитку когнітивних порушень у пацієнтів з автоімунним тиреоїдитом з метою їх ранньої діагностики та лікування. З огляду на те, що вплив гормонів щитоподібної залози на мозок є незаперечним, а їх нестача призводить до різноманітних неврологічних ускладнень, рання діагностика та лікування неврологічних порушень при тиреоїдних захворюваннях мають вирішальне значення для запобігання подальшому прогресуванню цих ускладнень. Мета дослідження — встановити вплив вітаміну D на рівень brain-derived neurotrophic factor (BDNF, нейротрофічний фактор мозку) у сироватці крові у пацієнтів з гіпотиреозом, спричиненим автоімунним тиреоїдитом (АІТ). Матеріали та методи. У дослідження було включено 28 пацієнтів з гіпотиреозом, спричиненим АІТ. Рівень BDNF у сироватці крові пацієнтів визначали кількісно за допомогою твердофазного імуноферментного аналізу з високочутливим Human BDNF (Brain Derived Neurotrophic Factor) ELISA Kit (Elabscience®, United States, Catalog No: E-EL-H0010) on E.I.A. Reader Sirio S (Seac, Italy). Результати. У нашому дослідженні призначення вітаміну D та L-тироксину призводило до зростання рівня BDNF в 7,4 раза (p < 0,001). У групі хворих, які приймали тільки L-тироксин, уміст BDNF у сироватці крові виріс в 2,1 раза. При порівнянні рівня BDNF у сироватці крові у пацієнтів, які приймали холекальциферол та L-тироксин, уміст BDNF був вищим в 2,48 раза порівняно з пацієнтами, які приймали тільки L-тироксин (p < 0,001). Висновки. Встановлено позитивний вплив вітаміну D на рівень BDNF у сироватці крові у пацієнтів з гіпотиреозом, спричиненим автоімунним тиреоїдитом. Лікування хворих на гіпотиреоз, спричинений автоімунним тиреоїдитом, шляхом додаткового призначення холекальциферолу на тлі L-тироксину виявилось ефективнішим порівняно з призначенням лише L-тироксину (p < 0,001).
Background. Hashimoto’s thyroiditis is a chronic autoimmune disease of the thyroid gland caused by an increase in thyroid antibodies. A growing body of research suggests that patients with Hashimoto’s thyroiditis may suffer from cognitive impairment. Therefore, it is important to identify risk factors that contribute to the development of cognitive impairment in patients with autoimmune thyroiditis to diagnose them early and treat. Given that the influence of thyroid hormones on the brain is undeniable, and their deficiency leads to a variety of neurological complications, early diagnosis and treatment of neurological disorders in thyroid diseases is crucial for preventing further progression of these complications. The purpose of the study is to determine the effect of vitamin D on the level of brain-derived neurotrophic factor (BDNF) in blood serum of patients with hypothyroidism caused by autoimmune thyroiditis. Materials and methods. Twenty-eight patients with hypothyroidism caused by autoimmune thyroiditis were included in the study. The serum level of BDNF was quantified using a solid-phase enzyme-linked immunosorbent assay with a highly sensitive Human BDNF ELISA Kit (Elabscience®, United States, Catalog No E-EL-H0010) on E.I.A. Reader Sirio S (Seac, Italy). Results. In our study, the administration of vitamin D and L-thyroxine led to a 7.4-fold increase in BDNF levels (p < 0.001). In the group of patients who took only L-thyroxine, serum content of BDNF increased by 2.1 times. In patients who took cholecalciferol and L-thyroxine, the level of BDNF was 2.48 times higher compared to those who took only L-thyroxine (p < 0.001). Conclusions. A positive effect of vitamin D on the serum level of BDNF was found in patients with hypothyroidism caused by autoimmune thyroiditis. Treatment of these individuals using additional administration of cholecalciferol on the background of L-thyroxine proved to be more effective compared to the administration of L-thyroxine alone (p < 0.001).
автоімунний тиреоїдит; гіпотиреоз; холекальциферол; BDNF
autoimmune thyroiditis; hypothyroidism; cholecalciferol; brain-derived neurotrophic factor
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Djurovic M., Pereira A.M., Smit J.W.A., Vasovic O., Damjanovic S., Jemuovic Z., Pavlovic D., et al. Cognitive functioning and quality of life in patients with Hashimoto thyroiditis on long-term levothyroxine replacement. Endocrine. 2018. 62(1). 136-143. doi: 10.1007/s12020-018-1649-6.
- Sonoyama T., Stadler L.K.J., Zhu M., Keogh J.M., Henning E., Hisama F., Kirwan P., et al. Human BDNF/TrkB variants impair hippocampal synaptogenesis and associate with neurobehavioural abnormalities. Sci. Rep. 2020. 10(1). 9028. doi: 10.1038/s41598-020-65531-x.
- Sable H.J., MacDonnchadh J.J., Lee H.W., Butawan M., Simpson R.N., Krueger K.M., Bloomer R.J. Working memory and hippocampal expression of BDNF, ARC, and P-STAT3 in rats: effects of diet and exercise. Nutr. Neurosci. 2021. 1-14. doi: 10.1080/1028415X.2021.1885230.
- Puhlmann L.M.C., Linz R., Valk S.L., Vrticka P., Vos de Wael R., Bernasconi A., Bernasconi N., et al. Association between hippocampal structure and serum brain-derived neurotrophic factor (BDNF) in healthy adults: A registered report. Neuroimage. 2021. 118011. doi: 10.1016/j.neuroimage.2021.118011.
- Xiong L.L., Chen J., Du R.L., Liu J., Chen Y.J., Hawwas M.A., Zhou X.F., et al. Brain-derived neurotrophic factor and its related enzymes and receptors play important roles after hypoxic-ischemic brain damage. Neural. Regen. Res. 2021. 16(8). 1453-1459. doi: 10.4103/1673-5374.303033.
- Peters R.B., Xavier J., Mondin T.C., Cardoso T.A., Ferreira F.B., Teixeira L., Gräeff K., et al. BDNF Val66Met polymorphism and resilience in major depressive disorder: the impact of cognitive psychotherapy. Braz. J. Psychiatry. 2021. 43(1). 22-28. doi: 10.1590/1516-4446-2019-0726.
- Hung P.L., Hsu M.H., Yu H.R., Wu K.L.H., Wang F.S. Thyroxin Protects White Matter from Hypoxic-Ischemic Insult in the Immature Sprague-Dawley Rat Brain by Regulating Periventricular White Matter and Cortex BDNF and CREB Pathways. Int. J. Mol. Sci. 2018. 19(9). 2573. doi: 10.3390/ijms19092573.
- Shabani S., Farbood Y., Mard S.A., Sarkaki A., Ahangarpour A., Khorsandi L. The regulation of pituitary-thyroid abnormalities by peripheral administration of levothyroxine increased brain-derived neurotrophic factor and reelin protein expression in an animal model of Alzheimer’s disease. Can. J. Physiol. Pharmacol. 2018. 96(3). 275-280. doi: 10.1139/cjpp-2016-0434.
- Sánchez-Huerta K., García-Martínez Y., Vergara P., Segovia J., Pacheco-Rosado J. Thyroid hormones are essential to preserve non-proliferative cells of adult neurogenesis of the dentate gyrus. Mol. Cell Neurosci. 2016. 76. 1-10. doi: 10.1016/j.mcn.2016.08.001.
- Shafiee S.M., Vafaei A.A., Rashidy-Pour A. Effects of maternal hypothyroidism during pregnancy on learning, memory and hippocampal BDNF in rat pups: Beneficial effects of exercise. Neuroscience. 2016. 329. 151-61. doi: 10.1016/j.neuroscience.2016.04.048.
- Liu D., Teng W., Shan Z., Yu X., Gao Y., Wang S., et al. The effect of maternal subclinical hypothyroidism during pregnancy on brain development in rat offspring. Thyroid. 2010. 20(8). 909-15. doi: 10.1089/thy.2009.0036.
- Garber J.R., Cobin R.H., Gharib H., Hennessey J.V., Klein I., Mechanick J.I., et al. Clinical practice guidelines for hypothyroidism in adults: cosponsored by the American Association of Clinical Endocrinologists and the American Thyroid Association. Endocr. Pract. 2012. 18(6). 988-1028. doi: 10.4158/EP12280.GL.
- Bizzaro G., Shoenfeld Y. Vitamin D and autoimmune thyroid diseases: facts and unresolved questions. Immunol. Res. 2015. 61(1-2). 46-52. doi: 10.1007/s12026-014-8579-z.
- Pankiv I.V. Effect of vitamin D supplementation on insulin resistance in patients with hypothyroidism. International Journal of Endocrinology (Ukraine). 2017. 13(6). 455-458. DOI: 10.22141/2224-0721.13.6.2017.112892.
- Shin D.Y., Kim K.J., Kim D., Hwang S., Lee E.J. Low serum vitamin D is associated with anti-thyroid peroxidase antibody in autoimmune thyroiditis. Yonsei Med. J. 2014. 55(2). 476-81. doi: 10.3349/ymj.2014.55.2.476.
- Al-Amin M., Bradford D., Sullivan R.K.P., Kurniawan N.D., Moon Y., Han S.H., Zalesky A., Burne T.H.J. Vitamin D deficiency is associated with reduced hippocampal volume and disrupted structural connectivity in patients with mild cognitive impairment. Hum. Brain Mapp. 2019. 40(2). 394-406. doi: 10.1002/hbm.24380.
- Pettersen J.A. Does high dose vitamin D supplementation enhance cognition? A randomized trial in healthy adults. Exp. Gerontol. 2017. 90. 90-97. doi: 10.1016/j.exger.2017.01.019.
- Han B., Zhu F.X., Yu H.F., Liu S., Zhou J.L. Low serum levels of vitamin D are associated with anxiety in children and adolescents with dialysis. Sci. Rep. 2018. 8(1). 5956. doi: 10.1038/s41598-018-24451-7.
- Kim S.Y., Jeon S.W., Lim W.J., Oh K.S., Shin D.W., Cho S.J., Park J.H., Shin Y.C. The Relationship between Serum Vitamin D Levels, C-Reactive Protein, and Anxiety Symptoms. Psychiatry Investig. 2020. 17(4). 312-319. doi: 10.30773/pi.2019.0290.
- Sepidarkish M., Farsi F., Akbari-Fakhrabadi M., Namazi N., Almasi-Hashiani A., Maleki Hagiagha A., Heshmati J. The effect of vitamin D supplementation on oxidative stress parameters: A systematic review and meta-analysis of clinical trials. Pharmacol. Res. 2019. 139. 141-152. doi: 10.1016/j.phrs.2018.11.011.
- Eyles D., Almeras L., Benech P., Patatian A., Mackay-Sim A., McGrath J., Féron F. Developmental vitamin D deficiency alters the expression of genes encoding mitochondrial, cytoskeletal and synaptic proteins in the adult rat brain. J. Steroid Biochem. Mol. Biol. 2007. 103(3-5). 538-45. doi: 10.1016/j.jsbmb.2006.12.096.
- Gil Á., Plaza-Diaz J., Mesa M.D. Vitamin D: Classic and Novel Actions. Ann. Nutr. Metab. 2018. 72(2). 87-95. doi: 10.1159/000486536.
- Fleet J.C. The role of vitamin D in the endocrinology controlling calcium homeostasis. Mol. Cell Endocrinol. 2017 Sep 15. 453. 36-45. doi: 10.1016/j.mce.2017.04.008.
- Máčová L., Bičíková M., Ostatníková D., Hill M., Stárka L. Vitamin D, neurosteroids and autism. Physiol. Res. 2017 Sep 26. 66(Suppl. 3). S333-S340. doi: 10.33549/physiolres.933721.
- Cooke G.E., Mullally S., Correia N., O’Mara S.M., Gibney J. Hippocampal volume is decreased in adults with hypothyroidism. Thyroid. 2014. 24(3). 433-40. doi: 10.1089/thy.2013.0058.
- Mahmoud R., Wainwright S.R., Galea L.A. Sex hormones and adult hippocampal neurogenesis: Regulation, implications, and potential mechanisms. Front Neuroendocrinol. 2016. 41. 129-52. doi: 10.1016/j.yfrne.2016.03.002.
- Kapoor R., Fanibunda S.E., Desouza L.A., Guha S.K., Vaidya V.A. Perspectives on thyroid hormone action in adult neurogenesis. J. Neurochem. 2015. 133(5). 599-616. doi: 10.1111/jnc.13093.
- Bothwell M. NGF, BDNF, NT3, and NT4. Handb Exp. Pharmacol. 2014. 220. 3-15. doi: 10.1007/978-3-642-45106-5_1. PMID: 24668467.
- Taghizadeh M., Talaei S.A., Djazayeri A., Salami M. Vitamin D supplementation restores suppressed synaptic plasticity in Alzheimer’s disease. Nutr. Neurosci. 2014. 17(4). 172-7. doi: 10.1179/1476830513Y.0000000080.
- Guo W., Nagappan G., Lu B. Differential effects of transient and sustained activation of BDNF-TrkB signaling. Dev. Neurobiol. 2018. 78(7). 647-659. doi: 10.1002/dneu.22592.
- Gascon-Barré M., Huet P.M. Apparent [3H]1,25-dihydroxyvitamin D3 uptake by canine and rodent brain. Am. J. Physiol. 1983. 244(3). E266-71. doi: 10.1152/ajpendo.1983.244.3.E266.
- Wrzosek M., Łukaszkiewicz J., Wrzosek M., Jakubczyk A., Matsumoto H., Piątkiewicz P., Radziwoń-Zaleska M., Wojnar M., Nowicka G. Vitamin D and the central nervous system. Pharmacol. Rep. 2013. 65(2). 271-8. doi: 10.1016/s1734-1140(13)71003-x.
- Koshkina A., Dudnichenko T., Baranenko D., Fedotova J., Drago F. Effects of Vitamin D3 in Long-Term Ovariectomized Rats Subjected to Chronic Unpredictable Mild Stress: BDNF, NT-3, and NT-4 Implications. Nutrients. 2019. 11(8). 1726. doi: 10.3390/nu11081726.

/60.jpg)