Резюме
Актуальність. Цукровий діабет (ЦД) є однією з найбільш пріоритетних медико-соціальних проблем сучасності. Основними причинами смертності у хворих на ЦД є ішемічна хвороба серця, артеріальна гіпертензія з розвитком гіпертрофії міокарда лівого шлуночка та діабетичне ураження нирок. Мета роботи: визначення поліморфізму Alu Ins/Del гена ангіотензинперетворюючого ферменту (АСЕ) у хворих на ЦД 2-го типу з діабетичною нефропатією (ДН) та виявлення можливого асоціативного зв’язку особливостей ремоделювання серця з генетичним профілем обстежених. Матеріали та методи. Обстежені 73 хворі на ДН, контрольну групу становили 19 здорових осіб. Хворі на ЦД 2-го типу були розділені на три групи: І група — хворі на ДН, носії D/D поліморфізму гена АСЕ (n = 23); ІІ група — хворі на ДН, носії І/D поліморфізму гена АСЕ (n = 32); ІІІ група — хворі на ДН, носії І/І поліморфізму гена АСЕ (n = 18). Ампліфікацію ДНК та генотипування здійснювали методом ПЛР в режимі реального часу з використанням набору реагентів «SNP-ЭКСПРЕСС-SHOT» («Литех», РФ). Усім пацієнтам проводили трансторакальну ехокардіографію на ультразвуковому апараті «ULTIMA PA» («Radmir», Україна) згідно з рекомендаціями Американського ехокардіографічного товариства. Результати. У хворих з генотипом D/D розміри лівого шлуночка серця, а саме ТЗС ЛШ, а також ІММ ЛШ достовірно більші, ніж у гетерозигот І/D (р < 0,05). У групі хворих на ДН, що мали поліморфізм І/І досліджуваного гена, відзначалися достовірно більші розміри устя аорти, ніж у носіїв гомозиготного варіанта D/D гена АСЕ (р < 0,05). У хворих на ЦД 2-го типу, гомозигот за алеллю D/D гена АСЕ, відмічається значне переважання концентричної гіпертрофії у структурі змін геометрії ЛШ (78,3 %) порівняно з гетерозигатами I/D (56,3 %) та носіями І/І поліморфізму (66,7 %). Встановлений негативний кореляційний зв’язок рівня ЛПДНЩ з ФВ ЛШ та позитивний з рівнем креатиніну сечі. Рівень ЛПНЩ позитивно корелював з показниками, що відображають гіпертрофію ЛШ, а саме з ТМШП ЛШ та ТЗС ЛШ. Також виявлений позитивний кореляційний зв’язок рівня креатиніну сечі та КДР ЛШ. У хворих на ДН поліморфізм I/D асоційований із зниженням ризику зростання ММ ЛШ понад 251 г (ВШ = 0,24 (0,08–0,76); р = 0,012 — кодомінантна модель успадкування; ВШ = 0,24 (0,09–0,63); р = 0,003 — надмірно-домінантна модель успадкування). Висновки. Гетерозиготний генотип І/D гена АСЕ асоційований із зниженням ризику зростання ММ ЛШ та ІММ ЛШ порівняно з D/D генотипом, що вказує на важливий вплив цього поліморфізму не тільки на патогенез ДН, а й на розвиток та прогресування серцево-судинних ускладнень в когорті хворих на ЦД 2-го типу.
Background. Diabetes mellitus (DM) is one of the highest priority medical and social problems today. The main causes of death in patients with diabetes are coronary heart disease, hypertension with the development of left ventricular (LV) myocardial hypertrophy and diabetic kidney disease. The aim of the study to determine the prevalence of the Alu Ins/Del polymorphism of the angiotensin-converting enzyme (ACE) gene in patients with type 2 DM with nephropathy and to identify a possible association between cardiac remodeling with genetic profile. Materials and methods. 73 patients with diabetic nephropathy (DN) were examined. The control group consisted of 19 healthy individuals. Depending on the polymorphic variant of the ACE gene, patients with type 2 DM were divided into three groups: group I — patients with DN and D/D polymorphism of the ACE gene (n = 23); group II — patients with DN and I/D polymorphism of the ACE gene (n = 32); Group III — patients with DN and I/I polymorphism of the ACE gene (n = 18). DNA amplification and genotyping were carried out by real-time polymerase chain reaction (PCR) using the SNP-EXPRESS-SHOT reagent kit (Litech, RF). All patients were diagnosed by transthoracic echocardiography on an ultrasound machine “ULTIMA PA” (“Radmir”, Ukraine) according to the recommendations of the American Echocardiographic Society. Results. In patients with the D/D genotype, the size of the left ventricle of the heart, as well as LV mass index (MI) is significantly higher than in I/D heterozygotes (p < 0.05). Significantly higher aortic ostium diameter observed in patients with I/I polymorphism than in homozygous variant of the D/D ACE gene carriers (p < 0.05). In patients with type 2 DM, homozygotes for the ACE D/D allele, there is a significant predominance of concentric hypertrophy in the structure of changes in LV geometry (78,3 %), compared with I/D heterozygotes (56,3 %) and I/I carriers polymorphism (66,7 %). We found a negative correlation between very-low-density lipoprotein (VLDL) cholesterol and LV ejective fraction and positive correlation with urinary creatinine concentration. The level of LDL-cholesterol was positively correlated with interventricular septal thickness (IVST) and posterior wall thickness (PWT) LV. There was also a positive correlation between urinary creatinine and LV volume. In patients with DN I/D polymorphism is associated with a reduced risk of LV mass over 251 g (OR = 0,24 (0,08–0,76); p = 0.012 — codominant model of inheritance; OR = 0,24 (0,09–0,63); p = 0,003 — overdominant model of inheritance). Conclusions. The heterozygous I/D genotype of the ACE gene is associated with a reduced risk of LV mass and LVMI growth compared to the D/D genotype, which indicates an important effect of this polymorphism not only on the pathogenesis of DN but also on the development and progression of cardiovascular disease in 2 type DM patients.
Вступ
Цукровий діабет (ЦД) є однією з найбільш пріоритетних медико-соціальних проблем сучасності. Захворюваність на ЦД продовжує невпинно зростати протягом останніх 30 років, і на сьогодні кількість хворих у світі становить 537 мільйонів серед дорослих. За прогнозами, це число зросте до 643 мільйонів до 2030 року і 783 мільйонів до 2045 року. Діабет є причиною 6,7 мільйона смертей у 2021 році [1]. Основними причинами смертності у хворих на ЦД є ішемічна хвороба серця, артеріальна гіпертензія з розвитком гіпертрофії міокарда лівого шлуночка (ГЛШ) та діабетичне ураження нирок [2]. Хронічна гіперглікемія являє собою самостійний фактор ризику виникнення та прогресування ураження серця та судин у хворих на цукровий діабет [3].
У сучасній медицині ехокардіографічне дослідження серця є провідним неінвазивним методом діагностики, що дозволяє виявити морфологічні зміни структур серця [4]. У розвитку серцевої недостатності велика увага приділяється змінам геометричної форми лівого шлуночка — ремоделюванню міокарда [5].
Виявлення взаємозв’язку генного поліморфізму з морфофункціональними змінами лівого шлуночка серця у хворих на цукровий діабет могло б сприяти вирішенню завдання формування груп ризику та здійсненню серед зазначених груп превентивних заходів, а також кращому розумінню патогенезу цих двох станів, а отже, можливому поліпшенню медикаментозного лікування.
Матеріали та методи
Дослідження проводились у відділі профілактики та лікування хвороб нирок при коморбідних станах на базі клінічного відділення гіпертензій та захворювань нирок ДУ «Національний інститут терапії ім. Л.Т. Малої НАМН України». Біохімічні та імуноферментні дослідження виконували у лабораторії імунобіохімічних і молекулярно-генетичних досліджень. Дослідження виконані згідно з міжнародними стандартами щодо погодженої участі обстежених, етичної складової виконання досліджень та взяття біоматеріалу. Хворі, які брали участь у дослідженні, підписували інформовану згоду на участь у ньому. Дослідження виконані з дотриманням основних положень «Етичних принципів проведення наукових медичних досліджень за участю людини», затверджених Гельсінською декларацією (1964–2013 рр.), ІСН GCP (1996 р.), директиви ЄЕС № 609 від 24.11.1986 р., наказів МОЗ України № 690 від 23.09.2009 р., № 616 від 03.08.2012 р.
У процесі виконання дослідження обстежені 73 хворі на діабетичну нефропатію (ДН), які перебували на лікуванні в клініці ДУ «Національний інститут терапії імені Л.Т. Малої НАМН України». Конт-рольну групу становили 19 здорових осіб.
Після первинного обстеження залежно від поліморфного варіанта гена АСЕ хворі з ЦД 2-го типу були розділені на три групи:
— І група — хворі на ДН, носії D/D поліморфізму гена АСЕ (n = 23);
— ІІ група — хворі на ДН, носії І/D поліморфізму гена АСЕ (n = 32);
— ІІІ група — хворі на ДН, носії І/І поліморфізму гена АСЕ (n = 18).
Критеріями включення пацієнтів були: наявність ЦД 2-го типу, підписання інформованої згоди на участь у дослідженні. Критеріями виключення пацієнтів були: вік менше ніж 18 років, вагітні жінки, хворі з декомпенсацією ЦД, наявність первинної патології нирок (сечокам’яна хвороба, інфекції вивідних шляхів, уроджені аномалії нирок), термінальна стадія ниркової недостатності, тяжкі захворювання печінки, злоякісні новоутворення, захворювання системи крові, відсутність інформованої згоди.
Дезоксирибонуклеїнові кислоти (ДНК) виділяли з крові стандартним методом з використанням набору реагентів «ДНК-сорб-В» («Амплисенс», РФ) згідно з інструкцією виробника. Ампліфікацію ДНК та генотипування здійснювали методом полімеразної ланцюгової реакції (ПЛР) у режимі реального часу з використанням набору реагентів «SNP-ЭКСПРЕСС-SHOT» («Литех», РФ) згідно з інструкцією виробника за допомогою системи детекції продуктів ПЛР у реальному часі CFX96 Touch (BioRad) (зав. № СТ 014010, 785 BR11304).
Для дослідження структурно-функціонального стану серця всім пацієнтам проводили трансторакальну ехокардіографію на ультразвуковому апараті «ULTIMA PA» («Radmir», Україна) (метрологічна придатність підтверджена свідоцтвом про повірку) секторальним фазованим датчиком з діапазоном частот 2–3 МГц, за стандартною методикою згідно з рекомендаціями Американського ехокардіографічного товариства [6].
Статистичний аналіз генетичних асоціацій проводився з використанням програми SNP Stats [7]. Для порівняння виявлених і очікуваних частот генотипів розраховували рівновагу Харді — Вайнберга за критерієм χ2 з одним ступенем свободи.
Математичний аналіз метричних даних проводили з використанням варіаційної статистики за стандартними ліцензійним комп’ютерними програмами. Відмінності між групами середніх величин та їх похибки (М ± m) оцінювали за допомогою критерію Стьюдента — Фішера. Достовірною вважалася ймовірна похибка менше ніж 5 % (p < 0,05). Перевірку нормальності розподілу показників здійснювали за допомогою тесту Колмогорова — Смирнова. Кореляцію кількісних ознак оцінювали шляхом розрахунку коефіцієнта Пірсона.
Результати
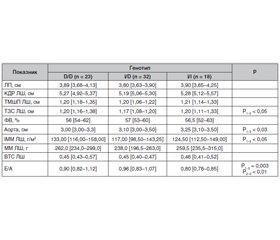
Порівняльний аналіз параметрів внутрішньосерцевої та центральної гемодинаміки у хворих на ЦД 2-го типу з ДН, носіїв різних поліморфних варіантів гена АСЕ, показав, що у хворих з генотипом D/D розміри лівого шлуночка серця, а саме ТЗС ЛШ, а також ІММ достовірно більші, ніж у гетерозигот І/D (р < 0,05). Згідно з даними, наведеними у табл. 1, у групі хворих на ДН, що мали поліморфізм І/І досліджуваного гена, відзначалися достовірно більші розміри устя аорти, ніж у носіїв гомозиготного варіанта D/D гена АСЕ (р < 0,05).
Носії різних поліморфізмів гена АСЕ мали достовірні відмінності у структурно-геометричних показниках ЛШ, а саме ТЗС ЛШ та ІММ ЛШ були достовірно вищі у пацієнтів з D/D генотипом порівняно з носіями І/D поліморфізма гена АСЕ (табл. 1).
Згідно з отриманими нами даними, що наведені на рис. 1, у хворих на ЦД 2-го типу, гомозигот за алеллю D/D гена АСЕ, відмічається значне переважання концентричної гіпертрофії у структурі змін геометрії ЛШ (78,3 %) порівняно з гетерозиготами I/D (56,3 %) та носіями І/І поліморфізму (66,7 %). Таким чином, ми можемо припустити, що у хворих на ЦД 2-го типу з генотипом D/D гена АСЕ, імовірно, буде мати місце більш тяжкий перебіг ГЛШ, висока коморбідність з ризиком розвитку порушень ритму, серцевої недостатності та інсульту, а також більший ризик розвитку летальних серцево-судинних ускладнень (ССУ). Перевірка цього припущення потребує подальших досліджень з визначенням кардіальних та ниркових кінцевих точок.
З метою виявлення взаємозв’язків між біохімічними показниками та основними кардіомет-ричними характеристиками у хворих на ДН нами був проведений кореляційний аналіз, наведений у табл. 2.
При аналізі встановлений негативний кореляційний зв’язок рівня ЛПДНЩ з ФВ ЛШ та позитивний з рівнем креатиніну сечі. Рівень ЛПНЩ позитивно корелював з показниками, що відображають гіпертрофію ЛШ, а саме з ТМШП ЛШ та ТЗС ЛШ. Також виявлений позитивний кореляційний зв’язок рівня креатиніну сечі та КДР ЛШ.
Аналіз даних за допомогою онлайн-програми SNP Stats продемонстрував, що у хворих на ДН поліморфізм I/D асоційований із зниженням ризику зростання ММ ЛШ понад 251 г (ВШ = 0,24 (0,08–0,76); р = 0,012 — кодомінантна модель успадкування; ВШ = 0,24 (0,09–0,63); р = 0,003 — надмірно-домінантна модель успадкування) (табл. 3).
При аналізі асоціації ризику зростання ІММ ЛШ у хворих на ДН з поліморфним варіантом гена АСЕ залежно від гендерної приналежності встановлено, що у жінок з гетерозиготним поліморфізмом I/D знижений ризик збільшення ІММ ЛШ (ВШ 0,16 (0,03–0,85); р < 0,05) порівняно з гомозиготами D/D.
При вивченні асоціації ризику зростання ММ ЛШ у хворих на ДН з поліморфним варіантом гена АСЕ залежно від гендерної приналежності встановлено, що у жінок з гетерозиготним поліморфізмом I/D знижений ризик збільшення ММ ЛШ (ВШ 0,15 (0,03–0,80); р < 0,05).
Обговорення
ГЛШ — це патологічний стан, який характеризується аномальним збільшенням маси ЛШ та тісно пов’язаний з розвитком інших серцево-судинних захворювань, фатальних ССУ, а саме з ішемічною хворобою серця [8], серцевою недостатністю [9], гострим порушенням мозкового кровообігу [10] та ураженням периферичних артерій [11]. Патогенез гіпертрофії ЛШ є складним та має тісний зв’язок з ренін-ангіотензин-альдостероновою системою. Відомо, що ангіотензин II має трофічну дію та сприяє розвитку гіпертрофії міокарда [12]. За результатами багатьох досліджень, у пацієнтів, у яких експресується генотип D/D гена АСЕ, відзначаються більш високі рівні сироваткового ангіотезинперетворювального ферменту, а також підвищений ризик раптової смерті та більш значима й тяжка гіпертрофія міокарда [13, 14].
Отримані нами дані збігаються з результатами інших дослідників.
За результатами метааналізу, проведеного T. Kuznetsova у 2000 р., встановлено, що алель D поліморфізму Alu Ins/Del гена АСЕ пов’язана зі збільшенням ризику гіпертрофії лівого шлуночка [15]. Подібні результати були продемонстровані в іншому метааналізі 2019 р., у якому показана достовірна асоціація D-алелі (р = 0,0180) та поліморфізму D/D гена АСЕ (р = 0,0110) з підвищеним ризиком розвитку гіпертрофії ЛШ [16].
За даними літератури, традиційно виділяють концентричну та ексцентричну ГЛШ. Концентрична ГЛШ характеризується потовщенням стінки внаслідок функціонального навантаження тиском, у результаті відбувається потовщення міофібрилярних пучків при їх незмінній довжині. При концентричній ГЛШ спостерігається високий загальний периферичний судинний опір, субнормальний ударний об’єм та підвищений пульсовий артеріальний тиск, обумовлений ригідністю артерій.
Ексцентрична ГЛШ виникає при навантаженні об’ємом та супроводжується збільшенням порожнини ЛШ, подовженням кардіоміоцитів за рахунок додавання нових саркомерів без зміни поперечних розмірів та довжини самого саркомера. Для таких пацієнтів більш характерно збільшення порожнини ЛШ, відносно низький пульсовий артеріальний тиск та відсутність виражених вазоспастичних реакцій [17].
Тип геометрії ЛШ є важливим індикатором розвитку порушень ритму. Згідно з дослідженням J. Ghali [17], концентрична ГЛШ асоційована з більш високим ризиком смерті внаслідок аритмії порівняно з ексцентричною та не залежить від коморбідності з ішемічною хворобою серця [18, 19]. Також за наявності ГЛШ значно збільшується ризик виникнення інсульту, що обумовлено супутніми змінами у судинах мозку. За даними дослідження, проведеного на японській популяції, доведено зв’язок концентричної ГЛШ з доклінічними ураженнями центральної нервової системи [20]. За результатами Фремінгемського дослідження, продемонстровано збільшення частоти фібриляції передсердь (ФП) у 1,5 раза при збільшенні ІММ ЛШ на кожні 40 г/м2. ГЛШ збільшує ризик виникнення ФП у 3–4 рази у пацієнтів однакового віку, а кожне потовщення стінки ЛШ на 4 мм підвищує ризик на 28 % [21].
Як вже було зазначено вище, ДН є багатофакторним захворюванням, і наявність або відсутність певних генотипів в інших релевантних локусах, безумовно, може впливати на фенотип, що визначає актуальність подальшого вивчення зв’язку передбачуваних генетичних маркерів з нирковими та серцево-судинними ураженнями в когорті хворих на ЦД 2-го типу.
Таким чином, спадкові розбіжності у носіїв різних поліморфних варіантів Ins/Del гена АСЕ можуть бути пов’язані з ДН, на що вказують патогенетичні особливості цього захворювання. Гетерозиготний генотип І/D гена АСЕ асоційований із зниженням ризику зростання ММ ЛШ та ІММ ЛШ порівняно з D/D поліморфізмом, що дозволяє припустити важливий вплив не тільки на патогенез ДН, але й на розвиток і прогресування коморбідних захворювань та ССУ. Для підтвердження отриманих результатів, а також подальшого поглиблення наукових знань та розуміння генетичних основ діабетичних уражень нирок та перебігу захворювання у даної категорії хворих необхідні подальші дослідження.
Висновки
1. Носії різних поліморфізмів гена АСЕ мали достовірні відмінності у структурно-геометричних показниках ЛШ, а саме ТЗС ЛШ та ІММ ЛШ були достовірно вищі у пацієнтів з D/D генотипом порівняно з носіями І/D поліморфізму гена АСЕ (р < 0,05).
2. У хворих на ЦД 2-го типу, гомозигот за алеллю D/D гена АСЕ відмічається значне переважання концентричної гіпертрофії у структурі змін геометрії ЛШ (78,3 %) порівняно з гетерозиготами I/D (56,3 %) та носіями І/І поліморфізму (66,7 %).
3. Гетерозиготний генотип І/D гена АСЕ асоційований із зниженням ризику зростання ММ ЛШ та ІММ ЛШ порівняно з D/D генотипом, що вказує на важливий вплив даного поліморфізму не тільки на патогенез ДН, але й на розвиток та прогресування ССУ в когорті хворих на ЦД 2-го типу.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 15.03.2022
Рецензовано/Revised 26.03.2022
Прийнято до друку/Accepted 03.04.2022
Список литературы
1. Sun H., Saeedi P., Karuranga S. et al. IDF Diabetes Atlas: Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045. Diabetes Research and Clinical Practice. 2022. P. 1-183. e. 109119. doi:0.1016/j.diabres.2021.109119.
2. Ettinger O.A. Diabetic heart disease: modern approaches to diagnosis and treatment. Meditsinskij Vestnik. 2012. № 17/18. P. 13. (in Russian)
3. Goncharenco O.N., Ametov A.S., Bysarov S.L. Heart at gunpoint. diabetes and cardiovascular disease (questions therapy). Vestnik Poslediplomnogo Meditsinskogo Obrazovania. 2008. № 3–4. P. 21-26. (in Russian)
4. Belaev A.B., Cholodova O.E., Kuchalechvili H.R. et al. The leading role of echocardiography in the diagnosis of cardiovascular diseases. Funkzionalnaya diagnostika. 2010. № 3. P. 56. (in Russian)
5. Serebrakova O.V. Pathogenetic mechanisms of cardiomyopathy in thyrotoxicosis and hypothyroidism: Thesis DSc in Medicine. Chita. 2008. P. 1-39. (in Russian)
6. Lang R.M., Badano L.P., Mor-Avi V. et al. Recomendations for Cardiac Chamber by Echocardiography in Adults: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J. Am. Soc. Echocardiogr. 2015. № 28(1). P. 1-38. doi: 10.1016/j.echo.2014.10.003.
7. Solé X., Guinó E., Valls J. et al. SNPStats: a web tool for the analysis of association studies. Bioinformatics. 2006. № 22 (15). P. 1928-1929. doi: 10.1093/bioinformatics/btl268.
8. Brown D.W., Giles W.H., Croft J.B. Left ventricular hypertrophy as a predictor of coronary heart disease mortality and the effect of hypertension. Am. Heart J. 2000. № 140(6). P. 848-856. doi: 10.1067/mhj.2000.111112.
9. Gradman A.H., Alfayoumi F. From left ventricular hypertrophy to congestive heart failure: management of hypertensive heart disease. Prog. Cardiovasc. Dis. 2006. № 48(5). P. 326-341. doi: 10.1016/j.pcad.2006.02.001.
10. Bruno A., Brooks D.D., Abrams T.A. Left ventricular hypertrophy in acute stroke patients with known hypertension. Clin. Exp. Hypertens. 2017. № 39(6). P. 502-504. doi: 10.1080/10641963.2016.1259328.
11. Albuquerque P.F., Albuquerque P.H., Albuquerque G.O. et al. Ankle-brachial index and ventricular hypertrophy in arterial hypertension. Arq. Bras. Cardiol. 2012. № 98(1). P. 84-86. doi: 10.1590/s0066-782x2012000100013.
12. Kawano H., Do Y.S., Kawano Y. et al. Angiotensin II has multiple profibrotic effects in human cardiac fibroblasts. Circulation. 2000. № 101. P. 1130-1137. doi: 10.1161/01.cir.101.10.1130.
13. Lechin M., Quinones M.A., Omran A. et al. Angiotensin-I converting enzyme genotypes and left ventricular hypertrophy in patients with hypertrophic cardiomyopathy. Circulation. 1995. № 92. P. 1808-1812. doi: 10.1161/01.cir.92.7.1808.
14. Jan Danser A.H., Schalekamp M., Bax W.A. et al. Angiotensin-converting enzyme in human heart. Effect of the deletion/insertion polymorphism. Circulation. 1995. № 92. P. 1387-1388. doi: 10.1161/01.cir.92.6.1387.
15. Kuznetsova T., Staessen J.A., Wang J.G. Antihypertensive treatment modulates the association between the D/I ACE gene polymorphism and left ventricular hypertrophy: a meta-analysis. J. Hum. Hypertens. 2000. № 14(7). P. 447-454. doi: 10.1038/sj.jhh.1001055.
16. Fajar J.K., Pikir B.S., Heriansyah T. et al. The Gene Polymorphism of Angiotensin-Converting Enzyme Intron Deletion and Angiotensin-Converting Enzyme G2350A in Patients With Left Ventricular Hypertrophy: A Meta-analysis. Indian Heart J. 2019. № 71(3). P. 199-206. doi: 10.1016/j.ihj.2019.07.002.
17. Safarova A.F., Kotovskaya Yu.V., Korovina E.P. Sovremennyie metodyi diagnostiki gipertrofii miokarda levogo zheludochka u bolnyih arterialnoy gipertoniey. Moskva: In-t problem upr. zdravoohraneniem, 2009. P. 1-77. (in Russian)
18. Ghali J., Kadakia S., Cooper R. et al. Impact of left ventricular hypertrophy patterns on ventricular arrhythmias in the absence of coronary artery disease. J. Am. Coll. Cardiol. 1991. № 17. P. 1277-1282. doi: 10.1016/s0735-1097(10)80135-4.
19. Ghali J.K., Liao Y., Cooper R.S. Influence of left ventricular geometric patterns on prognosis in patients with or without coronary artery disease. J. Am. Coll. Cardiol. 1998. № 31. P. 1635-1640. doi: 10.1016/s0735-1097(98)00131-4.
20. Kohara K., Zhao B., Jiang Y. et al. Relation of left ventricular hypertrophy and geometry to asymptomatic cerebrovascular damage in essential hypertension. Am. J. Cardiol. 1999. № 83. P. 367-370. doi: 10.1016/s0002-9149(98)00870-4.
21. Savage D.D., Garrison R.J., Konnel W.B. The spectrum of left ventricular hypertrophy in a general population sample: the Framingham study. Circulation. 1987. № 75. P. 26-33.

/26_2.jpg)
/26.jpg)
/27.jpg)