Діагноз
Ми вже згадували, що батьки дітей, що часто хворіють (ДЧХ), зазвичай звертаються на консультацію, маючи на руках стоси, повні папки різноманітних аналізів, результатів лабораторної та інструментальної діагностики, виписок із стаціонарних історій хвороб, висновків поважних консультантів та різноманітних схем лікування. Єдине, чого зазвичай бракує у цих папках, то це результатів бактеріологічного обстеження сечі, й дуже в обмеженій кількості — результати бактеріологічного обстеження мазків із носа та горла. А якщо вони і є, то рекомендації консультантів та лікуючих докторів з приводу виявлення в носоглотці золотистого стафілококу (Staphylococcus aureus, S. aureus) майже навпіл розмежовуються за двома крайніми принципами: 1) або «він є в усіх», або «його обмаль» і тому лікувати не потрібно; та 2) обов’язково «треба пролікувати антибіотиком» і домогтися його «повного знищення». Істина же, як відомо, завжди лежить посередині. Тому з цього і почнемо.
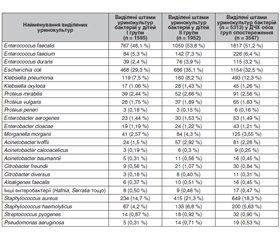
Проаналізуємо результати бактеріологічного обстеження 3547 дітей, що часто хворіють, у двох групах спостереження: із домінуючими гнійно-запальними захворюваннями носоглотки та дихальних шляхів (I група) та з домінуючими токсичними проявами (II група) у вигляді загальнодомінуючого порушення температурного режиму: із затяжними субфебрилітетами, фебрильними атаками та фебрильними лихоманками. У табл. 1 наведені результати бактеріологічного обстеження теплої сечі у 1595/3547 (45 %) дітей I групи спостережень, яку умовно називали «Клінічний образ ДЧХ із гнійно-запальними захворюваннями», та 1952/3547 (55 %) дітей II групи з умовною назвою «Клінічний образ ДЧХ із домінуючими токсичними проявами».
/9.jpg)
Внаслідок бактеріологічного обстеження теплої сечі 3547 дітей, що часто хворіють, в обох групах спостереження (1933/3547, або 54,5 % випадків) було виділено по 1 культурі бактерій — тобто 1933 штами, бо штами одного виду тієї самої бактерії, виділені при бакпосівах теплої сечі три дні поспіль у одного хворого двічі чи тричі, вважали, щоб не заплутатися, за один штам. Ще у 1462/3547 (41,2 %) дітей було виділено одночасно по 2 культури різних бактерій, тобто ще 2924 штами, а по 3 культури з однієї порції сечі виділяли рідко — всього у 152/3547 (4,3 %) випадках (456 штамів). Більше 3 штамів з одного бакпосіву майже не виділяли. Таким чином, узагалі було виділено 5313 штамів різних бактерій, що розглядали як бактеріологічне підтвердження наявності у цих пацієнтів або зазвичай нефродисбактеріозу, або встановлення етіологічного збудника хронічного пієлонефриту. Треба зауважити, що синдром хронічної бактеріальної інтоксикації (СХБІ), так само, як і вогнище хронічної бактеріальної інфекції у нирках, — це завжди поліетіологічне захворювання, і при бактеріологічному обстеженні переважно виділяють домінуючий наразі збудник. Неодноразово виникали ситуації, коли в одного хворого упродовж обмеженого періоду часу (6–12 місяців) при обстеженні послідовно виділяли 4–5 і навіть більше різних бактерій, що могло необґрунтовано здаватися лабораторною похибкою.
Згідно з табл. 1, частота виділення домінуючих уринокультур не мала суттєвих і принципових відмінностей у I та II групах спостереження. Тобто і у дітей із переважно хронічними, часто рецидивуючими гнійно-запальними захворюваннями носоротоглотки та ВДШ так само, як і у дітей із порушеннями температурного режиму та іншими проявами СХБІ завжди виявляли вогнище хронічної бактеріальної інфекції у нирках. Головним чинником виникнення нефродисбактеріозу у ДЧХ обох груп спостереження виявилися ентерококи, рівень виділення яких із сечі порівняно з іншими бактеріями значно переважав і становив 60,8 %, або 2158/3547 штамів. Найчастіше ізолювали Enterococcus faecalis — 1817/3547 (51,2 %) штамів від дітей у обох групах спостереження та 1817/2158 (84,2 %) серед усіх виділених ентерококів, значно рідше — Enterococcus faecium (226/3547, або 6,4 %, та 226/2158, або 10,5 %, відповідно) та Enterococcus durans — 115 штамів (3,2 та 5,3 % відповідно). Другою за ентерококами за частотою виявляли кишкову паличку (Escherichia coli), яка була виділена від 32,5 % дітей (1154/3547). Отже, саме ці дві бактерії — ентерококи та кишкова паличка — були головними домінуючими етіологічними чинниками виникнення нефродисбактеріозу/СХБІ у ДЧХ обох груп, становили майже 2/3 (3312/5313, або 63 %) від усіх ізольованих штамів уринокультур і були виділені загалом у 3312/3547 (93,4 %) дітей.
До домінуючих штамів бактерій, виділених із сечі у ДЧХ, можна було також віднести клебсієли, які були виділені у 538/3547 (13,56 %) хворих, при цьому значно частіше ізолювали Klebsiella pneumonia (493/3547, або 12,3 %) порівняно з Klebsiella oxytoca (45/3547, або 1,26 %). Майже у 3 рази рідше виділяли протеї — у 162/3547 (4,55 %) випадках (зазвичай — Proteus mirabilis та Proteus vulgaris, лише в поодиноких випадках — Proteus peneri). Ще рідше виділяли морганели (Morganella morganii) — у 125/3547, або 3,55 % хворих та ентеробактери — у 96/3547, або 2,7 % хворих (майже порівну — Enterobacter aerogenes і Enterobacter cloacae). Відповідно до табл. 1, іншу незначну групу виділених уринокультур становили такі ентеробактерії, як ацинетобактери, виділені у 106/3547, або майже 3 % дітей (переважно Acinetobacter lvoffii), та цитробактери — у 41/3547, або 1,15 % дітей (у 3 рази частіше — Citrobacter freundii). До рідкісних ізолятів уринокультур можна було віднести Alcaligenes faecalis (16/3547, або 0,45 %), а також гафнії, серації й деякі зовсім поодинокі (17/3547, або 0,47 %). У 19/3547 (0,53 %) дітей із сечі була виділена синьогнійна паличка (Pseudomonas aeruginosa) як етіологічно внутрішньолікарняна інфекція після хірургічного втручання та/або багаторазових інвазійних отоларингологічних, урологічних і інших оглядів, процедур, маніпуляцій. Треба зауважити, що рідкісні ізоляти бактерії майже у 2 рази частіше виділяли з сечі у ДЧХ II групи з домінуючими токсичними проявами.
Наступну велику групу виділених із сечі бактерій у ДЧХ обох клінічних образів, що знаходилися під спостереженням, становили стафілококи: сумарно 849/5313 (16 %) штамів, ізольованих від 23,9 % (849/3547) хворих дітей. При цьому S. aureus виділяли у 3,2 раза частіше, ніж S. haemolyticus: 649 штамів від 3547 хворих (18,3 %) та 200/3547 (5,63 %) відповідно. Також S. aureus у 1,8 раза частіше виділяли у дітей II групи з домінуючими клінічними проявами СХБІ порівняно з дітьми I групи: 415/1952 (21,3 %) і 234/1595 (14,7 %) відповідно. Значно рідше порівняно із стафілококами виділяли з сечі стрептококи, а саме Streptococcus pyogenes: 14/1595 штамів (0,87 %) у дітей I групи та 18/1952 (0,92 %) у дітей II групи. І хоча стафілококи загалом за частотою виявлення уринокультур поступилися лише ентерококам та кишковій паличці, слід зауважити, що територія слизових оболонок сечостатевих органів та нирок, зокрема, для стафілококів не є звичною. З урахуванням переважно повітряно-крапельного шляху їх передачі перше і головне вогнище цих бактерій спочатку формується у носоглотці, мигдаликах та придаткових пазухах носа, і звідтіля вони різними шляхами потрапляють у сечостатеві органи, де певний час можуть навіть домінувати в етіологічній структурі вогнища хронічної бактеріальної інфекції у нирках (нефродисбактеріоз) із розвитком СХБІ у ДЧХ. Тому буде цікаво проаналізувати частоту виявлення стафілококів у носоглотці в ДЧХ обох груп спостереження. Але спочатку невелика ремарка.
У зв’язку з майже тотальним виділенням бактерій із сечі ДЧХ з різними діагнозами були обстежені дві контрольні групи здорових дітей та дорослих. Бактеріологічне дослідження сечі (тричі, 3 дні поспіль) провели у 205 клінічно здорових малюків грудного віку (від 3 до 12 місяців), що становили контрольну групу 1, яких принесли у клініку на планове профілактичне щеплення, та 70 здорових дорослих (жінок — 30, або 42,9 %, чоловіків — 40, або 57,1 %) віком від 20 до 65 років (контрольна група 2). Діти грудного віку для бактеріологічного обстеження були вибрані не випадково. Вже понад 20 років клініка проводить планові профілактичні щеплення дітей лише після їх ретельного лабораторного обстеження, що включає обов’язкове проведення бактеріологічного аналізу сечі. Таке почали робити після бактеріологічного дослідження сечі 115 клінічно здорових малюків, частіше грудного віку, які на попередніх етапах звернення за медичною допомогою в інші клініки мали високу температурну реакцію після планового щеплення та введення полівалентної вакцини проти 6 інфекцій відомого європейського виробника, яку найчастіше використовують в Україні. В 112/115 (97,4 %) випадках із сечі були виділені різні бактерії, що свідчило про те, що підвищення температури відбулося на тлі нефродисбактеріозу та мало типові ознаки фебрильної атаки [11], спровокованої бактеріальними токсинами загальнотоксичної дії після введення вакцини.
У нашому дослідженні серед дітей контрольної групи 1 нефродисбактеріоз був виявлений у 110/205 випадках (53,7 %), що розглядали як своєрідну «плату за підгузки», та серед дорослих контрольної групи 2 — у 5/70 (7,1 %) випадках, що було істотно менше порівняно з результатами бактеріологічного дослідження сечі у дітей, що часто хворіють, із різними діагнозами.
Окремо зазначимо, що розвиток СХБІ та його клінічних проявів у ДЧХ не залежав від наявності запального процесу в нирках. Так, серед 3547 ДЧХ обох груп спостереження із встановленим діагнозом нефродисбактеріозу клінічні згадки та лабораторне і/або УЗД підтвердження пієлонефриту мали на момент звернення у клініку тільки 290/3547 (8,2 %) пацієнтів. Ще у 656/3547 (18,5 %) дітей, незважаючи на відсутність у них будь-яких даних з анамнезу та клінічних проявів хронічного пієлонефриту, в загальних аналізах сечі були вперше встановлені мікроскопічні ознаки латентного формування хронічного уповільненого запального процесу в нирках із різним рівнем підвищення білка, лейкоцитів, появою циліндрів та бактерій, рідше — еритроцитів. Тобто у 2601/3547 (73,3 %) дітей на момент встановлення діагнозу СХБІ був нефродисбактеріоз у «чистому» вигляді без усяких ознак запального процесу в нирках.
При бактеріологічному обстеженні мазків з носа і глотки, з рота та бляшок стоматиту, із слизу з носа та харкотиння в дітей обох груп домінуюча частота виявлення S. aureus суттєво не відрізнялась: у дітей групи 1 він сумарно був виявлений з мазків різних локалізацій при першому обстеженні до початку лікування в клініці у 1197/1595 (75,0 %) випадків, у другій — у 1374/1952 (70,4 %). Відзначимо, що частота виявлення золотистого стафілококу у ДЧХ обох груп залишалася стабільною протягом року та суттєво не змінювалася залежно від частоти ГРЗ у весняно-літній чи осінньо-зимовий період. Після першого курсу лікування при проведенні контрольного бактеріологічного обстеження він був додатково виділений від дітей із негативними результатами першого обстеження ще у 371/1595 (23,3 %) та 525/1952 (26,9 %) випадках відповідно. Тобто у 98,3 % (1568/1595) дітей групи 1 та у 97,3 % (1899/1952) групи 2 S. aureus (загалом у 3467/3547, або 97,7 % ДЧХ, що знаходились під наглядом) займав домінуючу позицію у цьому носоротоглотковому мікробіомі. При цьому, якщо у дітей I групи домінували клінічні прояви гнійно-запальних процесів у носоглотці, які викликає стафілокок, то у дітей II групи з переважно токсичними проявами такі запалення виникали значно рідше й мали другорядне клінічне значення. Інколи безсимптомна персистенція стафілококів, яка могла продовжуватися кілька місяців після клінічного одужання дитини, навіть не потребувала відповідного лікування. І це, мабуть, саме та відповідь, що лежить посередині: чи треба лікувати всіх носіїв стафілокока, чи не треба лікувати нікого, бо він у всіх є. Треба лікувати тих хворих, у яких стафілокок проявляє свої патогенні властивості та викликає рецидивуючі гнійно-запальні захворювання будь-якої локалізації. Коли ж він знаходиться у клінічно безсимптомному стані коменсала, то дійсно може не потребувати лікування. Цю сентенцію підтверджують результати бактеріологічного обстеження пацієнтів контрольних груп. У клінічно здорових дітей контрольної групи 1 золотистий стафілокок був виділений з носоглотки у 131/205 (63,9 %) дитини, серед здорових дорослих контрольної групи 2 — у 22/70 (31,4 %) і серед дітей перших 3 тижнів життя (контрольна група 3) — у 23/27 (85,2 %) випадків. Такі результати бактеріологічного обстеження носоглотки новонароджених збігаються з раніше опублікованими даними [13] про те, що спочатку в більшості новонароджених переважає саме Staphylococcus aureus, а вже потім відбувається диференціація бактеріальної флори їх мікробіоти з переважанням Corynebacterium pseudodiphteriticum/propinquum, Dolosigranulum pigrum, Moraxella catarrhalis/nonliquefaciens, Streptococcus pneumoniae або Haemophilus influenzae.
Додатково/одночасно із стафілококами (включно зі значно рідшою ідентифікацією, окрім S. aureus, ще S. haemolyticus) також виділяли стрептококи: переважно Streptococcus pyogenes — у 435/1595 (27,3 %) дітей першої групи та у 420/1952 (21,5 %) — другої та рідше Streptococcus pneumonia — у 245/1595 (15,4 %) та у 267/1952 (13,7 %) відповідно. У невеликій кількості в дітей обох груп — у 230/1595 (14,4 %) першої та у 193/1952 (9,9 %) другої — одночасно (рідше окремо) із стафілококами та стрептококами виділяли такі патогенні, умовно-патогенні та сапрофітні бактерії, як ентерококи (головним чином Enterococcus faecalis), Escherichia coli, клебсієли (зазвичай Klebsiella pneumoniae), протеї (переважно Proteus mirabilis та Proteus vulgaris), ентеробактери, в поодиноких випадках — ацинетобактери, цитробактери й Alcaligenes faecalis, синьогнійну паличку (Pseudomonas aeruginosa), а також коринебактерії, нейсерії, дифтероїди та деякі інші сапрофітні бактерії. Наші дані відносно частки різних бактерій у формуванні назофарингеального мікробіому в дітей з домінуючими гнійно-запальними захворюваннями носоглотки та/або токсичними проявами СХБІ суттєво відрізняються від результатів вивчення мікробної колонізації носоротоглотки у дітей, що часто хворіють на звичайні ГРЗ та RRD (рекурентні респіраторні захворювання). За раніше отриманими даними, у дітей цієї групи віком від 6 місяців до 5 років рівень назофарингеального носійства Str. pneumoniae становив 50,4 % [1].
Токсикологічне дослідження крові методом комплексної токсикометрії з використанням діагностичної системи «Токсикон» було проведено в 96 дітей віком від 3 до 14 років, що часто хворіли, II групи спостережень за методом випадкової вибірки з відповідною статистичною обробкою результатів. При проведенні токсикологічного обстеження крові було встановлено, що у всіх 96 ДЧХ із домінуючими токсичними проявами СХБІ, зокрема з порушеннями температурного режиму, загалом усі без винятку показники цитолітичної активності токсичних протеомів, що були перевірені, суттєво перевищували норму [10]. Різниця була статистично високозначимою для всіх перевірених протеомів (p < 0,001). При цьому цитолітична активність деяких токсичних протеомів, а саме токсичних протеомів плазми крові, глобулін-асоційованих токсичних протеомів, альбумін-асоційованих токсичних протеомів з частинками розміром 10–200 нм та вільноциркулюючих токсичних протеомів з частинками розміром < 10 нм у дітей (n = 96) була статистично вірогідно вищою (p < 0,05), ніж у дорослих (n = 722). Автоімунна активність деяких протеомів у дітей із СХБІ також була статистично вірогідно вищою (p < 0,05). Це стосувалося таких п’ятьох протеомів, як глобулін-асоційовані токсичні протеоми, вільноциркулюючі токсичні протеоми, глобулін-асоційовані токсичні протеоми з частинками розміром 10–200 нм, альбумін-асоційовані токсичні протеоми з частинками розміром 10–200 нм та вільноциркулюючі токсичні протеоми з частинками розміром 10–200 нм.
У переважної більшості хворих (77/96, або 80,2 %) була виявлена токсемія тяжкого ступеня, у 16/96 (16,7 %) — середньої тяжкості й тільки у 3/96 (3,1 %) — легкого ступеня. Форма інтоксикації була здебільшого компенсованою — у 87/96 (90,6 %) хворих, ще у 9/96 (9,4 %) — у стадії генералізації; декомпенсованих форм інтоксикації у дітей не було виявлено. Токсинонесуча фракція найбільш активних токсичних протеомів у кров’яному руслі в дітей була переважно представлена вільноциркулюючими (32/96, або 33,3 %) та глобулін-асоційованими (30/96, або 31,25 %) протеомами. Серед токсичних протеомів переважали молекули з розміром частинок > 200 нм, які були виявлені у 72/96 (75,0 %) дітей, та розміром 10–200 нм — у 22/96 (22,9 %); ще у 2/96 випадках (2,1 %) розміри протеомів становили < 10 нм. Майже у половині випадків (47/96, або 48,9 %) був встановлений міцний зв’язок протеомів із несучою фракцією, в інших випадках зв’язок був нетривкий (14/96, або 14,6 %) чи взагалі відсутній (35/96, або 36,5 %), що могло пояснювати швидку динамічну зміну клінічного стану дитини від вираженого інтоксикаційного синдрому до майже нормального самопочуття.
Фізіологічна елімінація токсичних протеомів в організмі ДЧХ здійснювалася переважно через макрофагальну систему клітин мезенхімального походження (РЕС) — у 73/96, або 76 % випадків, значно рідше — через печінку (22/96, або 23 %) і лише в окремих випадках (1/96, або 1 %) — через нирки. У переважної більшості ДЧХ із клінічними проявами СХБІ (93/96, або 96,9 %; р > 0,001) встановлений гіперергічний тип реактогенності системної відповіді на токсичні протеоми.
Зміни у периферичній крові ДЧХ із домінуючими клінічними проявами СХБІ мали неспецифічний, але досить типовий характер. Найчастіше, майже у 90–95 % випадків, виявляли відносний і абсолютний лімфоцитоз — від помірного до реального підвищення лімфоцитів у 2–2,5 раза від норми (що зазвичай пояснювали батькам дитини перенесеною вірусною інфекцією), та інколи навіть невелику кількість атипових мононуклеарів (до 5 %). Досить типовим частіше було стабільне зниження рівня гемоглобіну та еритроцитів (у 30–35 % випадків), яке могло триматися роками, незважаючи на неодноразове інтенсивне сучасне лікування анемії. Одним із проявів впливу хронічної інтоксикації на кровотворення було майже стабільне зниження у 25–30 % випадків рівнів лейкоцитів та у 10–15 % — тромбоцитів, при цьому інколи лейкопенія з нейтропенією та тромбоцитопенія могли бути суттєво вираженими й досягати майже критичних показників. Неодноразове призначення у таких випадках найсучасніших препаратів для покращення лейкопоезу і тромбоцитопоезу здебільшого давало тимчасовий і обмежений результат. Ще одним із проявів впливу хронічної інтоксикації бактеріального походження на загальний аналіз крові було підвищення швидкості осідання еритроцитів (ШОЕ) від 20–25 мм/год до 40–50 мм/год, яке могло також тривати роками. При цьому інші показники крові могли залишатися у межах норми. Такий феномен називали синдромом ізольованого підвищення ШОЕ, коли додаткові багаточисленні лабораторні та інструментальні обстеження не дають відповіді на запитання: звідки з’явилося та підвищена ШОЕ? У таких випадках загальний аналіз сечі та УЗД нирок патології не виявляють. І тільки бакпосіви сечі з виділенням уринокультур бактерій і подальше лікування відповідними бактеріальними вакцинами давали змогу прояснити цю діагностично невизначену ситуацію та знизити і навіть нормалізувати ШОЕ.
При визначенні імунного статусу, який дослідили у 2160/3547 (60,1 %) ДЧХ від грудного віку до 14 років обох груп спостереження, було встановлено, що клітинний імунітет переважно був або у межах норми, або навіть частіше перевищував норму. Тільки у 67/2160 (3,1 %) випадках було виявлено незначну клітинну імунну недостатність з вибірковим зниженням рівнів Т-лімфоцитів (СD3+, CD19–), Т-хелперів (СD3+, СD4+, СD8–), Т-супресорів (СD3+, СD4–, СD8+), натуральних кілерів (СD3–, СD56+), цитотоксичних клітин (СD3+, СD56+) та деяких інших. У 1912/2160 (88,5 %) дітей показники клітинного імунітету навіть перевищували вікову норму. Тільки у 157/2160 (7,3 %) дітей було виявлене підвищення циркулюючих імунних комплексів (ЦІК) переважно завдяки дрібно- та середньомолекулярним комплексам. Рівні загальних імуноглобулінів IgA, IgM та IgG, а також С3- і С4-комплементів майже в усіх хворих залишалися в межах норми. Лише у 7/2160 (0,3 %) випадках було встановлено селективну гіпогаммаглобулінемію IgA, яка у 4/7 (57,1 %) дітей майже минула за декілька років спостереження та лікування бактеріальними автовакцинами.
Клітинну імунну недостатність у ДЧХ обох груп спостереження розцінювали як вторинну і значною мірою пов’язану з ендотоксикозом на тлі нефродисбактеріозу/СХБІ. Через 3–6 місяців після початку лікування бактеріальними вакцинами стан імунної відповіді без додаткового призначення імуностимулюючих препаратів зазвичай поліпшувався або навіть нормалізувався. Тобто розвиток захворювань у дітей обох груп спостереження відбувався не внаслідок поганого імунітету, а, навпаки, майже у кожних 9 із 10 ДЧХ останній був наче мобілізований до бою та перевищував норму. Тому головна теза простих пояснень батькам, що їх дитина часто хворіє тому, що в неї «поганий імунітет», не відповідає дійсності. Аналогічний висновок було зроблено при імунологічному обстеженні дітей молодшого шкільного віку з RRD із 6–12 епізодами захворювання на респіраторні інфекції на рік [1]. У більшості випадків імунологічні показники були в межах вікової норми або підвищеними, на основі чого був зроблений висновок, що респіраторні вірусні інфекції зазвичай не є проявом імунодефіциту й поготів не є причиною імунодефіцитів. Імунодефіцитні стани як причина RRD визначені не більше ніж у 10 % дітей.
Так само можна визначити і результати імунологічного дослідження ДЧХ із постійно рецидивуючими гнійно-запальними захворюваннями носоглотки та ВДШ, а також із домінуючими клінічними проявами СХБІ. В обох випадках із загальним імунітетом у дітей все гаразд, і вони так часто хворіють всупереч гарному та міцному імунітету у його звичному розумінні. Багаторічні спостереження за ДЧХ та результатами їхнього лікування дозволяють зробити таке клінічне припущення. При хронічних бактеріальних інфекціях виникає певна імунологічна толерантність: імунна система «гальмує» і не розпізнає живі бактерії, які викликають різні хронічні захворювання. Або в зв’язку з тим, що ці бактерії — філогенетичні симбіоти, які довічно населяють кишечник людини (ентеробактерії, ентерококи), антигенну структуру яких імунна система перестає диференціювати як «чужу» і не чинить їй опору на загальному та місцевому рівнях. Або в зв’язку з тим, що зараження цими бактеріями (стафілококи, стрептококи, які є природними й одними з найпоширеніших інфекцій людського соціуму) відбувається щодня і багаторазово з перших днів життя дитини, що знижує рівень захисного імунологічного бар’єра та викликає своєрідний імунологічний параліч місцевого імунітету на слизових оболонках і загальної імунної відповіді. При вивченні взаємодії вроджених і адаптивних факторів місцевого імунітету в дітей із RRD порівняно з контролем було виявлено розбалансованість цих зв’язків у дітей із RRD [14], що може сприяти розмноженню бактерій.
Це призводить до тривалої, часто довічної персистенції бактерій у різних органах і системах, що проявляється (в умовах існуючих протоколів лікування з постійним використанням антибіотиків) клінічно невиліковними захворюваннями. Застосування антибіотиків тільки погіршує зниження загального та місцевого імунітету, підсилює стан імунологічної толерантності до цих бактерій і легко переводить хронічні бактеріальні захворювання, що виникають переважно ще в дитячому віці, в довічну проблему. Тому імунітет у дітей, що часто хворіють, не поганий, він «сліпий», тому що не бачить ті бактерії, які довічно живуть в організмі людини. І його не можна змінити або покращити, призначаючи імуностимулюючі та імуномодулюючі препарати: вони безсилі покращите те, що взагалі не потребує ніякого покращення. Аналогічного погляду про необґрунтоване призначення препаратів для стимуляції імунітету дітям із RRD дотримуються і деякі інші автори [1]. На їх думку, медикаментозна неспецифічна стимуляція може лише зашкодити дітям, у яких триває дозрівання системного імунітету. Неспецифічні імуномодулятори можуть «розбудити» ті ланки імунітету, які у дитини мають бути в «сплячому» стані, що становить загрозу хронізації інфекції, виникнення автоімунних та онкологічних захворювань.
Додатково у 890/1595 (55,8 %) дітей I групи та 732/1952 (37,5 %) II групи визначали рівень секреторного IgA в слині. Секреторний IgА, окрім слини, знаходиться також у сльозах, поті, молоці, секретах бронхів та шлунково-кишкового тракту й захищає слизові оболонки від інфекційних агентів. Основним фактором розвитку будь-якого захворювання практично завжди є зниження місцевого імунітету, основним показником якого є рівень sIgA, що свідчить про активність секреторних механізмів системи імунітету слизової оболонки. У переважної більшості дітей обох груп спостереження (789/890, або 88,6 % у першій групі та 610/732, або 83,3 % у другій) рівень секреторного IgA в слині значно перевищував нормальні показники, нерідко у 2–3 рази, та залишався підвищеним у процесі лікування і нагляду за дітьми. Незважаючи на таку формальну ознаку підвищення рівня місцевого захисту слизових оболонок завдяки антитілам класу IgА, які повинні зв’язуватися з мікроорганізмами й запобігати їх проникненню з зовнішніх поверхонь у глиб тканин, а також посилювати фагоцитоз антигенів шляхом активації комплементу в альтернативний спосіб, діти продовжували хворіти часто та довго. Певною мірою це підтверджує думку про розбалансованість вроджених і адаптивних факторів місцевого імунітету в дітей із RRD [14], що може сприяти розмноженню бактерій.
Отже, достатньо високий рівень секреторного IgА в слині у ДЧХ не запобігав персистенції бактерій на слизовій оболонці носоротоглотки та не попереджав їх патогенні властивості з рецидивуючими гнійно-запальними захворюваннями. Крім того, достатній і до того ж високий рівень IgА в організмі мав перешкоджати розвитку IgE-залежних алергічних реакцій. Рівень IgE визначали у динаміці в усіх ДЧХ обох груп спостереження. У більше ніж половини дітей I групи (858/1595, або 53,8 %) та майже у половини дітей II групи (950/1952, або 48,7 %) рівень IgE перевищував норму від 1,5–2 до десятків разів. При цьому клінічні ознаки алергічних захворювань носоглотки (алергічний риніт, сінна лихоманка, сезонна алергія, поліноз, алергічні фарингіт, кон’юнктивіт) мали лише 363/858, або 42,3 % дітей I групи та 358/950, або 37,7 % дітей II групи з підвищеними рівнями IgE. Крім того, нерідко діти з постійно персистуючими бактеріальними інфекціями носоглотки та клінічними проявами алергічних захворювань мали нормальні рівні загального IgE. У 121/3547 (3,4 %) дітей з обох груп спостереження ДЧХ рівень загального IgE перевищував 1000 МО/мл, через що багатьом із них був попередньо встановлений діагноз гіпер-IgE-синдрому. Відомо, що гіпер-IgE-синдром (або синдром Джоба) є спадковим поєднанням комбінованого гуморального та клітинного імунодефіциту Т- та В-клітин, який характеризується рецидивуючими тяжкими стафілококовими ураженнями шкіри (фурункули, абсцеси, флегмони та ін.), інфекціями навколоносових пазух і легеневими інфекціями та тяжким суцільним еозинофільним дерматитом із нестерпним свербінням шкіри. Гіпер-IgE-синдром розвивається у ранньому дитячому віці. Діагноз встановлюють на підставі вимірювання рівня IgE в сироватці крові. Стандартні методи лікування зазвичай малоефективні, тому лікування скоріше має паліативний характер. Але лікування гіпер-IgE-синдрому не як спадкової хвороби, а як тяжкої хронічної постійно рецидивуючої поліетіологічної бактеріальної інфекції, викликаної домінуючим S. aureus, без використання антибіотиків, але із застосуванням бактеріальних вакцин дозволило майже в усіх випадках досягнути гіпоалергенного ефекту з суттєвим зниженням зашкалених рівнів IgE в сироватці крові та отримати позитивний клінічний результат на межі повного одужання хворобливої дитини. Нижче наводимо приклад 1 такого випадку.
Приклад 1
Дитину Асхаба вперше було оглянуто у клініці 27.08.2012 р., коли батьки привезли його до Києва з Махачкали (Республіка Дагестан). Вік дитини становив 1 рік 6 місяців; раніше встановлений (м. Москва, РФ) діагноз «гіпер-IgE-синдром». Упродовж року (з 6 місяців до звернення у клініку в м. Києві) дитина перебувала під наглядом і неодноразово проходила відповідне протокольне лікування з багаторазовим призначенням різних антибіотиків у спеціалізованому медичному закладі м. Москви. Позитивний клінічний результат практично був відсутній: стан дитини продовжував погіршуватись, стафілококова хвороба з гнійними ускладненнями безперервно прогресувала, а рівень загального IgE за рік зріс із 1470 до 2510 МО/мл. Головною скаргою батьків був постійно рецидивуючий тотальний фурункульоз та/або абсцеси обличчя, голови, тулуба, кінцівок та майже тотальний сверблячий висип на шкірі.
При обстеженні в клініці були виявлені поліетіологічні вогнища хронічної бактеріальної інфекції в носоглотці (з домінуванням Staphylococcus aureus) та нирках (із домінуванням ентерококів та клебсієли). Крім того, додатково було встановлено внутрішньоутробне інфікування цитомегаловірусом (CMV), який залишався у стадії активної реплікації вірусу (позитивні ПЛР-тести на ДНК CMV у слині та сечі), що було головним провокуючим фактором імуносупресії для такого агресивного перебігу бактеріальних інфекцій. Жодної вади клітинного та/або гуморального імунітету виявлено не було: 23.08.2012 р. рівень Т-клітин становив 59 %, або 3537,05 • 106/л клітин, В-клітин — 6 %, або 359,7 • 106/л (у межах норми); IgА — 0,58 г/л, IgМ — 1,24 г/л, IgG — 10,2 г/л. Рівень загального IgE на початку лікування у клініці був 2250 МО/мл. За 2 роки (до серпня 2014 р.) було проведено кілька курсів імунізації стафілококовою вакциною, сумарно — 35 ін’єкцій та 4 курси імунізації бактеріальними моно-, дво- та полівалентними вакцинами з авто- та депонованими штамами. З вересня 2014 р. рецидиви фурункульозу припинилися, а до 21.06.2015 р. (дата чергового відвідування клініки) батьки відзначали лише рідкісну появу поверхневої піодермії та фурункулів-еквівалентів (недозріваючих фурункулів). Із 2016 р. епізоди гнійного ураження шкіри взагалі припинилися, хоча ще близько 2 років турбували рецидиви гнійних лакунарних ангін як один із клінічних проявів хронічної стафілококової інфекції (мигдалини не видаляли). За цей час додатково було проведено імунізацію стафілококовою вакциною з 12 ін’єкцій (сумарно — 47). Останнє відвідування клініки відбулося 12 січня 2018 р.: дитина клінічно здорова, прояви «гіпер-IgE-синдрому» відсутні, рівень розвитку відповідає віку, стан клітинного імунітету навіть вищий за норму, гуморального — в межах норми, рівень загального IgE становив 491 МО/мл. Наступний дзвінок вдячного батька відбувся перед новим 2021 р.: хлопчику майже 10 років, скарг на здоров’я дитини немає: клінічно здоровий, займається спортом, рівень загального IgE у межах вікової норми.
Результати ІФА- та ПЛР-обстеження ДЧХ обох груп спостереження на віруси герпесу (HSV 1/2, VZV, EBV, CMV, HHV-6, HHV-7, HHV-8) однозначно довели відсутність жодного випадку герпетичної етіології виникнення частих та/або повторних захворювань у дітей різного віку. До того ж навіть етіологічний герпетичний мікст при рецидивуючих респіраторних та бактеріальних інфекціях виявився нікчемним, про що свідчили клінічно неефективні неодноразові спроби противірусного лікування цих дітей від HSV, EBV, HHV-6, HHV-7 та HHV-8 на попередніх етапах звернення в інші медичні заклади. При обстеженні 3547 ДЧХ, які перебували під нашим наглядом, не було виявлено жодного випадку віремії, викликаної вірусами герпесу HSV 1/2, EBV, HHV-6, HHV-7 та HHV-8. А при контрольному ПЛР-обстеженні крові дітей, у яких начебто був напередодні виявлений один чи навіть декілька із зазначених вірусів у крові, отримували негативний результат. При цьому попередній позитивний результат зазвичай дітям видавала одна і та сама лабораторія. Найчастіше помилкова лабораторна та клінічна гіпердіагностика стосувалася вірусу Епштейна — Барр (EBV), тому зупинимось детально саме на цьому вірусі.
Хронічне інфікування EBV було виявлено у 197/862 (22,8 %) ДЧХ у обох групах спостереження віком до 3 років; у 638/1295 (49,3 %) — віком від 3 до 7 років та у 1164/1390 (83,7 %) дітей шкільного віку — від 7 до 14 років. На підставі системного ПЛР-моніторингу крові та слини на ДНК EBV, умови якого були викладені значно раніше [12], жодного випадку доказового підтвердження головної чи мікст-етіологічної ролі цього вірусу у виникненні клінічних симптомів у ДЧХ не встановлено. При цьому було виявлено, що серед ДЧХ віком до 3 років із супутнім хронічним інфікуванням EBV вірус у слині був виявлений у 54/197 (27,4 %) дітей; віком від 3 до 7 років — у 163/638 (25,5 %) та віком від 7 до 14 років — у 277/1164 (23,8 %) дітей. У тих дітей, які майже постійно виділяли вірус зі слиною, клінічні прояви хронічної EBV-інфекції були або зовсім відсутніми, або у разі їх начебто наявності вони мали зовсім інше походження і були пов’язані з СХБІ. Тому жодній дитині в обох групах спостереження, незважаючи на наявність підтвердженої реплікації вірусу з його виділенням зі слиною, не призначали противірусного лікування. А у тих випадках, коли воно вже було призначено раніше, скасовували через непотрібність.
Слід наголосити, що при постійному використанні в клініці Маркова кількісних тест-систем ПЛР для визначення ДНК EBV із досить низьким порогом чутливості (на рівні 500 копій ДНК/мл) нерідко у дітей виявляли дуже велику кількість копій ДНК EBV у слині — від 500 тис. до кількох мільйонів, а в деяких випадках — понад 10 млн копій ДНК/мл. Такі зовні жахливі позитивні результати ПЛР-тестів через декілька тижнів лише із плином часу і взагалі без усякого противірусного лікування знижувалися до незначної кількості копій або навіть ставали повністю негативними. Цей стан нешкідливої реплікативної активності EBV із визначенням вірусу в слині та відсутністю у крові розглядали як здорове вірусовиділення зі слиною, що не потребує противірусного лікування. Таке саме здорове виділення вірусів герпесу зі слиною стосувалося і вірусів HHV-6, HHV-7 та HHV-8, які дарма та ще неодноразово намагалися лікувати у ДЧХ, при цьому без усякої позитивної клінічної відповіді.
Окремо треба розглянути роль CMV у клінічному стані дітей, що часто хворіють. Серед 3547 ДЧХ обох груп спостереження клінічно безсимптомне або малосимптомне (переважно різні затримки розвитку) внутрішньоутробне інфікування (ВУІ) CMV було доволі невипадковим та верифіковано у 657/3547 (18,5 %) дітей. Внутрішньоутробне інфікування CMV встановлювали на підставі виявлення вірусної ДНК у слині та/чи в сечі, дуже рідко — у крові переважно в дітей перших 6 місяців життя, які зазвичай потребували стаціонарного лікування з внутрішньовенним використанням ганцикловіру і не входили до наших груп спостереження ДЧХ. Після 6 місяців життя віремію майже не фіксували або у мінімальному вигляді на межі слідової кількості (менше 500 копій ДНК/мл). Треба зазначити, що вірус виявляли в дітей у слині та сечі тільки у разі внутрішньоутробного інфікування, що було встановлено у майже 80 % дітей обох груп (524/657, або 79,8 %). Коли первинне зараження відбувалося з молоком матері після народження дитини (133/657, або 20,2 %), реплікативних форм хронічної CMV-інфекції не виявляли: вірус (на відміну від EBV) в імунокомпетентних дітей залишався у первинно латентному стані. Такі діти майже не потребували противірусної терапії: лише у 47/657 (7,1 %) випадках внаслідок суттєвих затримок психофізичного та мовленнєвого розвитку дітям проводили противірусну терапію за редукованою схемою без ганцикловіру [15]. Головні ризики для ДЧХ із клінічно безсимптомним внутрішньоутробним інфікуванням CMV лежали в площині поствакцинальних уражень ЦНС реактивованим після планового щеплення вірусом, особливо вакцинами із живим збудником. Тому всі діти, а поготів ДЧХ, перед плановими щепленнями мусять бути перевіреними на наявність/відсутність вродженої CMV-інфекції з обов’язковим відтермінуванням планових щеплень на період реплікативної активності вірусу.
Лікування всіх 3547 ДЧХ обох груп спостереження проводили з використанням бактеріальних автовакцин. Батьки певної частини недужих дітей (94/1595, або 5,9 % І групи спостереження та 122/1952, або 6,3 % ІІ групи, загалом — 216/3547, або 6,1 %) після першого циклу лікування більше не звертались у клініку на повторне контрольне обстеження та зникали з поля зору, тому їх не включали до групи статистичної обробки результатів лікування. Ще до групи пролікованих автовакцинами хворих не були включені 88/1595, або 5,5 % дітей І групи та 84/1952, або 4,3 % ІІ групи (загалом — 172/3547, або 4,8 %), яким під час імунізації бактеріальними вакцинами за різних обставин були одночасно призначені антибіотики. Отже, 182/1595, або 11,4 % ДЧХ І групи та 206/1952, або 10,6 % ІІ групи (загалом — 388/3547, або 10,9 %) не були зараховані при статистичній обробці отриманих результатів. Тобто такими, що пройшли лікування, наслідки якого можна було вважати за встановлені та такі, що не були пов’язані із супутнім прийомом антибактеріальних препаратів, були 3159/3547, або 89,1 % дітей (1413/1595, або 88,6 % І групи та 1746/1952, або 89,4 % ІІ групи).
Як зазначено у попередніх повідомленнях [11], був встановлений чіткий зв’язок між виникненням нефродисбактеріозу та СХБІ з порушеннями температурного режиму і попереднім прийомом антибіотиків, які призначали зазвичай з метою «нормалізації температури». Так, серед ДЧХ ІІ групи з переважно токсичними проявами захворювання антибіотики на попередніх етапах лікування отримували 1780/1952, або 91,2 %. Як з’ясувалося, те саме можна було казати і про дітей І групи з домінуючими вогнищами хронічної бактеріальної інфекції у носоглотці, роті та ВДШ: 1553/1595, або 97,4 % з них отримували раніше і неодноразово лікування антибіотиками різних груп.
Не менше ніж у 2/3 недужих ДЧХ обох груп спостереження (2404/3547, або 67,8 %) на попередніх етапах лікування можна було констатувати синдром поліпрагмазії з призначенням їм понад 5, а зазвичай — понад 10 препаратів одночасно. Але все було марно: стан недужих після призначення їм такої кількості препаратів «на чолі» з антибіотиками поліпшувався на короткий час, до чергового близького загострення, або взагалі не змінювався. Привертала увагу клінічна особливість лікування ДЧХ антибіотиками: у зв’язку з наступним рецидивом чи загостренням захворювання періоди «світлих» проміжків між попереднім та наступним курсами лікування весь час поступово скорочувалися.
Лікування
Лікування дітей, що часто хворіють, обох груп спостереження бактеріальними автовакцинами здійснювали відповідно до локальних протоколів, затверджених у клініці «Вітацелл» і клініці Маркова та зареєстрованих Державною службою інтелектуальної власності України [15]. Виготовлення термічно інактивованих бактеріальних вакцин із виділених культуральним методом автоштамів бактерій проводили у бактеріологічному відділі лабораторії клініки Маркова за вдосконаленою стандартною методикою, викладеною у наказі МОЗ України № 317 від 29.12.1994 р. «Про застосування автовакцин» та відповідно до першого отриманого патенту на спосіб виготовлення та лікування стафілококовою вакциною «Стафіло-Примавак®» [16]. Для контролю стерильності зразки вакцини висівали на поживний бульйон та інкубували у термостаті при температурі 37 °С протягом 24–48 годин. Бактеріальні автовакцини не мали у своєму складі антибіотиків та консервантів. Строк зберігання автовакцин при температурі 6–8 °С встановлювали на рівні до 6 місяців.
Схеми лікування завжди були індивідуальними, але мали і загальні риси. Один цикл складався з 2–3 курсів імунізації бактеріальними вакцинами. Один курс імунізації включав 10 або 12 підшкірних ін’єкцій у наростаючому дозуванні упродовж 19–21 дня. Між курсами витримували інтервал від 3 до 4 тижнів. Цикл лікування загалом тривав від 70 до 110 днів залежно від кількості курсів. Інтервали між циклами лікування зазвичай витримували упродовж 3 місяців. З урахуванням виділених з носа, горла, мокроти, слизу з носа, з інших локальних вогнищ, а також із сечі автоштамів бактерій, загалом дотримувалися такої послідовності їх призначення: спочатку моновалентна вакцина з одного виду бактерій, потім — двовалентна і за нею — полівалентна з додаванням накопичених під час попереднього та моніторингових обстежень та збережених автоштамів бактерій. Кількість циклів імунізації залежала від результатів попередньо проведеного лікування, а саме наявності/відсутності клінічних (насамперед — рецидивуючих гнійно-запальних процесів та підвищеної температури), мікроскопічних та бактеріологічних проявів СХБІ, за якими лікування саме і було призначено.
Клінічна ефективність проведеного лікування ДЧХ із використанням бактеріальних автовакцин наведена у табл. 2.
/15.jpg)
Згідно з результатами, наведеними у табл. 2, загальний успіх після завершення трьох циклів імунізації бактеріальними автовакцинами серед ДЧХ із домінуючими гнійно-запальними захворюваннями носоротоглотки та ВДШ (І група спостереження), які пройшли таке лікування та залишилися під катамнестичним спостереженням, був досягнутий у 1373/1413 (97,2 %) дітей та у 1720/1746 (98,5 %) ДЧХ ІІ групи з домінуючими токсичними проявами, насамперед із підвищеною температурою, не пов’язаною з гострими гнійно-запальними станами чи їх рецидивами. Тобто загалом 3093/3159, або 97,9 % дітей, що часто хворіють, повністю одужали упродовж 6–24 місяців від початку лікування бактеріальними автовакцинами без використання антибіотиків. При цьому вже після першого циклу вакцинації, що складався з 2–3 курсів, у більше ніж половини дітей І групи (740/1413, або 52,4 %) «підсихав» ніс, припинявся кашель, зникали загострення ринітів, отитів, стоматитів та ін. Серед дітей ІІ групи температура повністю нормалізувалася упродовж 6 місяців від початку лікування у більше ніж 2/3 хворих — 1178/1746, або 67,5 %. У деяких непоодиноких випадках нормалізацію температури реєстрували вже після 2–3 ін’єкцій першої вакцини. За нашими спостереженнями, ліпший та більш швидкий результат лікування бактеріальними автовакцинами знаходився у прямій залежності від кількості попередніх курсів лікування дитини антибіотиками: чим менше і рідше напередодні дитину намагалися «вилікувати» антибіотиками, тим скоріше вона після зміни парадигми лікування дійсно одужувала.
Батькам та і самій дитині інколи було важко повірити в те, що період частих захворювань, які здавалися нескінченними, з їх болісним очікуванням дійсно завершився, як у наступному прикладі 2.
Приклад 2
Дитина К., 7 років. Її щасливі батьки завітали до клініки у червні 2018 року на планову чергову консультацію: дівчинка закінчила 1-й клас, скарг немає, клінічно здорова. Перший раз вони звернулися до клініки у розгубленому стані близько 1,5 року тому (у грудні 2016 р.) з типовою скаргою: дитина часто хворіє (майже 1–2 рази на місяць). Був встановлений діагноз «хронічна стафілококова інфекція»: носійство в носоглотці, хронічний риносинусит із частим затяжним нежитем, закладеністю носа та постійним виділенням гнійного кольорового слизу по задній стінці глотки, аденоїди I–II ст., хронічний тонзиліт із рецидивуючими ангінами, повторні епізоди отиту у віддаленому та найближчому анамнезі, рецидивуючі ларинготрахеїти та бронхіти з обструктивним синдромом із стійким нападоподібним кашлюкоподібним кашлем, часті застудні захворювання. Повторні багаторазові попередні курси лікування антибіотиками (понад 14–15 разів, зокрема з урахуванням чутливості виділених при бакпосівах із носоглотки штамів Staphylococcus aureus) із грудного віку давали короткочасний клінічний ефект з подальшими, все більш ранніми рецидивами захворювання. Батькам наполегливо рекомендували видалити дитині мигдалини та аденоїди. За 1,5 року спостереження та лікування в клініці було проведено 2 курси імунізації стафілококовою вакциною «Стафіло-Примавак®» (сумарно — 22 ін’єкцій) та два курси — полівалентною вакциною з додаванням виділених автоштамів S. аureus, Str. рyogenes та Str. pneumoniae по 10 ін’єкцій в кожному у віковому дозуванні. Антибіотики більше не використовували. Хвилеподібний перебіг реконвалесцентного періоду (з періодичними епізодами клінічно все менш виражених загострень) завершився повним одужанням упродовж 12–15 місяців. Аденоїди зникли, хронічний тонзиліт більше не нагадував про себе ангінами. Пряма мова дитини після завершення лікування: «Мамо, чому я зараз не хворію, коли всі хворіють? Мамо, я вже втомилася ходити до школи».
Інколи у дітей ІІ групи після певного часу нормальної температури вона знову підвищувалася до субфебрильних значень, що було пов’язано зі зміною домінуючого штаму бактерій. Саме поліетіологічною структурою збудників нефродисбактеріозу/СХБІ з порушеннями температурного режиму (табл. 1) найімовірніше було обумовлено збереження, а частіше — повернення температури у 26/1746 (1,5 %) випадках затяжного субфебрилітету через 2–5 років після завершення лікування та клінічного одужання з повторним виділенням нових штамів уринокультур бактерій, що потребувало додаткового курсу/циклу імунізації бактеріальними автовакцинами іншого складу.
Багатьом пацієнтам як причину виникнення субфебрилітету називали наявність у них хронічного тонзиліту. Дуже часто, особливо після виділення у них із горла золотистого стафілококу (S. aureus) та повної неефективності його лікування антибіотиками, частіше з метою позбутися підвищеної температури, рекомендували видалення мигдаликів, «бо іншого шляху немає». Та дарма: не потрібна у цих випадках тонзилектомія внаслідок затяжного субфебрилітету, з усіма можливими небажаними наслідками хірургічного втручання, була проведена у 126/2685 (4,7 %) дітей шкільного віку та віком від 3 до 7 років, зокрема 81/1181 (6,8 %) дитині І групи та 45/1504 (3 %) — ІІ групи. Однак із зрозумілих причин це майже не мало позитивного клінічного впливу ані на температуру, що зберігалася після операції у 42/45 (93,3%) дітей, ані на гнійно-запальні захворювання носоротоглотки та ВДШ. Інфекція зазвичай або підіймалася вище у навколоносові пазухи, або спускалася нижче дихальними шляхами. Гільйотина як метод лікування хронічних бактеріальних інфекцій ніколи не буде ефективною та виправданою. Те ж саме стосується і патологічно збільшеної глоткової (носоглоткової) мигдалини, що більше відомо як аденоїди, через гіперплазію її лімфоїдної тканини. Неодноразово на прийом зверталися батьки з дитиною, якій двічі, а інколи навіть тричі видаляли аденоїди, але від цього вона не ставала здоровішою та не переставала часто хворіти. Водночас у ДЧХ із аденоїдами 1–2-го ступеня після лікування бактеріальними вакцинами та припинення постійних рецидивів гнійно-запальних вогнищ у носоглотці минала гіперплазія лімфоїдної тканини носоглоткової мигдалини, яка набувала нормальних розмірів без оперативного втручання.
Вакцини призначали пацієнтам з обтяженим алергічним анамнезом: при їх використанні був відсутній розвиток побічних алергічних реакцій. До того ж введення бактеріальних вакцин зазвичай призводило до вираженого гіпоалергенного ефекту з поступовим істотним зниженням підвищених до початку лікування рівнів загального та специфічних IgE. Це розглядали як додаткове підтвердження бактеріально-асоційованого, а не вірус-залежного характеру більшості випадків алергії у недужих дітей, що часто хворіють.
Результати бактеріологічного обстеження здорових дітей та дорослих, що становили три контрольні групи, свідчили, що після народження дитини зараження золотистим стафілококом має майже тотальний, з епідеміологічної точки зору — фізіологічний та нездоланний характер і відбувається у перші дні життя. При цьому важко сказати, де головним чином відбувається зараження: у пологовому будинку чи у рідній домівці. Та це і не принципово, тому що такого зараження, з урахуванням домінуючого повітряно-крапельного шляху інфікування стафілококом, уникнути неможливо. До того ж у людини, які живе у соціумі, таке рекурентне зараження відбувається багато разів на день. Здебільшого стафілокок у дітей різного віку та дорослих перебуває у стані коменсалізму — тобто тимчасово здорового носійства та не проявляє своїх патогенних властивостей. Доля кожної дитини та дорослого, так саме, як і самого стафілококу, та їх подальших стосунків складається по-різному. Хтось усе життя, залишаючись носієм стафілокока, не має проблем зі здоров’ям, пов’язаним із цією інфекцією. А хтось усе життя платить своєрідну данину за агресивне ставлення лікарів до цієї первинно коменсальної бактерії. При цьому, якщо багатьом дітям, як вважають непоодинокі дослідники, фізіологічно та імунологічно потрібно 6–10 епізодів ГРВІ на рік, щоб у них сформувався імунітет проти різних респіраторних вірусів, то проти стафілококу імунітет, на жаль, не формується, особливо після початку лікування таких дітей антибіотиками.
І це не «поганий імунітет» або стан імунодефіциту. Це імунітет, який страждає на «курячу сліпоту», тому що він у нормальному та навіть активованому стані взагалі «не бачить» ворога — золотистого стафілокока у носоглотці чи бактерій у нирках; тому що зустрівся з ними з першої миті після народження дитини і досі не розуміє: чи то друг, чи то ворог. Бактеріальні вакцини допомагають вирішити це питання, знімаючи із стафілокока та інших первинно коменсальних бактерій, які набули патогенні властивості та оселилися у невідповідному для них місці, їх захисні оболонки у прямому та переносному сенсі цього дійства. Доступність антигенних маркерів цих бактерій, що були приховані під ліпопротеїновими оболонками, для розпізнавання імунною системою організму дитини принципово змінює ефективність імунної відповіді на їх набуті патогенні властивості. Без застосування імуностимулюючих та імуномодулюючих препаратів, призначення яких у цьому разі не є ефективним із патогенетичної та клінічної точки зору.
Після лікування бактеріальних інфекцій носоротоглотки бактеріальними автовакцинами, що формує новий здоровий мікробіом та з клінічної точки зору відновлює місцевий імунітет, змінюються клінічні терміни перебігу ГРВІ у дітей із RRD. По-перше, всі катаральні явища закінчуються, як і повинно, тільки почавшись, за 2–4 дні, а по-друге, їх стає у 2–3 рази менше.
Зусилля, спрямовані на зміну мікробіому носа, глотки, навколоносових пазух та ВДШ у групі ДЧХ, у першу чергу повинні бути направлені на зниження вірулентності та гемолітичної активності S. aureus, а також його можливості здійснювати надлишкову колонізацію слизових оболонок, тобто фактично переведення його в стан коменсала, нешкідливого для організму дитини. І це має бути головною терапевтичною тактикою щодо такого домінуючого патогену, як S. аureus. Це логічно: тактика «вбивства» шляхом призначення антибіотиків бактерії, від якої немає епідеміологічного захисту і зараження якою відбувається в усіх без винятку дітей і дорослих повітряно-крапельним шляхом щоденно по декілька разів за добу, патогенетично неконструктивна, тому що немає цьому кінця-краю через постійне реінфікування та веде у глухий клініко-терапевтичний кут. Треба наголосити, що чим більше і частіше використовують антибіотики з намаганням «вбити» стафілокок, тим більше він віддаляється від свого можливого стану коменсалізму й тільки нарощує свої вірулентні та патогенні властивості. А от використання бактеріальних вакцин із різним механізмом введення (ін’єкційний, аерозольний, сублінгвальний, пероральний та ін.) дозволяє повернути, здавалося б, агресивний S. aureus на мирний шлях нешкідливого існування в організмі людини.
Треба також сказати про вірусну складову мікробіому слизових оболонок носоглотки та навколоносових пазух. Відомо, що існує винятково паразитичний варіант симбіотичних взаємовідносин вірусів з організмом людини [3], через що віруси людини навряд чи можуть бути постійними учасниками мікробіоценозів і може йтися лише про їх транзиторну участь у регулюванні мікробіому слизової оболонки носоглотки та ВДШ. Окремо від людських вірусів розташовані віруси бактерій — бактеріофаги, які можуть впливати на регулювання мікробіоценозу, зокрема завдяки профагам і з позицій використання фагів/профагів як маркерів/регуляторів функціонування мікробіоценозів [17]. Стає зрозумілим відсутність помітної користі від частого лікування противірусними препаратами та висока ефективність використання бактеріофагів разом із бактеріальними вакцинами у комплексному лікуванні дітей, що часто хворіють. Слід наголосити: якщо гострі та рекурентні респіраторні захворювання (RRD) вірусного походження, що формують перший клінічний образ ДЧХ, в епідеміологічному плані більше пов’язані з новим чи додатковим зараженням зовні, то рецидивуючі гнійно-запальні захворювання та домінуючі токсичні прояви у дітей із другим та третім клінічними образами відповідно зазвичай розвиваються як загострення хронічної ендогенної інфекції бактеріального походження.
Завершальна репліка перед закриттям завіси.
То хіба все, що ми розповіли про дітей, що часто хворіють, можна вкласти у прокрустове ліжко такого абортивного терміну, як RRD? Тобто рекурентні респіраторні захворювання (Recurrent Respiratory Diseases, RRD) дитини? США та Західна Європа не визнають термін ДЧХ, тому усі вимушено почали використовувати термін RRD. Але куди ж подіти дітей із постійно рецидивуючими бактеріальними гайморитами, етмоїдитами та іншими риносинуситами, з часто рецидивуючими отитами, кон’юнктивітами, стоматитами, фурункульозом та іншими гнійно-запальними захворюваннями шкіри та слизових оболонок, які хворіють майже щомісяця? А дітей з постійним затяжним субфебрилітетом або багаторазовими фебрильними атаками? Хіба їх можна у здоровому розумі віднести до групи дітей із RRD або до дітей, що нечасто хворіють? Термін RRD, на наш погляд, значно звужує рамки патології, яка робить із потенційно здорової дитини таку, що часто хворіє, і може розглядатися лише як придатний для певного відсотка ДЧХ із частими та рецидивуючими ГРВІ. У клінічній практиці ще використовують термін «recurrence infections», тобто «повторні, рецидивні інфекції», що, на наш погляд, значно більше підходить для визначення стану ДЧХ, ніж RRD. А відносно визнання чи невизнання, за великим рахунком, байдуже. Нам своє робити. Поготів, що ми вже маємо відповідний приклад «невизнання»: США та Західна Європа ставляться з неповним розумінням до терміну «дисбактеріоз кишечника». А до нас щодня звертаються батьки дітей, клінічний стан яких абсолютно відповідає саме такому діагнозу. Та і практичний досвід лікарів пострадянського простору, вихованих у багатьох поколіннях у зв’язку з «інструментальною бідністю» на клінічній домінанті, навряд чи поступиться технократичній загостреності лікарів із світу «цивілізованої» медицини, які звикли більше покладатися на протокол та алгоритм, аніж на власний досвід та клінічне мислення.
Підсумовуючи наші спостереження та викладений матеріал, треба зазначити, що важко певно відокремити один клінічний образ ДЧХ від іншого. Симптоми RRD та рецидивуючих гнійно-запальних захворювань носоротоглотки та ВДШ разом із токсичними проявами СХБІ, що виникає на тлі нефродисбактеріозу, сплітаються у кожної дитини майже в неповторну картину з тимчасово або тривало домінуючими ознаками. Але, якщо загубити хоча б жоден, мальовнича палітра симптомів клінічного образу постійно недужих дітей буде не повною, багато з них просто випадуть з поля зору та на них не будуть зважати. Сила діагностики та лікування таких дітей полягає у широкому погляді на цю проблему без штучних обмежень і купюр.
Висновок
Серед 3547 ДЧХ в обох групах спостереження в результаті бактеріологічного обстеження теплої сечі у 1933/3547 (54,5 %) випадках було виділено по 1 культурі бактерій, ще у 1462/3547 (41,2 %) дітей було виділено одночасно по 2 культури різних бактерій, по 3 культури з однієї порції сечі виділяли дуже рідко — усього у 152/3547 (4,3 %) випадках. Тобто загалом було виділено 5313 штамів різних бактерій, що розглядали як бактеріологічне підтвердження наявності у цих пацієнтів або, зазвичай, нефродисбактеріозу, або встановлення етіологічного збудника хронічного пієлонефриту. Вогнище хронічної бактеріальної інфекції у нирках, так само як і СХБІ, до якого воно призводило, завжди мало поліетіологічне походження, а при бактеріологічному обстеженні переважно виділяли домінуючий наразі збудник. Отже, у дітей із переважно хронічними, часто рецидивуючими гнійно-запальними захворюваннями носоротоглотки та ВДШ, як і у дітей із порушеннями температурного режиму та іншими проявами СХБІ завжди виявляли вогнище хронічної бактеріальної інфекції у нирках.
Головним чинником виникнення нефродисбактеріозу в ДЧХ обох груп спостереження визначили ентерококи, рівень виділення яких із сечі порівняно з іншими бактеріями значно переважав і становив 60,8 %, або 2158/3547 штамів. Другою за частотою виявляли кишкову паличку (Escherichia coli), яка була виділена від 32,5 % дітей (1154/3547). Таким чином, саме ці дві бактерії — ентерококи та кишкова паличка — були головними домінуючими етіологічними чинниками виникнення нефродисбактеріозу/СХБІ в ДЧХ обох груп і становили майже 2/3 (3312/5313, або 63 %) від усіх ізольованих штамів уринокультур та були виділені загалом у 3312/3547 (93,4 %) дітей.
Наступну велику групу виділених із сечі бактерій у ДЧХ обох клінічних образів, що знаходилися під спостереженням, становили стафілококи: сумарно було 849/5313 (16 %) штамів, ізольованих від 23,9 % (849/3547) хворих дітей. При цьому S. aureus виділяли у 3,2 раза частіше, ніж S. haemolyticus: 649 штамів від 3547 (18,3 %) хворих та 200/3547 (5,63 %) відповідно. Також S. aureus у 1,8 раза частіше виділяли у дітей II групи з домінуючими клінічними проявами СХБІ порівняно з дітьми I групи: 415/1952 (21,3 %) і 234/1595 (14,7 %) відповідно. Значно рідше порівняно із стафілококами виділяли з сечі стрептококи, а саме Streptococcus pyogenes: 14/1595 (0,87 %) штамів у дітей I групи та 18/1952 (0,92 %) у дітей II групи.
До домінуючих штамів бактерій, виділених із сечі у ДЧХ, можна було також віднести клебсієли, які були виділені у 538/3547 (13,56 %) хворих, при цьому значно частіше ізолювали Klebsiella pneumonia (493/3547, або 12,3 %) порівняно з Klebsiella oxytoca (45/3547, або 1,26 %); значно рідше виділяли протеї — у 162/3547 (4,55 %) випадках (зазвичай — Proteus mirabilis та Proteus vulgaris, лише в поодиноких випадках — Proteus peneri), морганели (Morganella morganii) — у 125/3547, або 3,55 % хворих та ентеробактери — у 96/3547, або 2,7 % хворих (майже порівну — Enterobacter aerogenes і Enterobacter cloacae); незначну групу виділених уринокультур становили ацинетобактери, виділені у 106/3547, або майже 3 % дітей (переважно завдяки Acinetobacter lvoffii) та цитробактери — у 41/3547, або 1,15 % дітей (у 3 рази частіше — Citrobacter freundii); до дуже рідкісних ізолятів уринокультур можна було віднести Alcaligenes faecalis (16/3547, або 0,45 %), а також гафнії, серації та деякі інші; ще у 19/3547 (0,53 %) дітей із сечі була виділена синьогнійна паличка (Pseudomonas aeruginosa) як етіологічно внутрішньолікарняна інфекція після хірургічного втручання та/або багаторазових інвазійних отоларингологічних, урологічних та інших оглядів, процедур і маніпуляцій.
Серед 205 клінічно здорових малюків грудного віку (від 3 до 12 місяців) контрольної групи 1 нефродисбактеріоз був виявлений у 110/205 (53,7 %) випадках, що розглядали як своєрідну «плату за підгузки», а серед 70 клінічно здорових дорослих контрольної групи 2 — лише у 5/70 (7,1 %) випадках, що було істотно менше порівняно з результатами бактеріологічного обстеження сечі в дітей, що часто хворіють, із різними діагнозами.
При бактеріологічному обстеженні мазків із носа і глотки, з рота та бляшок стоматиту, із слизу з носа та харкотиння у дітей обох груп домінуюча частота виявлення S. aureus суттєво не відрізнялась: в групі 1 він сумарно був виявлений із мазків різних локацій у 1568/1595, або 98,3 % дітей, у групі 2 — в 1899/1952, або 97,3 % (загалом — у 3467/3547, або 97,7 % ДЧХ, які перебували під наглядом) та займав домінуючу позицію у цьому носоротоглотковому мікробіомі. Частота виявлення золотистого стафілокока у ДЧХ обох груп залишалася стабільною впродовж року та суттєво не змінювалася залежно від частоти ГРЗ та ГРВІ у весняно-літній чи осінньо-зимовий період.
Додатково/одночасно із стафілококами (включно з рідкісною ідентифікацією, окрім S. aureus, ще S. haemolyticus) також виділяли стрептококи: переважно Streptococcus pyogenes — у 435/1595 (27,3 %) дітей групи 1 та у 420/1952 (21,5 %) — групи 2 та рідше Streptococcus pneumoniae — у 245/1595 (15,4 %) та у 267/1952 (13,7 %) відповідно. У невеликій кількості в дітей обох груп — у 230/1595 (14,4 %) першої та у 193/1952 (9,9 %) другої одночасно (рідше окремо) із стафілококами та стрептококами виділяли такі патогенні, умовно-патогенні та сапрофітні бактерії, як ентерококи (головним чином Enterococcus faecalis), Escherichia coli, клебсієли (зазвичай Klebsiella pneumoniae), протеї, ентеробактери, у поодиноких випадках — ацинетобактери, цитробактери і Alcaligenes faecalis, синьогнійну паличку (Pseudomonas aeruginosa), а також коринебактерії, нейсерії, дифтероїди та деякі інші сапрофітні бактерії.
На підставі токсикологічного дослідження крові у переважної більшості дітей (77/96, або 80,2 %) була виявлена токсемія тяжкого ступеня, у 16/96 (16,7 %) — середньої тяжкості й тільки у 3/96 (3,1 %) — легкого ступеня. Форма інтоксикації була переважно компенсованою у 87/96 (90,6 %) хворих, ще у 9/96 (9,4 %) — у стадії генералізації; декомпенсованих форм інтоксикації у дітей не було виявлено. Токсинонесуча фракція найбільш активних токсичних протеомів у кров’яному руслі дітей була переважно представлена вільноциркулюючими (32/96, або 33,3 %) та глобулін-асоційованими (30/96, або 31,25 %) протеомами. Серед токсичних протеомів переважали молекули з розміром частинок > 200 нм, які були виявлені у 72/96 (75,0 %) дітей, та розміром 10–200 нм — у 22/96 (22,9 %); ще у 2/96 (2,1 %) випадках розміри протеомів становили < 10 нм. Тільки майже у половині випадків (47/96, або 48,9 %) був встановлений міцний зв’язок протеомів із несучою фракцією; в інших випадках зв’язок був нетривкий (14/96, або 14,6 %) або взагалі відсутній (35/96, або 36,5 %), що могло пояснювати швидку динамічну зміну клінічного стану дитини від вираженого інтоксикаційного синдрому до майже нормального самопочуття.
Зміни у периферичній крові ДЧХ із домінуючими клінічними проявами СХБІ мали неспецифічний, але досить типовий характер. Найчастіше, майже у 90–95 % випадків, виявляли відносний та абсолютний лімфоцитоз — від помірного до реального підвищення лімфоцитів у 2–2,5 раза від норми, що пояснювали батькам дитини «перенесеною вірусною інфекцією», та інколи навіть невелику кількість атипових мононуклеарів (зазвичай до 5 %). Досить типовим було частіше стабільне зниження рівня гемоглобіну та еритроцитів (у 30–35 % випадків), яке могло триматися роками, незважаючи на неодноразове інтенсивне сучасне лікування анемії. Ще одним із проявів впливу хронічної інтоксикації на кровотворення було приблизно стабільне зниження у 25–30 % випадків рівнів лейкоцитів та у 10–15 % — тромбоцитів, при цьому інколи лейкопенія з нейтропенією та тромбоцитопенія могли бути суттєво вираженими і досягати майже критичних позначок.
При визначенні імунного статусу, який дослідили у 2160/3547 (60,1 %) ДЧХ від грудного віку до 14 років обох груп спостереження, було встановлено, що клітинний імунітет зазвичай був або у межах норми, або навіть частіше перевищував норму. Тільки у 67/2160 (3,1 %) випадках виявлено незначну клітинну імунну недостатність з вибірковим зниженням рівнів Т-лімфоцитів (СD3+, CD19–), Т-хелперів (СD3+, СD4+, СD8–), Т-супресорів (СD3+, СD4–, СD8+), натуральних кілерів (СD3–, СD56+), цитотоксичних клітин (СD3+, СD56+) та деяких інших. У 1912/2160 (88,5 %) дітей показники клітинного імунітету навіть перевищували вікову норму. Рівні загальних імуноглобулінів IgA, IgM та IgG, а також С3- і С4-комплементів майже в усіх хворих залишалися в межах норми. Лише у 7/2160 (0,3 %) випадках було встановлено селективну гіпогаммаглобулінемію IgA, яка у 4/7 (57,1 %) дітей минула приблизно за декілька років спостереження та лікування бактеріальними автовакцинами. Отже, головна теза простих пояснень батькам, що їх дитина часто хворіє тому, що в неї «поганий імунітет», не відповідає дійсності. У ДЧХ із загальним імунітетом все гаразд, і вони так часто хворіють всупереч гарному та міцному імунітету у його звичному розумінні.
У переважної більшості дітей обох груп спостереження (789/890, або 88,6 % у першій групі та 610/732, або 83,3 % у другій) рівень секреторного IgA в слині значно перевищував нормальні показники, нерідко — у 2–3 рази та залишався підвищеним у процесі лікування та нагляду за дітьми. Незважаючи на таку формальну ознаку підвищення рівня місцевого захисту слизових оболонок через наявність антитіл класу IgА, діти продовжували хворіти часто та довго. Таким чином, достатньо високий рівень секреторного IgА в слині у ДЧХ не запобігав персистенції бактерій на слизовій оболонці носоротоглотки та не попереджав їх патогенні властивості з рецидивуючими гнійно-запальними захворюваннями, а крім того, не перешкоджав розвитку IgE-залежних алергічних реакцій.
Хронічне інфікування EBV було виявлено у 197/862 (22,8 %) ДЧХ у обох групах спостереження віком до 3 років, у 638/1295 (49,3 %) віком від 3 до 7 років та у 1164/1390 (83,7 %) дітей шкільного віку від 7 до 14 років. На підставі системного ПЛР-моніторингу крові та слини на ДНК EBV жодного випадку доказового підтвердження головної чи мікст-етіологічної ролі цього вірусу у виникненні клінічних симптомів у ДЧХ не встановлено. При цьому було виявлено, що серед ДЧХ із супутнім хронічним інфікуванням EBV віком до 3 років вірус у слині був виявлений у 54/197 (27,4 %) дітей, від 3 до 7 років — у 163/638 (25,5 %) та від 7 до 14 років — у 277/1164 (23,8 %) дітей. Цей стан нешкідливої реплікативної активності EBV з визначенням вірусу в слині та відсутністю у крові розглядали як здорове вірусовиділення зі слиною, що не потребує противірусного лікування. Таке саме здорове виділення вірусів герпесу зі слиною стосувалося і вірусів HHV-6, HHV-7 та HHV-8, які неодноразово намагалися у ДЧХ на попередніх етапах звертання за медичною допомогою лікувати, при цьому, зрозуміло, без усякої позитивної клінічної відповіді.
Серед 3547 ДЧХ обох груп спостереження клінічно безсимптомне або малосимптомне (переважно різні затримки розвитку) внутрішньоутробне інфікування CMV було доволі невипадковим та верифіковано у 657/3547 (18,5 %) дітей. ВУІ CMV встановлювали на підставі виявлення вірусної ДНК в слині та/чи в сечі, дуже рідко — у крові переважно дітей перших 6 місяців життя. При цьому вірус виявляли в дітей у слині та сечі тільки у разі внутрішньоутробного інфікування, яке було встановлено у майже 80 % дітей обох груп (524/657, або 79,8 %). Коли первинне зараження відбувалося з молоком матері вже після народження дитини (133/657, або 20,2 %), реплікативних форм хронічної CMV-інфекції не виявляли: вірус (на відміну від EBV) у імунокомпетентних дітей залишався у первинно латентному стані. Такі діти майже не потребували противірусної терапії: лише у 47/657 (7,1 %) випадках через суттєві затримки психофізичного та мовленнєвого розвитку дітям проводили противірусну терапію за редукованою схемою (без ганцикловіру). Головні ризики для ДЧХ із клінічно безсимптомним внутрішньоутробним інфікуванням CMV лежали в площині поствакцинальних уражень ЦНС реактивованим після планового щеплення вірусом.
Лікування усіх 3547 ДЧХ обох груп спостереження проводили з використанням бактеріальних автовакцин. Такими, що пройшли лікування, наслідки якого можна було вважати за встановлені та які не були пов’язані із супутнім прийомом антибактеріальних препаратів, були 3159/3547, або 89,1 % дітей (1413/1595, або 88,6 % І групи та 1746/1952, або 89,4 % ІІ групи). Загальний успіх після завершення трьох циклів імунізації бактеріальними автовакцинами серед ДЧХ із домінуючими гнійно-запальними захворюваннями носоротоглотки та ВДШ (І група спостереження), які пройшли таке лікування та залишилися під катамнестичним спостереженням, був досягнутий у 1373/1413 (97,2 %) дітей та у 1720/1746 (98,5 %) ДЧХ ІІ групи з домінуючими токсичними проявами, насамперед із підвищеною температурою. Тобто загалом 3093/3159, або 97,9 % дітей, що часто хворіють, повністю одужали упродовж 6–24 місяців від початку лікування бактеріальними автовакцинами без використання антибіотиків.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 15.09.2021
Рецензовано/Revised 30.09.2021
Прийнято до друку/Accepted 10.10.2021

/9.jpg)
/15.jpg)