Вступ
Атопічний дерматит (АД) є найпоширенішим запальним захворюванням шкіри в дитячому віці, від якого страждають майже 20 % дітей. Пацієнти з АД із множинною алергічною сенсибілізацією до харчових продуктів та аероалергенів часто проходять так званий атопічний марш, який класично переходить від АД до харчової алергії (ХА) та респіраторної алергії. Величезний інтерес викликає ідентифікація різних ендотипів і біомаркерів шкіри, що спричиняє різні клінічні фенотипи АД, з подальшою перспективою індивідуального лікування з покращеними результатами, які перевищують досягнуті сучасні неспецифічні підходи.
ХА вражає лише третину дітей з АД, причому алергія на арахіс, яйця та молоко є переважаючою харчовою алергією у світі [1]. Такі пацієнти мають великий ризик серйозної алергічної реакції на їжу та вимушені дотримуватись елімінаційної дієти, що супроводжується зниженням якості життя.
Для подолання цього зростаючого навантаження на здоров’я населення велике значення мають стратегії запобігання розвитку ХА [2–4]. Крім того, для запобігання випадковому потраплянню харчових алергенів з’явилось кілька останніх досягнень промисловості щодо виявлення та видалення алергенів із оброблених продуктів [5].
Хоча з’являються нові докази того, що оптимізація догляду за екзематозною шкірою для підтримки здорового шкірного бар’єра і, отже, запобігання харчовій сенсибілізації (ХС), ймовірно, відіграє важливу роль у профілактиці харчової алергії [6, 7], підхід, підкріплений найбільш переконливими даними, стосується раннього введення в раціон алергенних продуктів, особливо яєць та арахісу [8–10].
Останні керівні принципи, включаючи консенсусний документ 2021 року щодо підходу до первинної профілактики харчової алергії [11], рекомендують завчасно вводити продукти, що містять яйця та арахіс, починаючи приблизно з 6-місячного віку (але не раніше 4-місячного віку) у всіх немовлят, а також не затримувати введення інших потенційно алергенних продуктів прикорму. Таким чином, клінічний звіт Американської академії педіатрії 2008 р. був оновлений у 2019 р. [12]. Клінічну оцінку наявної сенсибілізації можна проводити шляхом шкірного тестування та/або за допомогою специфічного IgE ImmunoCAP. Хоча стандартизованого визначення високого ризику харчової алергії немає, у консенсусному документі 2021 р. рекомендується вважати, що немовлята з тяжким АД мають найвищий ризик розвитку ХА, а немовлята з АД легкого та помірного ступеня, обтяженим атопічним анамнезом з боку батьків та відомою харчовою алергією, мають підвищений ризик розвитку нової харчової алергії. Хоча в рекомендаціях Європейської академії алергії та клінічної імунології (EAACI) від 2014 р. щодо запобігання ХА зазначалося, що на момент публікації не було достатньої кількості доказів, які б рекомендували припинити або заохочувати введення в раціон потенційно алергенних продуктів після 4-місячного віку для всіх немовлят з атопічною спадковістю та без неї, оновлені рекомендації 2020 року пропонують вводити арахіс та добре зварене яйце як частину прикорму [13].
Останні дослідження показали, що і алергія на арахіс, і АД тісно пов’язані з мутаціями в гені філаггрину (FLG). Хоча лише менша частка пацієнтів з AД і ХA мають мутації гену FLG, ця сильна асоціація свідчить про те, що дисфункція шкірного бар’єра сприяє розвитку як AД, так і ХA. Попередні дослідження повідомляли, що найсильнішими факторами ризику розвитку алергії на арахіс у дітей є епікутанне застосування кремів або олій, що містять арахіс, шкірна інфекція та тяжкість перебігу АД [14].
Сьогодні існує чимало спостережень, що свідчать про механізми розвитку епікутанної харчової сенсибілізації. Гіпотеза про вплив подвійного алергену постулює, що сенсибілізація відбувається через порушений шкірний бар’єр, як при AД, що призводить до проникнення алергену та порушення регуляції цитокінів. Проте ранній пероральний вплив харчових алергенів стимулює імунну толерантність, потенційно запобігаючи розвитку сенсибілізації [15]. Пероральна толерантність виникає при проникненні антигену через клітини слизової оболонки кишечника, що індукує диференціацію наївних Т-клітин у α4β7+ Т-клітини, які містяться у кишечнику. Ці Т-регуляторні клітини, у свою чергу, індукують виробництво Foxp3+ Tregs та вироблення цитокінів, таких як IL-10 і TGF-β, що інгібують Th2-залежну алергічну відповідь та дегрануляцію тучних клітин, а також відбувається продукція IgG4 [15].
Таким чином, клінічна харчова алергія виникає в умовах втрати цілісності шкірного бар’єра поряд із нездатністю досягти толерантності в ротовій порожнині.
Метою даного дослідження було оцінити у групі хворих на АД поширеність харчової алергії, визначити асоціацію харчової алергії та анамнестичних і клінічних параметрів АД.
Матеріали та методи
Діти, хворі на АД (n = 116), були включені в дослідження з вересня 2020 року по серпень 2021 року в м. Києві, Україна. Діагноз АД верифікований згідно з критеріями, запропонованими G.M. Hanifin, G. Rajka, які були доповнені британською групою спеціалістів та прийняті в 1994 р. як міжнародні клінічні рекомендації. Ступінь тяжкості визначали шляхом оцінки індексу АД (SCORAD). Харчова сенсибілізація встановлювалась шляхом визначення sIgE до харчових алергенів імунохемілюмінесцентним методом на приладі ImmunoCAP 100 (Thermo Fisher Scientific Inc., Phadia, Швеція) із застосуванням відповідних реагентів. Результати класифікували за класами: 0 (менше 0,35 kU/l), 1 (0,35–0,7 kU/l), 2 (0,7–3,5 kU/l), 3 (3,5–17,5 kU/l), 4 (17,5–50 kU/l), 5 (50–100 kU/l) та 6 (100 kU/l). Клас 1 або вище визначався як позитивний. Наявність харчової алергії була визначена шляхом детальної клінічної історії та огляду клінічних записів. Перед забором зразків була отримана письмова інформована згода від батьків або опікуна. Дослідження було схвалене Комісією з питань біоетичної експертизи при НМУ імені О.О. Богомольця, і всі учасники дали письмову інформовану згоду. Тест χ2 використаний з метою визначення асоціації харчової сенсибілізації та клінічних параметрів у хворих на АД. Значення р менше за 0,05 (р < 0,05) вважалось статистично значущим. U-критерій Манна — Уїтні використаний для оцінки різниці віку маніфестації захворювання в порівнюваних групах.
Результати
Середній вік дітей основної групи становив 6,8 року, серед них було 59 хлопчиків і 57 дівчаток. Всі 116 хворих на момент огляду мали прояви АД у вигляді еритематозного сверблячого висипу. Серед них у 30 осіб (25,9 %) був АД легкого ступеня тяжкості, у 59 (50,8 %) — середнього ступеня тяжкості, у 27 (23,3,0 %) — тяжкого ступеня. Супутні АЗ були наявні у 49 дітей, із них бронхіальна астма (БА) — у 16 дітей та алергічний риніт (АР) — у 44 дітей. Кількість дітей, які мали харчову сенсибілізацію та прояви харчової алергії, дорівнювала 23 (19,8 %).
У групі дітей із наявною ХС середній вік становив 6,6 року. Кількість хлопчиків у даній групі становила 14, кількість дівчаток — 9. Статистично значущої різниці у групі з харчовою сенсибілізацією та у групі дітей без неї щодо віку і статі не було встановлено.
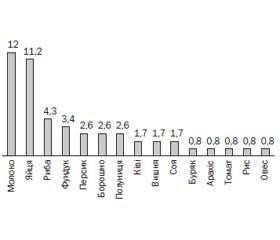
Серед харчових алергенів позитивні показники sIgE були виявлені: у 14 хворих (12 %) — до молока, у 13 хворих (11,2 %) — до яєць, 5 хворих (4,3 %) — до риби, у 4 хворих (3,4 %) — до фундука, у 3 хворих (2,6 %) — до персика, у 3 (2,6 %) — до борошна, у 3 (2,6 %) — до полуниці, у 2 (1,7 %) — до ківі, у 2 (2,7 %) — до вишні, у 2 (2,7 %) — до сої, а також до буряка, арахісу, томату, рису, вівса — по 1 хворому (0,8 %). Дані щодо сенсибілізації надані на рис. 1.
Серед дітей із сенсибілізацією до харчових продуктів 19 мали sIgE до двох і більше харчових продуктів, 4 мали моносенсибілізацію. Середній показник загального IgE у сироватці становив 522 kU/l у групі дітей з харчовою сенсибілізацією та 260 kU/l у загальній групі.
У групі дітей із ХА 10 хворих мали тяжкий АД, 11 хворих — АД середнього ступеня тяжкості, 2 хворих — легкий АД. ХА вірогідно частіше зустрічалась у дітей із середньотяжким та тяжким АД, ніж в групі хворих з легким АД (χ2 = 7,555, p < 0,05) (рис. 2).
У групі дітей із ХА відзначався більш ранній початок захворювання на АД: середній вік початку проявів становив 8 місяців, у групі дітей без ХА — 18 місяців (р < 0,05).
У групі дітей із ХА супутні АЗ зустрічались у 10 осіб: 10 мали АР, із них 5 хворих мали супутню БА. Статистично вірогідної різниці між групами з ХА та без неї залежно від наявності супутньої БА (χ2 = 3,198, p > 0,05) та АР не було (χ2 = 2,779, p > 0,05).
У групі дітей із ХА обтяжений атопічний анамнез з боку батьків відзначався у 14 дітей (60,9 %), у групі пацієнтів без ХА — у 21 дитини (22,6 %). Діти з атопічними захворюваннями в анамнезі у батьків вірогідно частіше мали супутню ХА (χ2 = 12,831, p < 0,05). Клінічні характеристики груп надані в табл. 1.
Обговорення
Генетичні аберації в генах шкірного бар’єра, такі як втрата функції мутації у FLG та SPINK5, призводять до зниження продукування структурних білків шкіри, які необхідні для утворення непошкодженого шкірного бар’єра та пов’язані з підвищеним ризиком сенсибілізації до харчових продуктів та/або ХА [16, 17]. Клінічні дослідження також підтверджують це спостереження. Підвищена трансепідермальна втрата води (TEWL) у 2-денних новонароджених немовлят в когорті Babies After Scope: Evaluating the Longitudinal Impact Using Neurological and Nutritional Endpoints (BASELINE) була предиктивною щодо харчової алергії у віці 2 років [18]. Когортне дослідження мельбурнської атопії показало, що діти з АД у 6 місяців мали збільшений ризик розвитку харчової та інгаляційної сенсибілізації у віці 1 та 2 років [19]. В Австралії в дослідній групі HealthNuts немовлята з АД протягом 1-го року життя мали в 6 разів частіше алергію на яйця та в 11 разів частіше алергію на арахіс до 12 місяців, особливо з раннім початком АД (< 3 місяців) та потребою у стероїдній терапії [20].
У найбільшому дослідженні когорти Barn/Children Allergy Milieu Stockholm Epidemiology (BAMSE) (n = 2256) показано, що 27 % пацієнтів з АД у віці 2 років мали позитивні реакції шкірного прик-тесту на їжу (яйця — 21 %, арахіс — 15 %, молоко — 8 %, тріска — 2 %). Однак дослідники не порівнювали це з сенсибілізацією серед дітей без АД [19]. Друге за величиною дослідження вивчало сенсибілізацію серед дітей старшого віку (12–16 років) (n = 1501), які були включені у Датську підліткову когорту (Danish Adolescent Odense Cohort (TOACS)). Хоча була продемонстрована сильна позитивна асоціація між поточним АД та сенсибілізацією до арахісу (16,2 % пацієнтів з АД проти 0,5 % осіб контрольної групи, р < 0,05) у підлітковому віці, істотних відмінностей щодо сенсибілізації до молока та яєць не було [19].
Дослідження серед дітей молодшого віку показали більш високу поширеність алергії на молоко та яйця у цій віковій групі. Дві високоякісні популяційні статті базувались на когорті народження алергіків із острова Уайт (n = 1456) [19]. У 4-річному віці найвищим незалежним фактором ризику АД була сенсибілізація до арахісу (відношення шансів (ВШ) 4,65; 95% ДІ 1,02–21,34). Існує також позитивна асоціація з сенсибілізацією до яєць, якій не вистачило статистичної значущості (ВШ 6,08; 95% ДІ 0,88–42,01), ймовірно, через брак потужності, оскільки деякі діти переросли алергію на яйця. Тим часом перехресне дослідження Сполученого Королівства (Великобританія) серед 1402 дітей віком від 3 до 5 років виявило, що сенсибілізація до яєць була сильно асоційована з АД (ВШ 9,53; 95% ДІ 2,40–37,82), тоді як сенсибілізація до молока не мала асоціації (ВШ 1,26; 95% ДІ 0,27–6,00) [19].
C. Flohr та співавт. проаналізували осіб, які проходили шкірні прик-тести у рамках дослідження «Запитуючи про толерантність» (ЕАТ) у Великобританії (n = 619), та повідомили, що діти з АД значно частіше, ніж здорові суб’єкти контролю, були чутливими до принаймні 1 з 6 продуктів (молоко, яйця, кунжут, арахіс, пшениця або тріска) з відкоригованим коефіцієнтом шансів (вВШ) 8,53 (95% ДІ 3,51–20,65; р < 0,001) [21]. Ця асоціація не залежала від успадкування мутації втрати функції в гені FLG. Так само існував позитивний зв’язок між АД і сенсибілізацією до окремих продуктів харчування, включаючи яйця (вВШ 9,48; 95% ДІ 3,77–23,83; р < 0,001), молоко (вВШ 9,11; 95% ДІ 2,27–36,59; р = 0,002) і арахіс (вВШ 4,09; 95% ДІ 1,00–13,16,76; р = 0,05). Наше дослідження продемонструвало, що серед дітей, хворих на АД, харчову сенсибілізацію мали 23 особи (19,8 %). Серед продуктів харчування найбільш значними алергенами були молоко (12 %) та яйця (11,2 %). На відміну від поширеності сенсибілізації до арахісу в західних країнах високого рівня сенсибілізації в нашій дослідній групі не відзначалось.
У шести статтях досліджувалось, чи пов’язана ХА з раннім початком АД або персистуючим перебігом. Найякісніше дослідження [22] оцінювало взаємозв’язок між наявністю АД, сенсибілізацією до їжі та ХА (за результатами діагностики на основі симптомів) у пацієнтів віком до 18 років (n = 1456). АД у віці 1 та 2 років асоціювався як з ХА (ВШ 6,04; 95% ДІ 1,25–29,9; р < 0,001), так і з сенсибілізацією до їжі (ВШ 20,1; 95% ДІ 4,40–54,50; р < 0,001) у 4 роки та сенсибілізацією у віці 18 років (ВШ 18,2; 95% ДІ 5,47–65,3; р < 0,001). Крім того, АД у віці 4 років був пов’язаний із сенсибілізацією до харчових продуктів у віці 10 років (ВШ 6,9; 95% ДІ 3,65–13,04; р < 0,001) та 18 років (ВШ 3,82; 95% ДІ 2,44–5,99; р < 0,001). Це підтверджує гіпотезу, що AД у ранньому дитячому віці підвищує ризик сенсибілізації до їжі як подальшого ускладнення. Подальша підтримка в цій галузі надається ретроспективним аналізом 252 немовлят з АД, в якому сенсибілізація до яєць була пов’язана з персистуючим АД (середня тривалість з ХС 11,1 ± 6,9 року проти середньої тривалості без ХС 8,3 ± 6,9 року; р < 0,02) [19].
Когорта Belgian Early Treatment of the Atopic Child (ETAC) (n = 397) продемонструвала, що сенсибілізація до яєць і молока була пов’язана з персистуючим АД (оцінка SCORAD > 7) через 18 місяців спостереження (р = 0,006) [19]. У південноафриканському дослідженні, проведеному Грей та ін. [19], повідомлялося, що початок АД до 6 місяців був значним фактором ризику ХА (р = 0,002). В нашій дослідній групі серед дітей з ХА також відзначався більш ранній початок захворювання на АД: середній вік початку проявів становив 8 місяців, у групі дітей без харчової сенсибілізації — 18 місяців. Також наше дослідження продемонструвало, що ХА вірогідно частіше зустрічалась у дітей із середньотяжким та тяжким АД, ніж у групі хворих з легким АД (χ2 = 7,555, p < 0,05).
Висновки
Наше дослідження продемонструвало, що діти з раннім та тяжким АД мають більший ризик розвитку ХА. Окрім того, діти, батьки яких мають алергічні захворювання в анамнезі, більш схильні до розвитку ХА при АД. ХС пов’язана з вищим показником загального IgE, отже, такі діти, ймовірно, більш схильні до розвитку сенсибілізації до респіраторних алергенів. З огляду на значну асоціацію між раннім початком, а також середньотяжким та тяжким перебігом ХА та сенсибілізацією до їжі, цілком ймовірно, що сенсибілізація до їжі відбувається переважно через запалений шкірний бар’єр в екзематозній шкірі, що потенційно може призвести до розвитку клінічної ХА.
Отже, існує все більше доказів, які підтверджують, що порушений шкірний бар’єр є першопричиною розвитку харчової сенсибілізації та алергії. За останні роки набуло популярності питання відновлення шкірного бар’єра для запобігання АД та ХА. Індукція оральної толерантності зумовила абсолютно нову стратегію профілактики ХА. Місцеве лікування шкіри при АД може запобігти розвитку ХА, або запобігаючи епікутанній сенсибілізації, або збільшуючи вікно можливостей, щоб викликати оральну толерантність шляхом раннього введення алергенної їжі.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Зв’язок роботи з науковими програмами, планами, темами. Наукове дослідження є фрагментом планової науково-дослідної роботи кафедри педіатрії № 2 Національного медичного університету імені О.О. Богомольця «Особливості клінічного перебігу та лікування бронхіальної астми у дітей з надлишковою масою тіла та ожирінням» (№ 0120U100804).
Отримано/Received 17.09.2021
Рецензовано/Revised 29.09.2021
Прийнято до друку/Accepted 04.10.2021
Список литературы
1. Leung D.Y.M., Calatroni A., Zaramela L.S. et al. The nonlesional skin surface distinguishes atopic dermatitis with food allergy as a unique endotype. Sci Transl. Med. 2019 Feb 20. 11(480). eaav2685. doi: 10.1126/scitranslmed.aav2685. PMID: 30787169. PMCID: PMC7676854.
2. Caffarelli C., Di Mauro D., Mastrorilli C., Bottau P., Cipriani F., Ricci G. Solid Food Introduction and the Development of Food Allergies. Nutrients. 2018 Nov 17. 10(11). 1790. doi: 10.3390/nu10111790. PMID: 30453619. PMCID: PMC6266759.
3. Sikorska-Szaflik H., Sozańska B. Primary prevention of food allergy — Environmental protection beyond diet. Nutrients. 2021. 13. 2025. doi: 10.3390/nu13062025.
4. Venter C., Agostoni C., Arshad S.H. et al. Dietary factors during pregnancy and atopic outcomes in childhood: A systematic review from the European Academy of Allergy and Clinical Immunology. Pediatr. Allergy Immunol. 2020. 31. 889-912. doi: 10.1111/pai.13303.
5. Aquino A., Conte-Junior C.A. A systematic review of food allergy: Nanobiosensor and food allergen detection. Biosensors. 2020. 10. 194. doi: 10.3390/bios10120194.
6. Kelleher M.M., Tran L., Boyle R.J. Prevention of food allergy-skin barrier interventions. Allergol. Int. 2020. 69. 3-10. doi: 10.1016/j.alit.2019.10.005.
7. Perkin M.R., Logan K., Marrs T. et al. EAT Study Team. Association of frequent moisturizer use in early infancy with the development of food allergy. J. Allergy Clin. Immunol. 2021. 147. 967-976e1. doi: 10.1016/j.jaci.2020.10.044.
8. Ferraro V., Zanconato S., Carraro S. Timing of food introduction and the risk of food allergy. Nutrients. 2019. 11. 1131. doi: 10.3390/nu11051131.
9. Keet C., Pistiner M., Plesa M., Szelag D., Shreffler W., Wood R., Dunlop J., Peng R., Dantzer J., Togias A. Age and eczema severity, but not family history, are major risk factors for peanut allergy in infancy. J. Allergy Clin. Immunol. 2021. 147. 984-991e5. doi: 10.1016/j.jaci.2020.11.033.
10. Yakaboski E., Robinson L.B., Arroyo A., Espinola J.A., Geller R.J., Sullivan A.F., Rudders S.A., Camargo C.A. Early Introduction of Food Allergens and Risk of Developing Food Allergy. Nutrients. 2021 Jul 5. 13(7). 2318. doi: 10.3390/nu13072318. PMID: 34371828. PMCID: PMC8308770.
11. Fleischer D.M., Chan E.S., Venter C., Spergel J.M., Abrams E.M., Stukus D., Groetch M., Shaker M., Greenhawt M. A consensus approach to the primary prevention of food allergy through nutrition: Guidance from the American Academy of Allergy, Asthma, and Immunology; American College of Allergy, Asthma, and Immunology; and the Canadian Society for Allergy and Clinical Immuno–logy. J. Allergy Clin. Immunol. Pr. 2021. 9. 22-43e4. doi: 10.1016/j.jaip.2020.11.002.
12. Greer F.R., Sicherer S.H., Burks A.W., Committee on Nutrition. Section on Allergy and Immunology The effects of early nutritional interventions on the development of atopic disease in infants and children: The role of maternal dietary restriction, breastfeeding, hydrolyzed formulas, and timing of introduction of allergenic complementary foods. Pediatrics. 2019. 143. e20190281. doi: 10.1542/peds.2019-0281.
13. Halken S., Muraro A., de Silva D., Khaleva E., Angier E., Arasi S., Arshad H., Bahnson H.T., Beyer K., Boyle R. et al. EAACI guideline: Preventing the development of food allergy in infants and young children (2020 update). Pediatr. Allergy Immunol. 2021. doi: 10.1111/pai.13496.
14. Astolfi A., Cipriani F., Messelodi D., De Luca M., Indio V., Di Chiara C., Giannetti A., Ricci L., Neri I., Patrizi A., Ricci G., Pession A. Filaggrin Loss-of-Function Mutations Are Risk Factors for Severe Food Allergy in Children with Atopic Dermatitis. J. Clin. Med. 2021 Jan 11. 10(2). 233. doi: 10.3390/jcm10020233. PMID: 33440636. PMCID: PMC7827548.
15. Tham E.H., Rajakulendran M., Lee B.W., Van Bever H.P.S. Epicutaneous sensitization to food allergens in atopic dermatitis: What do we know? Pediatr. Allergy Immunol. 2020 Jan. 31(1). 7-18. doi: 10.1111/pai.13127. Epub 2019 Oct 9. PMID: 31541586.
16. Roesner L.M., Heratizadeh A. Barrier defect in atopic dermatitis — possibilities and limits of basic skin therapy. Allergol. Select. 2021 Aug 27. 5. 287-292. doi: 10.5414/ALX02268E. PMID: 34532637. –PMCID: PMC8439110.
17. Ashley S.E., Tan H.T., Vuillermin P. et al. The skin barrier function gene SPINK5 is associated with challenge-proven IgE-mediated food allergy in infants. Allergy. 2017. 72(9). 1356-1364.
18. Kelleher M.M., Dunn-Galvin A., Gray C. et al. Skin barrier impairment at birth predicts food allergy at 2 years of age. J. Allergy Clin. Immunol. 2016. 137(4). 1111-6.e8.
19. Tsakok T., Marrs T., Mohsin M., Baron S., du Toit G., Till S., Flohr C. Does atopic dermatitis cause food allergy? A systematic review. J. Allergy Clin. Immunol. 2016 Apr. 137(4). 1071-1078. doi: 10.1016/j.jaci.2015.10.049. Epub 2016 Feb 18. PMID: 26897122.
20. Martin P.E., Eckert J.K., Koplin J.J. et al. Which infants with eczema are at risk of food allergy? Results from a population-based cohort. Clin. Exp. Allergy. 2015. 45(1). 255-264.
21. Flohr C., Perkin M., Logan K., Marrs T., Radulovic S., Campbell L.E., MacCallum S.F., McLean W.H.I., Lack G. Atopic dermatitis and disease severity are the main risk factors for food sensitization in exclusively breastfed infants. J. Invest. Dermatol. 2014 Feb. 134(2). 345-350. doi: 10.1038/jid.2013.298. Epub 2013 Jul 18. PMID: 23867897. PMCID: PMC3912359.
22. Venkataraman D., Soto-Ramírez N., Kurukulaaratchy R.J., Holloway J.W., Karmaus W., Ewart S.L., Arshad S.H., Erlewyn-Lajeunesse M. Filaggrin loss-of-function mutations are associated with food allergy in childhood and adolescence. J. Allergy Clin. Immunol. 2014 Oct. 134(4). 876-882.e4. doi: 10.1016/j.jaci.2014.07.033. Epub 2014 Aug 28. PMID: 25174864. PMCID: PMC4186905.

/8.jpg)
/9.jpg)