Журнал "Гастроэнтерология" Том 55, №3, 2021
Вернуться к номеру
Особливості вегетативного гомеостазу у хворих на хронічний атрофічний гастрит, поєднаний з патологією щитоподібної залози
Авторы: Зигало Е.В., Мосійчук Л.М., Шевцова О.М., Петішко О.П., Демешкіна Л.В.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
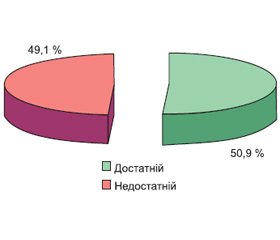
Актуальність. Показники варіабельності серцевого ритму відображують життєво важливі процеси управління фізіологічними функціями організму — вегетативний баланс і функціональні резерви механізмів його управління, адаптаційні можливості організму та стресостійкість. При виражених порушеннях вегетативного гомеостазу підвищується ризик виникнення та прогресування захворювань. Особливо це стосується людей похилого віку, для яких характерна коморбідність. Мета дослідження: оцінити стан адаптаційних можливостей і вегетативної регуляції організму у хворих на передракові стани шлунка з патологією щитоподібної залози (ЩЗ). Матеріали та методи. 72 хворі на хронічний атрофічний гастрит були розподілені на групи: I групу становили 34 хворі з вузлами у ЩЗ; у II групу ввійшли 23 пацієнти з патологічними змінами ЩЗ і 15 пацієнтів III групи мали нормальну ЩЗ. Оцінку показників варіабельності серцевого ритму проводили за результатами PRECISE-діагностики. Для діагностики функціонального стану тонкокишкової мікробіоти проводили водневий дихальний тест. Результати. У 81,9 % хворих на хронічний атрофічний гастрит, поєднаний із патологією щитоподібної залози, виявлено дисбаланс симпатичної та парасимпатичної ланок вегетативної нервової системи з превалюванням частоти ваготонії за рахунок хворих з вузлами у ЩЗ (64,7 %) та з патологічними змінами ЩЗ (56,5 %) (p < 0,05). Встановлено суттєве порушення адаптаційних можливостей організму у 63,2 % хворих на хронічний атрофічний гастрит. Частота зниження адаптаційних можливостей організму була у 2 рази вищою у хворих з коморбідною патологією (p < 0,05). У 56,1 % хворих на хронічний атрофічний гастрит, поєднаний із патологією ЩЗ, спостерігалося зниження функціональних резервів організму. У спектрі виявлених порушень у 68,8 % хворих мало місце виснаження функціональних резервів організму із підсиленням центрального рівня керування та у 31,2 % хворих — гормональний дисбаланс із превалюванням гуморальної ланки із включенням автономного рівня керування (p < 0,05). Аналіз показника стрес-індексу показав у половини обстежених хворих недостатню стресостійкість із вірогідним підвищення середніх цифр до (136,8 ± 7,4) м/с (p < 0,05). Виявлені кореляційні зв’язки між частотою виявлення синдрому надлишкового бактеріального росту та порушенням адаптації (r = 0,64; р < 0,05), дисбалансом симпатичної і парасимпатичної ланок вегетативної нервової системи (r = 0,59; р < 0,05). Висновки. Перебіг хронічного атрофічного гастриту, поєднаного з тиреоїдною патологією, асоціюється з дисбалансом симпатичної та парасимпатичної ланок вегетативної нервової системи, виснаженням адаптаційних механізмів, зниженням функціональних резервів організму і стресостійкості. При цьому порушення адаптаційного потенціалу організму та зміни вегетативного балансу асоціюються з порушенням мікробіоти тонкого кишечника, що потребує мультидисциплінарного підходу до ведення пацієнтів з коморбідною патологією шлунка та щитоподібної залози.
Background. The indicators of heart rate variability reflect the vital processes of managing the physiological functions of the body — autonomic balance and functional reserves of its management mechanisms, the adaptive capacity of the body, and stress resistance. At the expressed disturbances of autonomic nervous system homeostasis, the risk of emergence and progression of diseases increases. This is especially true for the elderly, who are characterized by comorbidity. The purpose of the study was to assess the state of adaptive capacity and autonomic regulation of the body in patients with precancerous conditions of the stomach with the thyroid gland pathology. Materials and methods. Seventy-two patients with chronic atrophic gastritis were divided into groups: group I consisted of 34 patients with nodules in the thyroid gland; group II included 23 patients with pathological changes of the thyroid gland and 15 patients of group III had a normal thyroid gland. The heart rate variability was assessed based on the results of PRECISE-diagnostics. To diagnose the functional state of the small intestinal microbiota, a hydrogen breath test was performed. Results. In 81.9 % of patients with chronic atrophic gastritis and thyroid pathology, an imbalance of the sympathetic and parasympathetic parts of the autonomic nervous system with a prevalence of vagotonia including the patients with thyroid nodules (64.7 %) and pathological changes in the thyroid gland (56.5 %) (р < 0.05). A significant violation of the body’s adaptive capacity was found in 63.2 % of patients with chronic atrophic gastritis. The frequency of reduced adaptive capacity of the organism was twice higher in patients with comorbid pathology (p < 0.05). 56.1 % of patients with chronic atrophic gastritis associated with thyroid pathology experienced a decrease in functional reserves of the body. In the spectrum of detected disorders, 68.8 % of patients presented with depletion of functional reserves of the body with increased central control and 31.2 % of patients — hormonal imbalance with a predominance of the humoral link with the inclusion of autonomous control (p < 0.05). The analysis of the stress index showed in half of the examined patients insufficient stress resistance with a probable increase in mean figures to (136.8 ± 7.4) m/s (p < 0.05). Correlations were found between the frequency of detection of excessive bacterial growth syndrome and maladaptation (r = 0.64; p < 0.05), imbalance of the sympathetic and parasympathetic parts of the autonomic nervous system (r = 0.59; p < 0.05). Conclusions. The course of chronic atrophic gastritis associated with thyroid pathology is associated with an imbalance of sympathetic and parasympathetic parts of the autonomic nervous system, depletion of adaptive mechanisms, reduced functional reserves of the body, and stress resistance. At the same time, disorders of the body’s adaptive potential and changes in autonomic balance are associated with the disorders of the small intestinal microbiota, which requires a multidisciplinary approach to the management of patients with comorbid pathology of the stomach and thyroid gland.
хронічний атрофічний гастрит, щитоподібна залоза, вегетативна регуляція, адаптація, стресостійкість
chronic atrophic gastritis; thyroid gland; autonomic regulation; adaptation; stress resistance
Вступ
Матеріали та методи
Результати та обговорення
/14.jpg)
Висновки
- Li Y., Xia R., Zhang B., Li C. Chronic atrophic gastritis: a review. J. Environ Pathol. Toxicol. Oncol. 2018. Vol. 37. № 3. P. 241-259.
- Lahner E. et al. Chronic atrophic gastritis: Natural history, diagnosis and therapeutic management. A position paper by the Ita-lian Society of Hospital Gastroenterologists and Digestive Endoscopists [AIGO], the Italian Society of Digestive Endoscopy [SIED], the Italian Society of Gastroenterology [SIGE], and the Italian Society of Internal Medicine [SIMI]. Dig. Liver Dis. 2019. Vol. 51. № 12. P. 1621-1632.
- Симонова Ж.Г., Приходько М.Н., Шульгина Е.М. Хронический гастрит и пожилой возраст: есть ли проблема? Ульяновский медико-биологический журнал. 2020. № 4. С. 30-39.
- Липатова Т.Е. и др. Хронический атрофический гастрит у пациентов старше 60 лет: клинические, морфофункциональные и нейроэндокринные параметры. Саратовский научно-медицинский журнал. 2020. Т. 16. № 1. С. 160-163.
- Stirland L.E. et al. Measuring multimorbidity beyond counting diseases: systematic review of community and population studies and guide to index choice. BMJ. 2020. 368. P. 160.
- Мосийчук Л.Н. и др. Оценка коморбидного статуса и структурных изменений щитоподібной железы у больных с хроническим метапластическим атрофическим гастритом: обзор и собственные исследования. Гастроентерологія. 2020. Т. 54. № 3. С. 44-60.
- Kandemir E.G., Yonem A., Narin Y. Gastric carcinoma and thyroid status. J. Int. Med. Res. 2005. Vol. 33. № 2. Р. 222-227.
- Benarroch E.E. Physiology and pathophysiology of the autonomic nervous system. Continuum (Minneap. Minn.). 2020 Feb. 26(1). 12-24.
- Gibbons C.H. Basics of autonomic nervous system function. Handb. Clin. Neurol. 2019. № 160. P. 407-418.
- Wehrwein E.A., Orer H.S., Barman S.M. Overview of the anatomy, physiology, and pharmacology of the autonomic nervous system. Compr. Physiol. 2016. Vol. 6. № 3. P. 1239-1278.
- Browning K.N., Travagli R.A. Central nervous system control of gastrointestinal motility and secretion and modulation of gastrointestinal functions. Compr. Physiol. 2014. Vol. 4. № 4. P. 1339-1368.
- Sen J., McGill D. Fractal analysis of heart rate variability as a predictor of mortality: A systematic review and meta-analysis. Chaos: An Interdisciplinary Journal of Nonlinear Science. 2018. Vol. 28. № 7. Р. 72-101.
- Kim H.G., Cheon E.J., Bai D.S., Lee Y.H. Stress and heart rate variability: a meta-analysis and review of the literature. Psychiatry Investig. 2018. Vol. 15. № 3. P. 235-245.
- Rao S.S.C., Bhagatwala J. Small intestinal bacterial overgrowth: clinical features and therapeutic management. Clin. Transl. Gastroenterol. 2019. Vol. 10(10). P. e00078.
- Quigley E.M.M. The Spectrum of small intestinal bacterial overgrowth (SIBO). Curr. Gastroenterol. Rep. 2019. Vol. 21. № 1. P. 3.
- Ардатская М.Д., Логинов В.А., Минушкин О.Н. Синдром избыточного бактериального роста у больных со сниженной кислотопродуцирующей функцией желудка: некоторые аспекты диагностики. Экспериментальная и клиническая гастроэнтерология. 2014. № 12. С. 30-36.
- Losurdo G. et al. The influence of small intestinal bacterial overgrowth in digestive and extra-intestinal disorders. Int. J. Mol. Sci. 2020. Vol. 21. № 10. P. 3531.
- Husebye E. The pathogenesis of gastrointestinal bacterial overgrowth. Chemotherapy. 2005. Vol. 51(Suppl. 1). P. 1-22.

/13_2.jpg)
/13.jpg)
/15.jpg)
/14_2.jpg)