Журнал «Практическая онкология» Том 4, №2, 2021
Вернуться к номеру
Уротеліальний рак: популяційний аналіз проблеми в Україні
Авторы: Пікуль М.В., Стаховський Е.О., Войленко О.А., Стаховський О.Е., Вітрук Ю.В., Кононенко О.А., Семко С.Л., Гречко Б.О., Кошель Д.О., Каркич О.О.
Національний інститут раку МОЗ України, м. Київ, Україна
Рубрики: Онкология
Разделы: Клинические исследования
Версия для печати
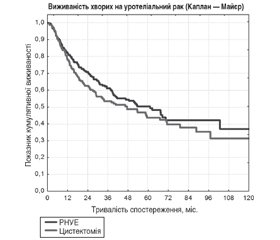
Метою роботи було проведення популяційного аналізу на базі Національного канцер-реєстру з первинною ціллю: визначення ефективності лікування уротеліального раку в Україні; вторинною ціллю: визначення основних тенденцій та підходів до терапії з оцінкою їх впливу на показники загальної виживаності. Матеріали та методи. Дизайн дослідження мав характер ретроспективного обсерваційного. Аналіз проводився на основі даних Національного канцер-реєстру з 2008 по 2020 рік. Загалом проаналізовано медичну документацію 12 698 хворих з уротеліальними пухлинами верхніх сечових шляхів та сечового міхура, що підлягали хірургічному лікуванню. Статистична вибірка робилася на основі створення максимально гомогенних груп пацієнтів з раком сечового міхура (РСМ) та карциномою верхніх сечових шляхів (кВСШ), які мали необхідну кількість нотифікованих параметрів для подальшого аналізу. Первинними цілями аналізу було визначення: середнього віку первинного виявлення досліджуваних нозологій, рівня виявлення залежно від статі, частоти верифікації діагнозу перед проведенням хірургічного лікування, об’єму оперативного втручання, частоти післяопераційних ускладнень на основі даних про 30-денну повторну госпіталізацію, рівня відхилення принципів диспансеризації пацієнтів від загальноприйнятих рекомендацій. Вторинною ціллю була оцінка кумулятивної виживаності пацієнтів з уротеліальними пухлинами залежно від локалізації первинної пухлини та типу оперативного втручання (органозберігаюче чи радикальне). Результати. Для РСМ більш характерним було органозберігаюче лікування, тоді як радикальне лікування було проведене у 15 % хворих із карциномами. Органозберігаюче лікування було більш характерним для кВСШ (40 %). Варто зазначити, що при даній нозології воно є допустимим при інвазивних формах уротеліального раку. Рівень 30-денної госпіталізації був невисоким при обох патологіях, з дещо більшою перевагою кВСШ. Рівень ускладнень становить ІІІ ступінь за класифікацією Clavien-Dindo, у середньому для всього пулу пацієнтів становив 0,2 %. Для РСМ показники загальної виживаності по стадіям становили: І — 73 %, ІІ — 49 %, ІІІ — 18 % та ІV — 11 % (хі-квадрат = 1807,207; р = 0,000001). Для кВСШ рівні 5-річної загальної виживаності відповідають літературним даним, проте існує виражена негативна тенденція до зниження останньої після 10-річного періоду для всіх стадій (хі-квадрат = 146,298; р = 0,000003). По Україні органозберігаюче лікування при кВСШ не поступалося радикальній нефруретеректомії (РНУЕ) у контексті 5-річної виживаності (51,3 проти 51 %; log-rank test). Отримані дані свідчать на користь переваги в 15 % загальної виживаності пацієнтів, котрим була проведена РНУЕ на базі Національного інституту раку (high volume center), порівняно з іншими регіонами України. Рівні 5- та 10-річної виживаності за обох нозологій характеризувались статистично незначимою перевагою кВСШ над РСМ у 7 %. Висновки. Найбільш проблемними в лікуванні уротеліального раку сечового міхура та верхніх сечовивідних шляхів в Україні є поверхневі та місцево-поширені пухлини. Поверхневі пухлини потребують проведення максимально радикальних оперативних втручань та наступного ефективного місцевого лікування. Місцево-поширені пухлини вимагають комплексного підходу до лікування, проведення адекватної системної терапії впливає на кінцеві показники загальної виживаності. У випадках хірургічної резектабельності та збереження функції нирки кВСШ потребують органозберігаючого лікування; такий підхід направлений на підвищення кліренсу креатиніну в пацієнтів до проведення системної хіміотерапії та зниження ймовірності прогресування супутньої патології та асоційованої з нею смертності.
The aim of this work was to conduct a population analysis on the basis of the National Cancer Registry with the primary goal: to determine the effectiveness of urothelial cancer treatment in Ukraine; and the secondary goal: to identify the main trends and approaches to therapy with an assessment of their impact on overall survival. Materials and methods. The design of the study was retrospective observational. The analysis was conducted based on the data of the National Cancer Registry from 2008 to 2020. A total of 12,698 patients with urothelial tumors of the upper urinary tract and bladder who underwent surgical treatment were analyzed. Statistical sampling was performed based on the creation of the most homogeneous groups of patients with bladder cancer (BC) and the upper urinary tract carcinoma (UUTc) who had the required number of notified parameters for further analysis. The primary objectives of the analysis were to determine: the average age of primary detection of the studied nosologies, level of detection depending on gender, frequency of diagnosis verification before surgery, extent of surgery, frequency of postoperative complications based on data on 30-day rehospitalization, the level of deviation of the principles for prophylactic medical patients’ examination from generally accepted recommendations. The secondary objective was to assess the cumulative survival of patients with urothelial tumors depending on the localization of the primary tumor and the type of surgery (organ-sparing or radical). Results. Organ-sparing treatment was more typical for BC, while radical treatment was performed in 15 % of patients with carcinomas. Organ-sparing treatment was more typical for UUTc (40 %). It should be noted that in this nosology it is acceptable for invasive forms of urothelial cancer. The level of 30-day hospitalization was low in both pathologies, with a slightly greater advantage of UUTc. The level of complications is grade III according to the Clavien-Dindo classification, averaging 0.2 % for the entire pool of patients. For BC, the overall survival rates by stages were: I — 73 %, II — 49 %, III — 18 % and IV — 11 % (chi-square = 1,807.207; p = 0.000001). For UUTc, the levels of 5-year overall survival correspond to the literature data, but there is a significant negative tendency to decrease the latter after a 10-year period for all stages (chi-square = 146.298; p = 0.000003). In Ukraine, organ-sparing treatment for UUTc was not inferior to radical nephroureterectomy in the context of 5-year survival (51.3 vs. 51 %; log-rank test). The obtained data testify in favor of the 15% advantage of the total survival of patients who underwent radical nephroureterectomy at the premises of the National Cancer Institute (high volume center), compared to other regions of Ukraine. Levels of 5- and 10-year survival in both nosologies were characterized by a statistically non-significant advantage of UUTc over BC of 7 %. Conclusions. Superficial and locally advanced tumors are the most complex ones in the treatment of urothelial cancer of the bladder and upper urinary tract in Ukraine. Superficial tumors require the most radical surgeries and subsequent effective local treatment. Locally advanced tumors require a comprehensive approach to treatment, adequate systemic therapy influences the final indicators of overall survival. In cases of surgical resectability and preservation of renal function, UUTc requires organ-sparing treatment; this approach aims to increase creatinine clearance in patients before systemic chemotherapy and to reduce the likelihood of progression of comorbidities and associated mortality.
уротеліальний рак; карцинома верхніх сечовивідних шляхів; радикальна нефруретеректомія; рак сечового міхура; радикальна цистектомія; канцер-специфічна виживаність; резекція сечового міхура
urothelial cancer; upper urinary tract cancer; radical nephroureterectomy; bladder cancer; radical cystectomy; cancer-specific survival; resection of the bladder
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Oosterlinck W., Solsona E., van der Meijden A.P., Sylvester R., Bohle A., Rintala E., et al. Guidelines on diagnosis and treatment of upper urinary tract transitional cell carcinoma. 2004 (EAU).
- Munoz J.J., Ellison L.M. Upper tract urothelial neoplasms: incidence and survival during the last 2 decades. Journal of Urology. 2000.
- Huang W.C., Levey A.S., Serio A.M., Snyder M., Vickers A.J., Raj G.V., et al. Chronic kidney disease after nephrectomy in patients with renal cortical tumours: a retrospective cohort study. Lancet Oncology. 2006.
- Zigeuner C., Hutterer G., Chromecki T., Winkelmayer I., Rehak P., Zigeuner R. pT classification, grade, and vascular invasion as prognostic indicators in urothelial carcinoma of the upper urinary tract. Mod. Pathol. 2006.
- Jeldres C., Lughezzani G., Sun M., Isbarn H., Shariat S., Budäus L., et al. Segmental ureterectomy can safely be performed in patients with transitional cell carcinoma of the ureter. Journal of Urology. 2010.
- Go A.S., Chertow G.M., Fan D., McCulloch C.E. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. New England Journal of Medicine. 2004.
- Lane B.R., Smith A.K., Larson B.T., Gong M.C., Campbell S.C., Raghavan D., et al. Chronic kidney disease after nephroureterectomy for upper tract urothelial carcinoma and implications for the administration of perioperative chemotherapy. Cancer. 2010.
- Xylinas E., Rink M., Margulis V., Clozel T., Lee R.K., Comploj E., et al. For the UTUC Collaboration «Impact of renal function on eligibility for chemotherapy and survival in patients who have undergone radical nephro-ureterectomy». BJU International. 2013.
- Adibi M., Youssef R., Shariat S.F., Lotan Y., Wood C.G., Sagalowsky A.I., et al. Oncological outcomes after radical nephroureterectomy for upper tract urothelial carcinoma: Comparison over the three decades. International Journal of Urology. 2012.
- Siegel R.L., Miller K.D., Jemal A., et al. Cancer statistics. CA Cancer J. Clin. 2016.
- Rouprêt M., Colin P., Yates D.R. A new proposal to risk stratify urothelial carcinomas of the upper urinary tract (UTUCs) in a predefinitive treatment setting: low-risk versus high-risk UTUCs. European Urology. 2014.
- Rouprêt M., Colin P. Risk-adapted strategy for the kidney-sparing management of upper tract tumours. Nature Reviews Urology. 2015.
- Porten S., Siefker-Radtke A.O., Xiao L., Margulis V., Kamat A.M., Wood C.G., et al. Neoadjuvant chemotherapy improves survival of patients with upper tract urothelial carcinoma. Cancer. 2015 June.
- Green D.A., Rink M., Xylinas E., et al. Urothelial carcinoma of the bladder and the upper tract: disparate twins. Journal of Urology. 2013.
- Wołącewicz M., Hrynkiewicz R., Grywalska E., Suchojad T., Leksowski T., Roliński J., Niedźwiedzka-Rystwej P. Immunotherapy in Bladder Cancer: Current Methods and Future Perspectives. Cancers. 2020.
- Premo C., Apolo A.B., Agarwal P.K. Trimodality therapy in bladder cancer: Who, what and when? Urologic Clinics of North America. 2015.

/7.jpg)
/8.jpg)
/9.jpg)