Журнал «Травма» Том 21, №5, 2020
Вернуться к номеру
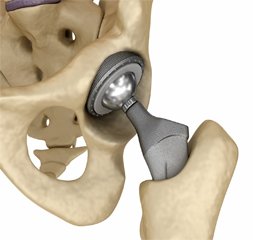
Тотальне ендопротезування кульшового суглоба протягом останніх 25 років
Авторы: Зазірний І.М.
Клінічна лікарня «Феофанія» Державного управління справами, м. Київ, Україна
Рубрики: Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Тотальне ендопротезування кульшового суглоба (ТЕКС) є однією з найбільш клінічно ефективних і економічно доцільних ортопедичних процедур за останні п’ять десятиліть. Міцність фіксації цементованої стегнової ніжки залишається стандартом, з яким порівнюються всі сучасні методи фіксації. Виживання ніжок становило 82 % при 20-річному терміні та 81 % при 30-річному. При цьому виживання ацетабулярних чашок становило 71 і 52 % відповідно. У північноамериканському реєстрі пацієнтів із протезуванням кульшового та колінного суглобів використання цементних чашок знизилося з 12 % у 1995 році до 7,8 % у 2001 році. Клінічні дані не вказують на стійкі клінічні переваги методів малоінвазивної хірургії (Minimally Invasive Surgery, MIS) порівняно з традиційними хірургічними доступами. Нерідко трапляються серйозні ускладнення, пов’язані з використанням цього методу. В останнє десятиліття спостерігається різке зниження частоти клінічного застосування методів MIS при ТЕКС згідно з даними національних реєстрів. У період з 1993 року в усьому світі виявлялося послідовне зростання обсягів поверхневого ендопротезування кульшового суглоба. До 2008 року поверхневе ендопротезування кульшового суглоба становило 6–9 % від усіх ТЕКС. Незважаючи на зацікавленість пацієнтів поверхневим ендопротезуванням, побоювання щодо ускладнень та довгострокового виживання імплантатів, а також невідомі наслідки впливу іонів металів та пов’язані з ними несприятливі тканинні реакції призвели до скорочення кількості поверхневих ендопротезувань кульшового суглоба в більшості країн. Інновації в галузі обробки поліетилену сприяли поліпшенню його зносостійких характеристик. Ідеальний поліетиленовий матеріал повинен мати високу щільність поперечних зв’язків (міцний міжмолекулярний зв’язок) і низький потенціал окислення. Це досягається через збільшення дози опромінення, що подається на поліетилен (до 10 Мрад), що збільшує кількість поперечних зв’язків. Щоб знизити окислювальний потенціал, компоненти тепер опромінюють у безкисневих середовищах з бар’єрною упаковкою. Існує обмежена кількість доказів щодо порівняльної ефективності різних пар тертя кульшових імплантатів. Рандомізовані клінічні дослідження показують схожі коротко- та середньострокові періоди виживання серед керамічно-керамічної пари тертя, кераміки з крос-лінкованим поліетиленом та металу з крос-лінкованим поліетиленом у пацієнтів, молодших за 65 років. Керамічні головки набувають все більшої популярності порівняно з металевими головками. Величезні відмінності досі існують серед країн у частоті застосування цементної та безцементної фіксації. У деяких країнах застосування цементних ніжок було меншим за 4 % в 2013 році, в інших країнах воно становило понад 68 % в тому самому році. В усьому світі існує тенденція до збільшення кількості безцементних фіксацій. Загальнонаціональна база даних пацієнтів США демонструє причини проведення ревізійного ТЕКС: серед 51 345 повторних ТЕКС вивихи становили 22,5 %, асептична нестабільність — 19,7 %, інфекція — 14,8 %. У 2030 році клінічна потреба в первинному ТЕКС збільшиться на 174 %, до 572 000 випадків на рік, порівняно з 2002 роком, а попит на повторне ТЕКС збільшиться на 137 % до 2030 року.
Тотальное эндопротезирование тазобедренного сустава (ТЭТС) является одной из наиболее клинически эффективных и экономически целесообразных ортопедических процедур в течение последних пяти десятилетий. Прочность фиксации цементной бедренной ножки остается стандартом, с которым сравнивают все современные методы фиксации. Выживание ножек составило 82 % при 20-летнем периоде и 81 % при 30-летнем. При этом выживание ацетабулярных чашек составило 71 и 52 % соответственно. В североамериканском регистре больных с протезированием тазобедренного и коленного суставов использование цементных чашек уменьшилось с 12 % в 1995 году до 7,8 % в 2001 году. Клинические данные не указывают на стойкие клинические преимущества методов малоинвазивной хирургии (Minimally Invasive Surgery, MIS) по сравнению с традиционными хирургическими доступами. Нередко встречаются серьезные осложнения, связанные с использованием данного метода. В последнее десятилетие наблюдается резкое снижение частоты клинического использования методов MIS при ТЭТС. В период с 1993 года во всем мире наблюдалось последовательное увеличение объемов поверхностного эндопротезирования тазобедренного сустава. До 2008 года поверхностное эндопротезирование тазобедренного сустава составляло 6–9 % от всех ТЭТС. Несмотря на заинтересованность больных поверхностным эндопротезированием, боязнь осложнений и выживание имплантатов в длительной перспективе, а также неизвестные последствия влияния ионов металлов и связанные с ними неблагоприятные тканевые реакции привели к сокращению количества поверхностного эндопротезирования тазобедренного сустава в большинстве стран. Инновации в области обработки полиэтилена привели к улучшению его износостойких характеристик. Идеальный полиэтиленовый материал должен иметь высокую плотность поперечных связей (крепкая межмолекулярная связь) и низкий потенциал окисления. Это достигается за счет увеличения дозы облучения, которая подается на полиэтилен (до 10 Мрад), что увеличивает количество поперечных связей. Чтобы снизить окислительный потенциал, компоненты облучают в бескислородной среде с барьерной упаковкой. Существует ограниченное количество доказательств сравнительной эффективности разных пар трения тазобедренных суставов. Рандомизированные клинические исследования демонстрируют похожие коротко- и среднесрочные периоды выживания среди керамо-керамической пары трения, керамики с кросс-линкованным полиэтиленом и металла с кросс-линкованным полиэтиленом у больных моложе 65 лет. Керамические головки приобретают все большую популярность по сравнению с металлическими головками. Огромные различия до сих пор существуют среди стран по частоте использования цементной и бесцементной фиксации. В 2013 году в некоторых странах использование цементных ножек было меньше 4 %, в других странах оно составляло более 68 % в том же году. Во всем мире сегодня существует тенденция к увеличению количества бесцементной фиксации. Общенациональная база данных пациентов США демонстрирует причины проведения ревизионного ТЭТС: среди 51 345 повторных ТЭТС вывихи составляли 22,5 %, асептическая нестабильность — 19,7 %, инфекция — 14,8 %. В 2030 году клиническая потребность в первичном ТЭТС увеличится на 174 %, до 572 000 случаев в год, по сравнению с 2002 годом, а спрос на ревизионное ТЭТС увеличится на 137 % до 2030 года.
Total hip arthroplasty (THA) is among the most clinically effective and the most cost-effective orthopaedic surgeries in the past 5 decades. The fixation durability of a well-done cemented femoral stem remains the standard against which all newer fixation techniques are measured. Stem survival was 82 % for 20 years and 81 % for 30 years. In contrast, the acetabular cup survival rate was 71 and 52 %, respectively. Cemented cup use decreased from 12 % in 1995 to 7.8 % in 2001 in the North American Hip and Knee Registry. Clinical data have consistently demonstrated no sustained clinical advantages of the minimally invasive surgery over conventional surgical approaches. Moreover, this method is quite often associated with complications. There has been a dramatic reduction in the enthusiasm and clinical application of minimally invasive procedures in THA over the past decade according to the data from national registries. There was a consistent growth of hip resurfacing worldwide since 1993. By 2008, hip resurfacing accounted for 6–9 % of all THAs. Despite continued intense patient interest, concerns regarding the complications and the long-term implant survival rate and unknown implications of metal ion and related adverse tissue reactions have led to a reduction in the number of superficial hip arthroplasty in most countries. Innovations in the processing of the polyethylene have resulted in improved wear characteristics. The ideal polyethylene material should have a high density of cross-links (strong intermolecular forces) and a low potential for oxidation. This is achieved by increasing the radiation dose given to the polyethylene (up to 10 Mrad), which increases the amount of cross-links. To decrease the oxidation potential, components are now irradiated in oxygen-free environments with barrier packaging. There is limited evidence regarding comparative effectiveness of various hip implant bearings. Randomized clinical trials show similar short to mid-term survivorship among ceramic-on-ceramic (CoC), ceramic-on-highly cross-linked polyethylene (XPE) and metal-on-XPE in patients younger than 65 years. Ceramic heads are getting increasing popularity compared with metal heads. Huge differences still exist amongst countries in the rate of using cemented and cementless fixation. In some countries, the cemented stems were used in less than 4 % of cases in 2013, in other countries — in more than 68 % that same year. All around the world at the moment, there is still a tendency towards an increase in the number of cementless fixations. The Nationwide Inpatient Sample database demonstrates the causes for revision THAs. Three most common causes among the 51,345 revision THAs were dislocation (22.5 %), aseptic loosening (19.7 %), and infection (14.8 %). In 2030, the clinical demand for primary THAs would increase by 174 %, to 572,000 cases per year compared to 2002, and the demand for revision THAs would increase by 137 %.
ендопротезування, кульшовий суглоб
эндопротезирование, тазобедренный сустав
arthroplasty; hip joint
Вступ
1. Хірургічні методи
2. Біоматеріали
3. Недоліки імплантатів і відкликання їх з ринків
4. Ускладнення
5. Питання медичної економіки щодо ТЕКС
Висновок
1. Sochart D.H., Porter M.L. Long-term results of cemented Charnley low-friction arthroplasty in patients aged less than 30 years. J. Arthroplasty. 1998. 13. 123-131.
2. Berry D.J., Harmsen W.S., Cabanela M.E. et al. Twenty-five-year survivorship of two thousand consecutive primary Charnley total hip replacements: factors affecting survivorship of acetabular and femoral components. J. Bone Joint Surg. 2002. 84(A). 171-177.
3. Race A., Miller M.A., Ayers D.C. et al. The influence of surface roughness on stem-cement gaps. J. Bone Joint Surg. 2002. 84(B). 1199-1204.
4. Eisler T., Svensson O., Iyer V. et al. Revision total hip arthroplasty using third-generation cementing technique. J. Arthroplasty. 2000. 15. 974-981.
5. Huo M.H., Brown B.S. What’s new in hip arthroplasty? J. Bone Joint Surg. 2003. 85(A). 1852-1864.
6. Kawamura H., Dunbar M.J., Murray P. et al. The porous coated anatomic total hip replacement. A ten to fourteen-year followup study of a cementless total hip arthroplasty. J. Bone Joint Surg. 2001. 83(A). 1333-1338.
7. Laupacis A., Bourne R., Rorabeck C. et al. Comparison of total hip arthroplasty performed with and without cement: a randomized trial. J. Bone Joint Surg. 2002. 84(A). 1823-1828.
8. Corten K., Bourne R.B., Charron K.O. et al. What works best, a cemented or cementless primary total hip arthroplasty: minimum 17-year follow up of a randomized controlled trial? Clin. Orthop. Relat. Res. 2011. 469. 209-217.
9. Keener J.D., Callaghan J.J., Goetz D.D. et al. Twenty-five-year results after Charnley total hip arthroplasty in patients less than fifty years old: a concise follow-up of a previous report. J. Bone Joint Sur. 2003. 85(A). 1066-1072.
10. Jamieson M.L., Russell R.D., Incavo S.J. et al. Does an enhanced surface finish improve acetabular fixation in revision total hip arthroplasty? J. Arthroplasty. 2011. 26. 644-648.
11. Dunkley A.B., Eldridge J.D., Lee M.B. et al. Cementless acetabular replacement in the young. A 5- to 10-year prospective study. Clin. Orthop. Relat. Res. 2000. 376. 149-155.
12. Huo M.H. What’s new in hip arthroplasty? J. Bone Joint Surg. 2002. 84(A). 1894-1905.
13. Berry D.J., Berger R.A., Callaghan J.J. et al. Minimally invasive total hip arthroplasty. Development, early results, and a critical analysis. Presented at the Annual Meeting of the American Orthopaedic Association, Charleston, South Carolina, USA, June 14, 2003. J. Bone Joint Surg. 2003. 85(A). 2235-2246.
14. Bal B.S., Haltom D., Aleto T. et al. Early complications of primary total hip replacement performed with a two-incision minimally invasive technique. J. Bone Joint Surg. 2005. 87. 2432-2438.
15. DiGioia A.M. III, Plakseychuk A.Y., Levison T.J. et al. Mini-incision technique for total hip arthroplasty with navigation. J. Arthroplasty. 2003. 18. 123-128.
16. Sculco T.P., Jordan L.C., Walter W.L. Minimally invasive total hip arthroplasty: The Hospital for Special Surgery experience. Orthop. Clin. N. Am. 2004. 35. 137-142.
17. Wright J.M., Crockett H.C., Delgado S. et al. Mini-incision for total hip arthroplasty: a prospective, controlled investigation with 5-year follow-up evaluation. J. Arthroplasty. 2004. 19. 538-545.
18. Pagnano M.W., Trousdale R.T., Meneghini R.M. et al. Slower recovery after two-incision than mini-posterior-incision total hip arthroplasty. A randomized clinical trial. J. Bone Joint Surg. 2008. 90(A). 1000-1006.
19. Krych A.J., Pagnano M.W., Coleman Wood K. et al. No strength or gait benefit of two-incision THA: a brief follow-up at 1 year. Clin. Orthop. Relat. Res. 2011. 469. 1110-1118.
20. Spaans A.J., Van de Hout J.A., Bolder S.B. High complication rate in the early experience of minimally invasive THA by DAA. Acta Orthop. 2012. 83. 342-346.
21. Higgins B.T., Barlow D.R., Heagerty N.E., Lin T.J. Anterior vs. posterior approach for total hip arthroplasty, a systematic review and meta-analysis. J. Arthroplasty. 2015. 30. 419-434.
22. Vail T.P., Callaghan J.J. Minimal incision total hip arthroplasty. J. Am. Acad. Orthop. Surg. 2007. 15. 707-715.
23. Mont M.A., Ragland P.S., Etienne G. et al. Hip resurfacing arthroplasty. J. Am. Acad. Orthop. Surg. 2006. 14. 454-463.
24. Huo M.H., Parvizi J., Bal B.S. et al. Council of Musculoskeletal Specialty Societies of the American Academy of Orthopaedic Surgeons. What’s new in total hip arthroplasty? J. Bone Joint Surg. 2008. 90(A). 2043-2055.
25. Amstutz H.C., Beaule P.E., Dorey F.J. et al. Metal-on-metal hybrid surface arthroplasty: two to six-year follow-up study. J. Bone Joint Surg. 2004. 86(A). 28-39.
26. Daniel J., Pynsent P.B., McMinn D.J. Metal-on-metal resurfacing of the hip in patients under the age of 55 years with osteoarthritis. J. Bone Joint Surg. 2004. 86(B). 177-184.
27. Treacy R.B., McBryde C.W., Pynsent P.B. Birmingham hip resurfacing arthroplasty. A minimum follow-up of five years. J. Bone Joint Surg. 2005. 87(B). 167-170.
28. Treacy R.B., McBryde C.W., Shears E. et al. Birmingham hip resurfacing: a minim um follow-up of ten years. J. Bone Joint Surg. 2011. 93(B). 27-33.
29. Amstutz H.C., Campbell P.A., Le Duff M.J. Fracture of the neck of the femur after surface arthroplasty of the hip. J. Bone Joint Surg. 2004. 86(A). 1874-1877.
30. Mont M.A., Seyler T.M., Ulrich S.D. et al. Effect of changing indications and techniques on total hip resurfacing. Clin. Orthop. Relat. Res. 2007. 465. 63-70.
31. Macnair R.D., Wynn-Jones H., Wimhurst J.A. et al. Metal ion levels not sufficient as a screening measure for adverse reactions in metal-on-metal hip arthroplasties. J. Arthroplasty. 2013. 28. 78-83.
32. Van Der Straeten C., Grammatopoulos G., Gill H.S. et al. The 2012 Otto Aufranc Award: The interpretation of metal ion levels in unilateral and bilateral hip resurfacing. Clin. Orthop. Relat. Res. 2013. 471. 377-385.
33. Charnley J. Using Teflon in arthroplasty of the hip joint. J. Bone Joint Surg. 1966. 48(A). 819.
34. Harris W.H. The problem is osteolysis. Clin. Orthop. Relat. Res. 1995. 311. 46-53.
35. Sutula L.C., Collier J.P., Saum K.A. et al. The Otto Aufranc Award. Impact of gamma sterilization on clinical performance of polyethylene in the hip. Clin. Orthop. Relat. Res. 1995. 319. 28-40.
36. Kurtz S.M., Gawel H.A., Patel J.D. History and systematic review of wear and osteolysis outcomes for first-generation highly crosslinked polyethylene. Clin. Orthop. Relat. Res. 2011. 469. 2262-2277.
37. Sedrakyan A., Normand S.L.T., Dabic S. et al. Comparative assessment of implantable hip devices with different bearing surfaces: systematic appraisal of evidence. BMJ. 2011. 343. d7434.
38. Wyles C.C., Jimenez-almonte J.H., Murad M.H. et al. There are no differences in short- to mid-term survivorship among total hip-bearing surface options: a network meta-analysis. Clin. Orthop. Relat. Res. 2015. 473. 2031-2041.
39. Milošev I., Kovač S., Trebše R., Levašič V., Pišot V. Comparison of ten-year survivorship of hip prostheses with use of conventional polyethylene, metal-on-metal, or ceramic-on-ceramic bearings. J. Bone Joint Surg. [Am.]. 2012. 94-A. 1756-1763.
40. Paxton E.W., Inacio M.C., Namba R.S., Love R., Kurtz S.M. Metal-on-conventional polyethylene total hip arthroplasty bearing surfaces have a higher risk of revision than metal-on-highly crosslinked polyethylene: results from a US registry. Clin. Orthop. Relat. Res. 2015. 473. 1011-1021.
41. Tower S.S., Currier J.H., Currier B.H. et al. Rim cracking of the cross-linked longevity polyethylene acetabular liner after total hip arthroplasty. J. Bone Joint Surg. [Am.]. 2007. 89-A. 2212-2217.
42. Jacobs C.A., Christensen C.P., Greenwald A.S., McKellop H. Clinical performance of highly cross-linked polyethylenes in total hip arthroplasty. J. Bone Joint Surg. [Am.]. 2007. 89-A. 2779-2786.
43. Duffy G.P., Wannomae K.K., Rowell S.L., Muratoglu O.K. Fracture of a cross-linked polyethylene liner due to impingement. J. Arthroplasty. 2009. 24. 158. e15-e19.
44. Furmanski J., Kraay M.J., Rimnac C.M. Crack initiation in retrieved cross-linked highly cross-linked ultrahigh-molecular-weight polyethylene acetabular liners: an investigation of 9 cases. J. Arthroplasty. 2011. 26. 796-801.
45. Cooper H.J., Della Valle C.J., Berger R.A. et al. Corrosion at the head-neck taper as a cause for adverse local tissue reactions after total hip arthroplasty. J. Bone Joint Surg. [Am.]. 2012. 94-A. 1655-1661.
46. Plummer D.R., Berger R.A., Paprosky W.G. et al. Diagnosis and management of ALTR secondary to corrosion at the head-heck junction in patients with Metal on Poly bearings. J. Arthroplasty. 2016. 31. 264-268.
47. Whitehouse M.R., Endo M., Zachara S. et al. Adverse local tissue reactions in metal-on-polyethylene total hip arthroplasty due to trunnion corrosion: the risk of misdiagnosis. Bone Joint J. 2015. 97-B. 1024-1030.
48. Kurtz S.M., Kocagöz S.B., Hanzlik J.A. et al. Do ceramic femoral heads reduce taper fretting corrosion in hip arthroplasty? A retrieval study. Clin. Orthop. Relat. Res. 2013. 471. 3270-3282.
49. Kocagoz S.B., Underwood R.J., Macdonald D.W., Gilbert J.L., Kurtz S.M. Ceramic heads decrease metal release caused by head-taper fretting and corrosion. Clin. Orthop. Relat. Res. 2016. 474. 985-994.
50. R.I.P.O. (Registro Regionale di Implantologia Protesica Ortopedica) Report 2000–2013. https://ripo.cineca.it/Reports.html (date last accessed 20 March 2017).
51. Lindalen E., Nordsletten L., Høvik Ø., Röhrl S.M. E-vitamin infused highly cross-linked polyethylene: RSA results from a randomised controlled trial using 32 mm and 36 mm ceramic heads. Hip Int. 2015. 25. 50-55.
52. Shareghi B., Johanson P.E., Kärrholm J. Femoral head penetration of vitamin E-infused highly cross-linked polyethylene liners: a randomized radiostereometric study of seventy hips followed for two years. J. Bone Joint Surg. [Am.]. 2015. 97. 1366-1371.
53. Günther K.P., Schmitt J., Campbell P. et al. Consensus statement “Current evidence on the management of metal-on-metal bearings”. 16 April 2012. Hip Int. 2013. 23. 2-5.
54. NJR Editorial Board. National Joint Registry for England, Wales and Northern Ireland. 12 Annual Report 2015. http://www.njrcentre.org.uk/njrcentre/Portals/0/ Documents/England/Reports/12th %20annual %20report/NJR %20Online %20Annual %20 Report %202015.pdf (date last accessed 16 March 2017).
55. Garellick G., Kärrholm J., Lindahl H. et al. Swedish Hip Arthroplasty Register Annual Report. 2013. http://www.shpr.se/Libraries/Documents/ %C3 %85rsrapport_2013_ eng_webb.sflb.ashx (date last accessed 20 March 2017)
56. Keurentjes J.C., Pijls B.G., Van Tol F.R. et al. Which implant should we use for primary total hip replacement? A systematic review and meta-analysis. J. Bone Joint Surg. [Am.]. 2014. 96. 79-97.
57. Stea S., Comfort T., Sedrakyan A. et al. Multinational comprehensive evaluation of the fixation method used in hip replacement: interaction with age in context. J. Bone Joint Surg. [Am.]. 2014. 96. 42-51.
58. Jämsen E., Eskelinen A., Peltola M., Mäkelä K. High early failure rate after cementless hip replacement in the octogenarian. Clin. Orthop. Relat. Res. 2014. 472. 2779-2789.
59. Heck D.A., Partridge C.M., Reuben J.D. et al. Prosthetic component failures in hip arthroplasty surgery. Arthroplasty. 1995. 10. 575-580.
60. Blumenfeld T.J., Bargar W.L. Early aseptic loosening of a modern acetabular component secondary to a change in manufacturing. J. Arthroplasty. 2006. 21. 689-695.
61. Bernthal N.M., Celestre P.C., Stavrakis A.L. et al. Disappointing short-term results with the DePuy ASR XL metal-on-metal total hip arthroplasty. J. Arthroplasty. 2012. 27. 539-544.
62. Long W.T., Dastane M., Harris M.J. et al. Failure of the Durom Metasul acetabular component. Clin. Orthop. Relat. Res. 2010. 468. 400-405.
63. MacDonald S.J., McCalden R.W., Chess D.G. et al. Metal-on-metal versus polyethylene in hip arthroplasty: a randomized clinical trial. Clin. Orthop. Relat. Res. 2003. 406. 282-296.
64. Neumann D.R., Thaler C., Hitz W. et al. Long-term results of a contemporary metal-on-metal total hip arthroplasty: a 10-year follow-up study. J. Arthroplasty. 2010. 25. 700-708.
65. Bartelt R.B., Yuan B.J., Trousdale R.T. et al. The prevalence of groin pain after metal-on-metal total hip arthroplasty and total hip resurfacing. Clin. Orthop. Relat. Res. 2010. 468. 2346-2356.
66. Mahendra G., Pandit H., Kliskey K. et al. Necrotic and inflammatory changes in metal-on-metal resurfacing hip arthroplasties. Acta Orthop. 2009. 80. 653-659.
67. Curfman G.D., Redberg R.F. Medical devices-balancing regulation and innovation. N. England Med. J. 2011. 365. 975-977.
68. Ardaugh B.M., Graves S.E., Redberg R.F. The 510 (k) ancestry of a metal-on-metal hip implant. N. Engl. J. Med. 2013. 368. 97-100.
69. Johnson R., Green J.R., Charnley J. Pulmonary embolism and its prophylaxis following the Charnley total hip replacement. Clin. Orthop. Relat. Res. 1977. 127. 123-132.
70. Xing K.H., Morrison G., Lim W. et al. Has the incidence of deep vein thrombosis in patients undergoing total hip/knee arthroplasty changed over time? A systematic review of rando–mized controlled trials. Thrombosis Res. 2008. 123. 24-34.
71. Bozic K.J., Kurtz S.M., Lau E. et al. The epidemiology of revision total hip arthroplasty in the United States. J. Bone Joint Surg. 2009. 91(A). 128-133.
72. Charnley J. Postoperative infection after total hip replacement with special reference to air contamination in the operating room. Clin. Orthop. Relat. Res. 1972. 87. 167-187.
73. Kurtz S.M., Lau E., Watson H. et al. Economic burden of periprosthetic joint infection in the United States. Arthroplasty. 2012. 27 (8, Suppl). 61-65el.
74. Yi P.H., Cross M.B., Morie M. et al. The 2013 Frank Stinchfield Award: Diagnosis of Infection in the Early Postoperative Period after Total Hip Arthroplasty. Clin. Orthop. Relat. Res. 2014. 472. 424-429.
75. Parvizi J., McKenzie J.C., Cashman J.P. Diagnosis of periprosthetic joint infection using synovial C-reactive protein. J. Arthroplasty. 2012. 27 (8, Suppl). 12-16.
76. Parvizi J., Jacovides C., Antoci V. et al. Diagnosis of periprosthetic joint infection: the utility of a simple yet unappreciated enzyme. J. Bone Joint Surg. 2011. 93(A). 2242-2248.
77. Kurtz S., Ong K., Lau E. et al. Projections of primary and revision hip and knee arthroplasty in the United States from 2005 to 2030. J. Bone Joint Surg. 2007. 89. 780-785.
78. Iorio R., Davis C.M. III, Healy W.L.F. et al. Impact of the economic downturn on adult reconstruction surgery: a survey of the American Association of Hip and Knee Surgeons. J. Arthroplasty. 2010. 25. 1005-1014.
79. Fehring T.K., Odum S.M., Troyer J.L. et al. Joint replacement access in 2016: a supply side crisis. J. Arthroplasty. 2010. 25. 1175-1181.