Резюме
Шкірна меланома — злоякісна пухлина нейроектодермального походження, яка має високий потенціал метастазування та низькі показники відповіді на хіміотерапію, що погіршує прогноз пацієнтів із поширеними та нерезектабельними формами. У цій статті подано огляд останніх клінічних досліджень нових імунопрепаратів — PD-1/PD-L1-блокаторів, застосування яких є перспективним напрямком терапії шкірної меланоми, що не підлягає хірургічному лікуванню. Метою роботи був аналіз досліджень, присвячених вивченню ефективності анти-PD-1/PD-L1-терапії при поширених формах шкірної меланоми, порівняння її з традиційною хіміотерапією та іншими варіантами таргетної терапії та імунотерапії. Проаналізовано матеріали та інтерпретації клінічних досліджень CheckMate 037, CheckMate 067, KEYNOTE-001, KEYNOTE-002, KEYNOTE-006, KEYNOTE-054, дані NCBI, PubMed, NCCN, ESMO, FDA, NCBI, офіційні рекомендації із застосування анти-PD-1-імунопрепаратів. Терапія інгібіторами PD-1 демонструє кращі результати та прогностичні дані при лікуванні поширених форм шкірної меланоми, аніж класична хіміотерапія. Несприятливі події, пов’язані з лікуванням, зокрема, III–IV стадії, рідше реєструються при лікуванні інгібіторами PD-1, аніж при хіміотерапевтичному лікуванні. Використання PD-1-інгібіторів сприяє покращенню показників у безсимптомних та симптомних пацієнтів із метастазами в головний мозок, у тому числі тих, хто потребує системної терапії кортикостероїдами. Анти-PD-1-терапію доцільно застосовувати як першу лінію при неоперабельних і метастатичних формах шкірної меланоми, а також в ад’ювантному режимі у пацієнтів з ІІІ і IV стадіями захворювання.
Кожная меланома — злокачественная опухоль нейроэктодермального происхождения, которая обладает высоким потенциалом к метастазированию и демонстрирует низкие показатели ответа на химиотерапию, что ухудшает прогноз пациентов с распространенными и нерезектабельными формами. В данной статье представлен обзор последних клинических исследований новых иммунопрепаратов — PD-1/PD-L1-блокаторов, применение которых является перспективным направлением терапии кожной меланомы, не подлежащей хирургическому лечению. Целью работы был анализ исследований, посвященных изучению эффективности анти-PD-1/PD-L1-терапии при распространенных формах кожной меланомы, сравнение ее с традиционной химиотерапией и другими вариантами таргетной терапии и иммунотерапии. Проанализированы материалы и интерпретации клинических исследований CheckMate 037, CheckMate 067, KEYNOTE-001, KEYNOTE-002, KEYNOTE-006, KEYNOTE-054, данные NCBI, PubMed, NCCN, ESMO, FDA, NCBI, официальные рекомендации по применению анти-PD-1-иммунопрепаратов. Терапия ингибиторами PD-1 демонстрирует лучшие результаты и прогностические данные при лечении распространенных форм кожной меланомы, чем классическая химиотерапия. Неблагоприятные события, связанные с лечением, в частности, III–IV стадии, реже регистрируются при лечении ингибиторами PD-1, чем при химиотерапевтическом лечении. Использование PD-1-ингибиторов приводит к улучшению показателей у бессимптомных и симптоматических пациентов с метастазами в головной мозг, в том числе нуждающихся в системной терапии кортикостероидами. Анти-PD-1-терапию целесообразно применять в качестве первой линии при неоперабельных и метастатических формах кожной меланомы, а также в адъювантном режиме, начиная с III–IV стадии заболевания.
Cutaneous melanoma is a neuroectodermal malignant tumor with high metastatic potential and low chemotherapy response rates that worsens the prognosis of patients with advanced and non-resectable forms. This article provides an overview of recent clinical studies on new immunosuppressive drugs: PD-1/PD-L1 inhibitors, the use of which is a promising treatment for cutaneous melanoma that cannot be treated surgically. The purpose of our work was to analyze studies on the anti-PD-1/PD-L1 therapy effectiveness in advanced cutaneous melanoma, comparing it with traditional chemotherapy and other targeted therapies and immunotherapy. Materials and interpretations of clinical trials CheckMate 037, CheckMate 067, KEYNOTE-001, KEYNOTE-002, KEYNOTE-006, KEYNOTE-054; data from NCBI, PubMed, NCCN, ESMO, FDA, NCBI, official recommendations for anti-PD-1 immunotherapy drugs were analyzed. PD-1 inhibitor therapy shows better results and prognostic data for the advanced cutaneous melanoma treatment than traditional chemotherapy. Adverse events related to treatment, including stages III and IV, are less commonly reported with PD-1 inhibitor treatment than with chemotherapy. The use of PD-1 inhibitors shows good results in asymptomatic and symptomatic patients with brain metastases, including those requiring systemic corticosteroid therapy. It is advisable to use anti-PD-1 therapy as a first line in both non-resectable and metastatic forms of cutaneous melanoma and in the adjuvant mode in patients with stages ІІІ and IV of disease.
Вступ
Меланома є однією з найагресивніших та найменш чутливих до медикаментозного лікування злоякісних пухлин. Через це та високу здатність до метастазування смертність від меланоми є найвищою серед інших онкологічних захворювань. Тривалий час неоперабельні форми меланоми мали вкрай невтішні прогнози через високу хіміорезистентність, проте відкриття мембранних білків-чекпойнтів, зокрема PD-1 та його ліганду, створило умови для дослідження іншого напрямку терапії — таргентої та імунної. Пошук якісно нових схем лікування рецидивних і поширених форм меланоми є важливим завданням для дослідників та лікарів.
Мета: аналіз досліджень, присвячених вивченню ефективності анти-PD-1/PD-L1-терапії при поширених формах шкірної меланоми, порівняння її з традиційною хіміотерапією та іншими варіантами таргетної терапії та імунотерапії.
Матеріали та методи
У роботі використовувались матеріали та інтерпретації клінічних досліджень CheckMate 037, CheckMate 067, KEYNOTE-001, KEYNOTE-002, KEYNOTE-006, KEYNOTE-054, а також дані NCBI, PubMed, NCCN, ESMO, FDA, NCBI, офіційні рекомендації із застосування анти-PD-L1-імунопрепаратів.
Епідеміологія меланоми
Меланома вважається найагресивнішою злоякісною пухлиною серед новоутворень шкіри. За останні 50 років захворюваність на меланому різко зросла. Станом на 2018 рік меланома шкіри посідає 19-те місце у світі в загальній структурі діагностованих злоякісних новоутворень (ЗН). Найбільші показники захворюваності визначають у Австралії, Новій Зеландії та Північно-Західній Європі [1]. За 2018 р. у світі діагностовано близько 300 тис. нових випадків захворювання на меланому шкіри. Незважаючи на те, що серед усіх ЗН шкіри меланома займає лише 5 %, смертність саме від цієї нозологічної форми залишається найвищою, здебільшого через високу схильність пухлини до метастазування. Після виявлення метастазів медіана виживаності навіть при лікуванні варіюється від 8 до 12 місяців [2]. П’ятирічна виживаність для IV стадії меланоми становить 15–20 %. За частотою метастазування в головний мозок цей вид пухлини знаходиться на третьому місці після ЗН легень та грудної залози [3]. В Україні станом на 2018 р. меланома шкіри займає у структурі хворих із первинною локалізацією ЗН 2,5 % серед чоловіків та 2,6 % серед жінок; на обліку перебуває 24 801 особа (69,1 на 100 тис. населення), з яких чоловіків 8611 (51,7 на 100 тис. населення) та жінок 16 190 (84,3 на 100 тис. населення). За останні роки також відзначається тенденція до підвищення захворюваності: у 2017 р. в Україні зареєстровано вірогідне зростання показників захворюваності на меланому шкіри серед усього населення на 8,0 %, зокрема, жіночого населення — на 10,1 % порівняно з 2016 р. [4].
Лікування меланоми до відкриття імунотерапевтичних препаратів
Із розвитком медицини та фармації підходи до лікування меланоми змінювались. І якщо на 0–ІІ стадіях методом вибору незмінно залишалось широке висічення, то на ІІІ–IV стадіях, з появою регіонарних та віддалених метастазів, до хірургічного лікування приєднувалось медикаментозне в ад’ювантному режимі або, у разі неоперабельної пухлини, як єдиний метод, ефективність якого тривалий час була досить низькою. Початок розвитку цього напрямку припадає на 1970-ті роки, коли у лікування меланоми почали застосовувати дакарбазин, темозоломід, таксани, похідні платини та нітрозосечовини. Однак, згідно з ретроспективним порівняльним аналізом A. Yang та P. Chapman (2009), вищенаведені препарати не продемонстрували достатнього рівня відповіді в монорежимі: для дакарбазину він становив у середньому 13,4 %, темозоломіду — 13,2 %, цисплатину — 14,4 %, карбоплатину — 15,6 %, фотемустину — 22 %, кармустину — 18,5 %, паклітакселу — 13,1 % та доцетакселу — 11,4 %. Не набагато ефективнішими видалися і комбінації препаратів у поліхіміотерапевтичні схеми. Так, багатоінституційне рандомізоване дослідження третьої фази порівняло дартмутську схему (дакарбазин/кармустин/цисплатин/тамоксифен) з монотерапією дакарбазином, у результаті якого було отримано 18,5-відсотковий рівень відповіді на поліхіміотерапію проти 10,2 % у когорті дакарбазину (хоча різниця виявилась статистично невірогідною). Схема CVD (цисплатин/вінбластин/дакарбазин) продемонструвала 40-відсоткову відповідь у дослідженні другої фази в межах однієї установи, проте порівнянь CVD із дакарбазином у монорежимі так і не було проведено. Щодо ад’ювантного застосування хіміотерапії, то порівняння монотерапії дакарбазином, БЦЖ, їх поєднання та контрольної групи не виявило різниці виживаності впродовж 3 років [5].
На початку 2000-х років було проведено низку досліджень впливу біохіміотерапії, а саме інтерферонів, на перебіг пухлинного процесу при меланомі. Результати продемонстрували збільшення безрецидивної виживаності та зниження частоти рецидивів, проте вплив на загальну виживаність або не був зафіксований, або ж виявлявся таким у малій мірі та без кореляції з дозою чи тривалістю терапії [6].
Проте відкриття чекпойнтів, зокрема мембранного білка-рецептора PD-1 та його ліганду у 1992 р. японським ученим Honjo Tasuku з Університету Кіото, запустило низку подальших досліджень і розробок препаратів моноклональних антитіл. Інгібітори PD-1 ніволумаб та пембролізумаб були схвалені FDA у 2014 р. За відкриття цього білка (2018) Honjo Tasuku отримав Нобелівську премію з медицини. Починаючи з 2010-х років та і сьогодні триває розробка препаратів — блокаторів PD-1 та активне дослідження їх впливу на солідні пухлини, зокрема на поширену меланому. Рекомендації ESMO-2015 та NCCN-2019 включають таргетну терапію в першу лінію лікування поширеної меланоми [7, 8].
Дослідження, присвячені вивченню ефективності анти-PD-1/PD-L1 в терапії меланоми
PD-1/PD-L1 належать до чекпойнтів, через які реалізуються механізми пригнічення імунної відповіді в периферичних тканинах. Високий рівень експресії PD-L1 було зафіксовано в злоякісних пухлинах та їх мікрооточенні, що сприяє ухиленню від нормальних імунних реакцій розпізнавання та індукції апоптозу. Атипові меланоцити часто демонструють експресію PD-L1, що дозволяє застосовувати щодо них анти-PD-1/PD-L1-терапію з метою блокування вищенаведеного механізму опору, відновлення нормальної протипухлинної імунної відповіді та провокації регресу пухлини. У пацієнтів з поширеною меланомою монотерапія анти-PD-1 продемонструвала об’єктивну, ймовірно, вірогідну відповідь на лікування у 30–40 % пацієнтів [9].
Активне дослідження ефективності нових препаратів розпочалося в середині 2010-х років та триває досі. Імунотерапію інгібіторами PD-1 шляху порівнювали з хіміотерапією та блокаторами інших чекпойнтів, порівнювали групи раніше лікованих та наївних пацієнтів, досліджували дієвість різноманітних комбінацій та режимів дозування і введення препаратів. Далі наведено найбільш масштабні та показові з них.
C. Robert та співавт. (2015) було проведено подвійне сліпе рандомізоване дослідження 3-ї фази ефективності застосування PD-1-інгібітора ніволумабу для раніше нелікованих пацієнтів ІІІ–ІV стадії без BRAF-мутації. Порівняння групи ніволумабу було проведено з групою пацієнтів, які отримували дакарбазин. Ніволумаб продемонстрував вірогідне збільшення загальної однорічної виживаності (72,9 проти 42,1 % групи дакарбазину), медіани безрецидивної виживаності (5,1 проти 2,2 місяця в групі дакарбазину), рівень відповіді на терапію (40,0 проти 13,9 % в групі дакарбазину), а також зниження частоти побічних ефектів 3–4-го ступеня тяжкості (11,7 проти 17,6 % у групі дакарбазину) [10]. Цим колективом учених було одночасно оприлюднено результати рандомізованого контрольованого дослідження 3-ї фази, в якому порівнювалися показники безрецидивної та загальної виживаності при лікуванні PD-1-інгібітором пембролізумабом і раніше зареєстрованим та схваленим FDA іпілімумабом, інгібітором CTLA-4, що на той час входив до стандартної лінії терапії пацієнтів із поширеною меланомою. Пацієнти були розподілені на три когорти: перші дві приймали пембролізумаб у дозуванні 10 мг/кг раз на 2 тижні та у тій самій дозі раз на 3 тижні, і третя група отримувала іпілімумаб у дозуванні 3 мг/кг раз на 3 тижні. Результати продемонстрували збільшення 6-місячної безрецидивної виживаності майже вдвічі в обох когортах пембролізумабу (47,3 та 46,4 % відповідно) проти когорти іпілімумабу (26,5 %); а також підвищення показника 12-місячної загальної виживаності (74,1; 68,4 та 58,2 % відповідно). При цьому пембролізумаб в обох групах продемонстрував менший рівень токсичності, аніж іпілімумаб: до уваги бралися побічні ефекти 3–5-го ступеня тяжкості, частота їх виникнення фіксувалася у 13,3; 10,1 та 19,9 % пацієнтів відповідно [11].
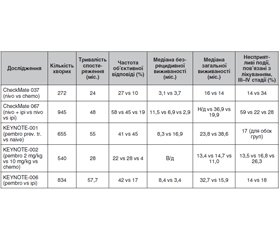
У рандомізованому контрольованому відкритому дослідженні 3-ї фази CheckMate 037 більшу увагу було приділено реакції вже лікованих пацієнтів на терапію PD-1/PD-L1-інгібіторами. Критеріями включення були наявність нерезектабельної або метастатичної меланоми та прогресування після іпілімумабу або ж іпілімумабу та BRAF-інгібітора (за умови наявності BRAF-мутації). 272 пацієнти були розподілені на групу ніволумабу та групу хіміотерапії (дакарбазин у монорежимі або паклітаксел в комбінації з карбоплатином). Після 24 місяців спостереження медіана загальної виживаності становила 16 місяців для ніволумабу та 14 місяців для хіміотерапії, медіана безрецидивної виживаності — 3,1 місяця проти 3,7 місяця відповідно. Об’єктивну відповідь на терапію було зафіксовано у 27 % пацієнтів групи ніволумабу, тоді як у групі хіміотерапії показник виявився майже втричі нижчим — 10 %, медіана тривалості відповіді на терапію — 32 місяці проти 13 місяців відповідно. Побічні ефекти 3–4-го ступеня тяжкості в групі ніволумабу зустрічалися у 14 % пацієнтів, тоді як у групі хіміотерапії — у 34 % пацієнтів. Вищенаведені дані свідчать про те, що навіть у раніше лікованих та пацієнтів із прогресією імунотерапія PD-1-інгібітором викликає кращу відповідь на терапію та має нижчий ризик виникнення побічних ефектів, аніж при класичній хіміотерапії [12].
Дещо схоже дослідження, але присвячене вивченню ефективності наступного представника групи PD-L1-блокаторів — пембролізумабу, описане у рамках рандомізованого клінічного випробування 2-ї фази KEYNOTE-002. Воно включало 540 пацієнтів із попередньо лікованою іпілімумаб-рефрактерною меланомою та мало на меті порівняння пембролізумабу та класичних схем хіміотерапії. Пацієнтів було розподілено на три групи: дві групи пембролізумабу з різницею в дозуванні (2 або 10 мг/кг що три тижні) та одна група хіміотерапії за однією з наведених схем на розсуд локального дослідника: карбоплатин + паклітаксел, карбоплатин, паклітаксел, дакарбазин або темозоламід. Під час аналізу даних враховувався кросовер 55 % пацієнтів із групи хіміотерапії на пембролізумаб. Медіана загальної виживаності становила 13,4 місяця для пембролізумабу в дозуванні 2 мг/кг, 14,7 місяця для дози 10 мг/кг та 11,0 місяця для групи хіміотерапії. Рівень загальної виживаності на момент 24-місячного спостереження становив 36; 38 та 30 % відповідно, рівень безрецидивної виживаності на той самий момент — 16; 22 та < 1 % відповідно. Загальна частота відповіді становила 22; 28 та 4 % відповідно за термін спостереження. Відсутність прогресування було зафіксовано у 73; 74 та 13 % пацієнтів, які відповіли на терапію. Несприятливі події, пов’язані з лікуванням, виникали рідше у групах пембролізумабу (13 та 17 % проти 26 % групи хіміотерапії) при довшій експозиції (232 та 276 днів проти 82 днів). Різниця між показниками різних доз пембролізумабу при аналізі виявилася статистично невірогідною, що вказує на рівноцінну доцільність використання обох режимів дозування в клінічній практиці [13].
Протиставлення схем, що включають PD-1/PD-L1-блокатор у моно- або полірежимі, з монотерапією інгібітором CTLA-4, було поставлене за мету мультицентричного рандомізованого дослідження 3-ї фази CheckMate 067, результати якого було описано після чотирьох років спостереження. Відповідно до дизайну дослідження, когорти складалися із загальної кількості 945 пацієнтів, які приймали ніволумаб у комбінації з іпілімумабом, ніволумаб у монорежимі та іпілімумаб у монорежимі. На момент мінімального спостереження (48 місяців від дати включення останнього пацієнта) медіана загальної виживаності у групі ніволумабу та іпілімумабу не була досягнута, у групі ніволумабу становила 36,9 місяця, а у групі імілімумабу — 19,9 місяця. Коефіцієнт небезпеки смерті для комбінації проти іпілімумабу становив 0,54, а для ніволумабу проти іпілімумабу — 0,42. Медіана безрецидивної виживаності у групі ніволумабу та іпілімумабу становила 11,5 місяця, у групі ніволумабу — 6,9 місяця та у групі іпілімумабу — 2,9 місяця. Коефіцієнт небезпеки для безрецидивної виживаності у протиставленні комбінації та іпілімумабу становив 0,53, а для ніволумабу проти іпілімумабу — 0,42. Побічні ефекти 3–4-го ступеня тяжкості було зафіксовано у 59 % пацієнтів, які отримували комбінацію, у 22 % пацієнтів з групи ніволумабу та 28 % пацієнтів з групи іпілімумабу. Дослідники вважають, що дані свідчать на користь використання ніволумабу як першої лінії терапії поширеної меланоми або комбінації його з іпілімумабом задля довготривалого стійкого ефекту та подовження виживаності [14].
Оприлюднення результатів п’ятирічного спостереження за пацієнтами з поширеною меланомою, які отримували пембролізумаб в рамках фази Ib дослідження KEYNOTE-001, відбулося у січні 2019 р. У дослідження було включено 655 як уперше, так і попередньо лікованих пацієнтів. Всі вони отримували пембролізумаб у одному з трьох варіантів дозування (2 мг/кг що три тижні, 10 мг/кг що три тижні або 10 мг/кг що два тижні). На момент підбиття підсумків п’ятирічного спостереження середня тривалість відповіді не була досягнута. 73 % відповідей у загальній групі та 82 % відповідей у групі первинно лікованих тривають після закриття внесення даних в дослідження, найдовша відповідь тривала 66 місяців. Несприятливі події, пов’язані з лікуванням, спостерігалися у 86 % пацієнтів, проте лише у 7,8 % призвели до припинення прийому препарату та неможливості продовжувати дослідження. Побічні реакції 3–4-го ступеня тяжкості зареєстровано у 17 % пацієнтів. Ці дані демонструють високу та стійку протипухлинну активність пембролізумабу при поширеній меланомі [15].
Нещодавно оприлюднено також п’ятирічні результати дослідження 3-ї фази KEYNOTE-006, що мало на меті порівняння ефективності пембролізумабу та CTLA-4 інгібітора іпілімумабу у пацієнтів з поширеною нерезектабельною меланомою, які на момент включення в дослідження отримали не більше одного виду системної терапії, окрім CTLA-4-, PD-1- та PD-L1-інгібіторів (таких пацієнтів було виключено з дослідження). 834 пацієнтів було розподілено на дві групи пембролізумабу, що розрізнялися режимами введення, та одну групу іпілімумабу. На момент серединного спостереження 57,7 місяця медіана загальної виживаності становила 32,7 місяця у комбінованій групі пембролізумабу та 15,9 місяця у групі іпілімумабу. Медіана безрецидивної виживаності становила для комбінованої групи пембролізумабу 8,4 місяця проти 3,4 місяця у групі іпілімумабу. Несприятливі події, пов’язані з лікуванням, виникли у 17 та 20 % у групах пембролізумабу та іпілімумабу відповідно, зокрема 3–4-го ступеня тяжкості — у 14 та 18 % відповідно. Щодо отриманих даних можна зробити висновок про подовження ефективної дії пембролізумабу після п’яти років спостереження за пацієнтами, а також його перевагу над іпілімумабом як щодо дієвості, так і щодо кращої переносимості [16].
Певний час PD-1 блокатори розглядались лише як рятівна терапія для пацієнтів з неоперабельною або метастатичною меланомою. Проте у лютому 2019 р. FDA було схвалено пембролізумаб як ад’ювантну терапію для пацієнтів з меланомою та залученням одного та більше лімфовузлів після повної резекції. Рішення було прийнято на основі результатів рандомізованого подвійного сліпого плацебо-контрольованого дослідження KEYNOTE-054, яке залучило 1019 пацієнтів. За результатами, медіана безрецидивної виживаності у групі пембролізумабу не була досягнута, а у групі плацебо становила 20,4 місяця. Рецидив або летальний випадок було зафіксовано у 26 % пацієнтів групи пембролізумабу та у 43 % пацієнтів групи плацебо. Через побічні реакції 14 % пацієнтів припинили прийом пембролізумабу [17].
/66.jpg)
Великомасштабні дослідження із залученням сотень пацієнтів зазвичай не роблять додаткового ранжування пацієнтів за локалізацією метастатичних вогнищ. При цьому деякі з них більше за інші асоціюються з погіршенням прогнозів та скороченням тривалості життя. Ідеться про ураження головного мозку. Згаданий напрямок метастазування є досить поширеним при меланомі, зустрічається у 40–50 % пацієнтів із IV стадією захворювання та призводить до зменшення загальної виживаності до 5 місяців з моменту діагностування метастатичних вогнищ у головному мозку. Під час аналізу даних було знайдено опис S. Parakh et al. (2017) дослідження, присвяченого впливу анти-PD-1-терапії на перебіг захворювання у разі діагностики метастазів вищезгаданої локалізації. В дослідженні ретроспективно було проаналізовано дієвість пембролізумабу та ніволумабу у 66 пацієнтів із метастазами меланоми в мозкові структури. На момент початку анти-PD1-терапії 64 % пацієнтів отримали її після локального втручання хірургічним, променевим або поєднаним методами, для 21 % пацієнтів анти-PD1-лікування стало системною терапією першої лінії. Інтракраніальний загальний рівень відповіді становив 21 %, рівень контролю захворювання (DCR) — 56 %. Медіана загальної виживаності дорівнювала 9,9 місяця. У разі порівняння симптоматичної та асимптомної груп пацієнтів безрецидивна виживаність становила 2,7 та 7,4 місяця відповідно, а загальна виживаність — 5,7 та 13,0 місяця відповідно. Також проводили порівняння статистичних показників у пацієнтів, які потребували та не потребували системної кортикостероїдної терапії. Безрецидивна виживаність у першій групі становила 3,2 місяця, тоді як у другій — 7,4 місяця; загальна виживаність — 4,8 проти 13,1 місяця відповідно, що визначає потребу у кортикостероїдах як несприятливий прогностичний фактор. Дослідники вважають імунотерапію анти-PD1-препаратами при метастазах меланоми в головний мозок за перспективний напрямок паліативної медицини, оскільки описані результати демонструють наявність достатньої відповіді метастатичних вогнищ на лікування [18].
Досі немає єдиної думки щодо того, чи доцільно змінювати один PD-1/PD-L1-блокатор на інший у випадку неефективності попереднього лікування препаратом цієї групи. Однак опис клінічного випадку T. Lepir та співавт. (2019) демонструє, що іноді таке рішення є виправданим. Наведені дані демонструють перебіг захворювання 76-річного чоловіка з меланомою, верифікованою патогістологічно після хірургічного видалення. Ад’ювантне лікування включало послідовне застосування BRAF-, MEK-інгібіторів та променеву терапію, після прогресування — CTLA-4-блокатор іпілімумаб (відповідь не досягнута) та ніволумаб. На останній препарат було зафіксовано часткову відповідь, проте після появи метастазів у печінці було прийнято рішення замінити один препарат з групи PD-1-блокаторів на інший — пембролізумаб. Після 46 циклів терапії всі метастази, включаючи селезінкові, повністю регресували. Дослідники припускають, що відповідь на пембролізумаб при неефективності ніволумабу можна пояснити особливою взаємодією першого з C’D-петлею PD-1-рецептора [19].
Клінічні рекомендації щодо застосування анти-PD-1-препаратів у лікуванні меланоми
У гайдлайнах NCCN 2019 наведена рекомендація щодо використання ніволумабу та пембролізумабу при меланомі від ІІІ стадії (за наявності позитивного сторожового лімфовузла, хоча б одного клінічно позитивного лімфовузла, клінічного або мікроскопічного сателіту) в ад’ювантному режимі, а також як першої лінії терапії при метастатичній або нерезектабельній меланомі в монорежимі або у варіанті комбінації із CTLA-4-блокаторами (ніволумаб + іпілімумаб). Офіційна рекомендація до пембролізумабу пропонує для нерезектабельної чи метастатичної меланоми єдине дозування 200 мг внутрішньовенно що три тижні до прогресування або неприйнятної токсичності, для ад’ювантного режиму — 200 мг внутрішньовенно що три тижні до прогресування, неприйнятної токсичності, або продовжити до 12 місяців для пацієнтів без ознак рецидиву захворювання. Інструкція до ніволумабу пропонує для ад’ювантного режиму один з двох еквівалентних режимів введення: 240 мг внутрішньовенно що два тижні або 480 мг внутрішньовенно що чотири тижні, продовжувати до прогресування захворювання чи неприйнятної токсичності, на загальний строк до 1 року. Для нерезектабельної чи метастатичної меланоми пропонується аналогічний режим дозування та введення в монорежимі до прогресії чи неприйнятної токсичності, або в комбінації з іпілімумабом за схемою: 1 мг/кг внутрішньовенно струминно в супроводі іпілімумабу 3 мг/кг внутрішньовенно в той же день що три тижні, продовжити комбінацію до 4 доз, надалі вводити ніволумаб у фіксованій дозі 240 мг внутрішньовенно що два тижні до прогресування чи неприйнятної токсичності [8, 20–22].
Висновки
1. Терапія інгібіторами PD-1 демонструє кращі результати та прогностичні дані при лікуванні поширених форм шкірної меланоми, аніж класична хіміотерапія.
2. Несприятливі події, пов’язані з лікуванням, зокрема III–IV стадії, рідше реєструються при лікуванні інгібіторами PD-1, аніж при хіміотерапевтичному лікуванні.
3. Використання PD-1-інгібіторів сприяє покращенню показників безрецидивної та загальної виживаності у безсимптомних та симптомних пацієнтів з метастазами в головний мозок, зокрема тих, хто потребує системної терапії кортикостероїдами.
4. Анти-PD-1-терапію доцільно застосовувати як першу лінію при неоперабельних та метастатичних формах шкірної меланоми, а також в ад’ювантному режимі, починаючи з ІІІ стадії захворювання.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Список литературы
1. Skin cancer statistics [Електронний ресурс]. Режим доступу до ресурсу: https://www.wcrf.org/dietandcancer/cancer-trends/skin-cancer-statistics.
2. William H. Ward. Cutaneous Melanoma. Etiology and Therapy Farma. Philadelphia, PA, USA: Codon Publications, 2017.
3. D’Souza G. Stage 4 melanoma: What you need to know [Електронний ресурс]. 2018. Режим доступу до ресурсу: https://www.medicalnewstoday.com/articles/322765.php.
4. Федоренко З.П., Гулак Л.О., Михайлович Ю.Й. та ін. Рак в Україні, 2017–2018. Захворюваність, смертність, показники діяльності онкологічної служби. Бюл. Нац. канцер-реєстру України. 2019. С. 130.
5. Yang A. The History and Future of Chemotherapy for Melanoma. Hematol. Oncol. Clin. North Am. 2009. № 23. С. 583-x.
6. Ascierto P. Adjuvant therapy of melanoma with interferon: lessons of the past decade. J. Transl. Med. 2008. № 6. С. 62.
7. Dummer R., Hauschild A., Lindenblatt N. та ін. Cutaneous melanoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology. 2015. № 26. С. 126-132.
8. Cutaneous melanoma: NCCN Clinical Practice Guidelines in Oncology. 2019.
9. Sunshine J., Nguyen P., Kaunitz G. та ін. PD-L1 Expression in Melanoma: A Quantitative Immunohistochemical Antibody Comparison [Електронний ресурс]. 2017. Режим доступу до ресурсу: http://clincancerres.aacrjournals.org/content/23/16/4938.
10. Robert C., Long G., Brady B. та ін. Nivolumab in previously untreated melanoma without BRAF mutation. N. Engl. J. Med. 2015. № 372. С. 320-30.
11. Robert C., Schachter J., Long G. та ін. Pembrolizumab versus Ipilimumab in Advanced Melanoma. N. Engl. J. Med. 2015. № 372. С. 2521-32.
12. Larkin J., Minor D., D'Angelo S. та ін. Overall Survival in Patients with Advanced Melanoma who Received Nivolumab Versus Investigator’s Choice Chemotherapy in CheckMate 037: A Randomized, Controlled, Open-Label Phase III Trial. J. Clin. Oncol. 2018. № 36. С. 383-390.
13. Hamid O., Puzanov I., Dummer R. та ін. Final analysis of a randomised trial comparing pembrolizumab versus investigator-choice chemotherapy for ipilimumab-refractory advanced melanoma. Eur. J. Cancer. 2017. № 86. С. 37-45.
14. Hodi F., Chiarion-Sileni V., Gonzalez та ін. Nivolumab plus ipilimumab or nivolumab alone versus ipilimumab alone in advanced melanoma (CheckMate 067): 4-year outcomes of a multicentre, randomised, phase 3 trial. Lancet Oncol. 2018. № 19. P. 1480-1492.
15. Hamid O., Robert C., Daud A. та ін. Five-year survival outcomes for patients with advanced melanoma treated with pembrolizumab in KEYNOTE-001. Annals of Oncology. 2019. № 30. С. 582-588.
16. Robert C., Ribas A., Schachter J. та ін. Pembrolizumab versus ipilimumab in advanced melanoma [KEYNOTE-006]: post-hoc 5-year results from an open-label, multicentre, randomised, controlled, phase 3 study. The Lancet Oncology. 2019. № 20. С. 1239-1251.
17. Eggermont A.M.M., Blank C.U., Mandala M. та ін. Adjuvant Pembrolizumab versus Placebo in Resected Stage III Melanoma. Engl. J. Med. 2018. № 378(19). Р. 1789-1801.
18. Parakh S., Park J., Mendis S. та ін. Efficacy of anti-PD-1 therapy in patients with melanoma brain metastases. Br. J. Cancer. 2017. № 116. С. 1558-1563.
19. Lepir T., Zaghouani M., Roche S. та ін. Nivolumab to pembrolizumab switch induced a durable melanoma response: A case report. [Електронний ресурс]. 2019. Режим доступу до ресурсу: https://www.ncbi.nlm.nih.gov/pubmed/30633154.
20. Keytruda (pembrolizumab) Dosing & Uses [Електронний ресурс]. Режим доступу до ресурсу: https://reference.medscape.com/drug/keytruda-pembrolizumab-999962.
21. Opdivo (nivolumab) Dosing & Uses [Електронний ресурс]. Режим доступу до ресурсу: https://reference.medscape.com/drug/opdivo-nivolumab-999989.
22. Yervoy (ipilimumab) Dosing & Uses [Електронний ресурс]. Режим доступу до ресурсу: https://reference.medscape.com/drug/yervoy-ipilimumab-999636.

/66.jpg)