У пациента Ф., 1961 г.р., с сентября 2019 года отмечалось повышение активности сывороточных трансаминаз, включая ГГТ, в пределах 3–5 верхних границ показателя в норме (АЛТ > АСТ) и уровня билирубина в 2,5 раза. Изменения показателей печеночных проб совпали по времени с приемом венетоклакса, который пациент получал по поводу В-клеточного хронического лимфолейкоза (ХЛЛ), стадия С по Binet.
Впервые диагноз ХЛЛ был установлен в 2005 году. В 2006, 2011 гг. получал химиотерапию (ХТ) по схеме RFC (ритуксимаб, флударабин, циклофосфамид) с последующим развитием стойкой ремиссии. В 2014 году в связи с рецидивом также было назначено лечение по схеме RFC. Однако после 3 курсов ХТ была достигнута лишь частичная ремиссия. После проведенного исследования костного мозга и выявления делеции 17р13.1 (82 %) был назначен ибрутиниб с положительным эффектом. В 2019 году вновь констатирован рецидив болезни, и в июне 2019 г. принято решение о необходимости лечения венетоклаксом. Терапия была эффективной, в связи с чем доза препарата постепенно снижалась, а интервал между приемами увеличивался. В процессе лечения регулярно контролировались общий анализ крови, почечные и печеночные пробы. Последние оставались в пределах нормальных значений вплоть до сентября 2019 года.
В связи с повышением активности трансаминаз и уровня билирубина было проведено обследование (см. ниже), которое не выявило явной причины гепатита, что дало основание классифицировать его как лекарственный, связанный с приемом венетоклакса. Последний был отменен в октябре 2019 года, пациенту были назначены гепатопротекторы. К сожалению, это мало повлияло на динамику печеночных проб: с декабря 2019 по апрель 2020 года минимальное значение АЛТ было 110 Ед/л в январе 2020 г. (колебания от 110 до 267 Ед/л). Напротив, уровень билирубина, хотя и очень медленно, имел тенденцию к снижению (от 54 мкмоль/л в декабре 2019 г. до 19 мкмоль/л в феврале 2020 г.). В последних анализах от 06.04.20 г. АЛТ — 213 Ед/л, АСТ — 182 Ед/л, билирубин — 28 мкмоль/л (прямой — 10 мкмоль/л), ГГТ — 157 мкмоль/л (норма — до 61). Общий анализ крови подтверждал стойкую ремиссию после лечения венетоклаксом: количество лейкоцитов колебалось от 3,2 до 9,9 × 109/л, эритроцитов — от 4,3 до 5,68 × 1012/л, гемоглобин — 138–163 г/л.
Из отдаленного анамнеза известно, что в 2013 году пациент получал терапию Peg-IFN α-2a в комбинации с рибавирином в течение 48 недель по поводу хронического гепатита С с последующим развитием устойчивого вирусологического ответа на лечение. Никогда ранее во время проведения курсов ХТ уровни трансаминазы у больного не повышались. В мае — июне 2019 года во время рецидива болезни проводилась трансфузия эритроцитарной массы, свежезамороженной плазмы, тромбоконцентрата.
С сентября 2019 г. по апрель 2020 г. пациенту были проведены анализы, которые позволили исключить вирусные гепатиты А, В, С, G (неоднократные исследования методом ПЦР, а также HBsAg, антитела класса IgM), гепатиты, вызванные вирусом Эпштейна — Барр, цитомегаловирусом, вирусом простого герпеса (ПЦР-исследования, антитела класса IgM), аутоиммунный гепатит. Также были исследованы уровни меди в крови, церулоплазмина, α1-антитрипсина (норма). Однократно проведено обследование на антитела класса IgM к вирусу гепатита Е (результат отрицательный). В декабре 2019 г. был обнаружен высокий уровень ферритина (767 нг/мл) при повышенном содержании сывороточного железа (до 41 при норме 30). Данные показатели имели тенденцию к нормализации (параллельно с уровнем билирубина). Проведенные в апреле 2020 г. исследования продемонстрировали нормальный уровень ферритина, сывороточного железа и насыщенности трансферрина железом. Все перечисленные выше исследования выполнялись по нескольку раз, в том числе и в лабораториях за рубежом.
Проведенная компьютерная томография (КТ) органов грудной клетки не выявила какой-либо патологии. При КТ-исследовании брюшной полости обнаружена выраженная гепатоспленомегалия, 2 мелкие простые кисты (S2, 7), расширение селезеночной вены без видимых портокавальных анастомозов, нормального размера внутрибрюшные лимфатические узлы.
Ввиду отсутствия эффекта от прекращения терапии венетоклаксом и назначения гепатопротекторов, исключения заболеваний печени, диагноз которых устанавливается на основании наличия чувствительных биомаркеров, была проведена биопсия печени. Было выявлено частичное нарушение структуры печени за счет наличия выраженной лимфоцитарной инфильтрации в перипортальных трактах. Гепатоциты с умеренно выраженными дистрофическими изменениями, мелкокапельной, вакуольной дистрофией, признаками внутрипеченочного холестаза. Клетки инфильтрата мелкие, с округлыми гиперхромными ядрами, скудной цитоплазмой, располагаются преимущественно в перипортальных зонах, единичные проникают по межбалочным пространствам в паренхиму. При иммуногистохимическом исследовании установлено, что среди лимфоцитов инфильтрата значительно преобладают клетки, экспрессирующие маркер В-лимфоцитов (CD20+), положительно окрашивающиеся с CD5 и CD23, а также экспрессирующие ZAP-70. Определяется примесь единичных малых Т-лимфоцитов (CD3+), располагающихся преимущественно в межбалочных пространствах. Пролиферативная активность клеток инфильтрата низкая — при окрашивании с маркером пролиферации Ki-67 реакция положительная примерно у 5 % опухолевых лимфоцитов. На основании проведенного исследования 26.02.20 г. был сделан вывод о том, что гистологическая картина и иммунофенотип клеток инфильтрата соответствуют поражению печени при мелкоклеточной В-клеточной лимфоме/хроническом лимфолейкозе.
Месяц спустя ткань печени (парафиновые блоки) была отправлена другому патологу, который высказал мысль о наличии у пациента признаков острого портального, межуточного и лобулярного гепатита с наличием мостовидных некрозов. Не было выявлено признаков пролиферации желчных протоков (СК7), их вовлечения в воспалительный процесс. Также не выявлено признаков жировой болезни печени, накопления железа внутри гепатоцитов и PAS-позитивных включений (PAS-реакция). В качестве комментария указывалось на возможную вирусную этиологию гепатита или гепатит как следствие приема лекарственных препаратов.
Итак, несмотря на порой неоднократно предпринятые попытки установить этиологию заболевания печени у больного Ф., она оставалась неуточненной к 7-му месяцу от начала заболевания. По крайней мере с учетом продолжительности заболевания было ясно, что речь идет о хроническом заболевании печени. Результаты биопсии позволяли интерпретировать заболевание как гепатит неустановленной этиологии (вирусный или лекарственный) или же предполагать инфильтративное поражение печени вследствие основного заболевания.
По поводу второго предположения имелись серьезные контрдоводы. Поражение печени при ХЛЛ чаще всего наблюдают в бластной фазе заболевания, и оно связано с замещением гепатоцитов нефункционирующими опухолевыми клетками, высвобождением ими цитокинов, активацией купферовских клеток и ишемией вследствие инфильтрации портальных трактов бластными клетками [1]. Иногда эти изменения могут быть причиной острой печеночной недостаточности, хотя в большинстве случаев регистрируется различной степени увеличение печени и минимальное/умеренное повышение активности сывороточных трансаминаз, особенно щелочной фосфатазы [2, 3]. Однако во время проведения биопсии (февраль 2020 года) у пациента была полная клиническая и лабораторная ремиссия ХЛЛ, а анализ крови полностью соответствовал норме.
С чем же в данном случае могут быть связаны различия в интерпретации результатов биопсии печени? В первом заключении описана морфологическая картина, которая может соответствовать изменениям в печени при хроническом лимфолейкозе, а именно выраженная лимфоцитарная инфильтрация, причем описанные клетки инфильтратов могут соответствовать опухолевым В-лимфоцитам при ХЛЛ (при иммуногистохимическом исследовании выявлены маркеры, которые характерны для фенотипа В-клеточной хронической лимфоцитарной лейкемии (В-ХЛЛ)). Однако все использованные маркеры могут давать позитивную экспрессию в клетках инфильтрата и при воспалительном процессе: CD20 экспрессируется В-лимфоцитами, CD5 — большинством Т-лимфоцитов, частью В-лимфоцитов; CD23 — низкоаффинный IgE-рецептор, участвующий в регуляции IgE-ответа, экспрессируется в зрелых В-лимфоцитах, активированных макрофагах; тирозинкиназа ZAP-70 экспрессируется Т- и NK-лимфоцитами, эозинофилами, тучными клетками, но не зрелыми В-лимфоцитами. Возможно, что если бы был проведен анализ распределения/локализации/доли прореагировавших моноклональных антител и уточнены особенности их экспрессии (мембранная, ядерная, цитоплазматическая), было бы получено больше данных, которые помогли бы дифференцировать воспалительный инфильтрат от опухолевого. Низкий, до 5 % индекс пролиферации также не исключает В-ХЛЛ. Таким образом, описанные в первом заключении изменения на самом деле могли соответствовать как воспалительным изменениям в печени, так и изменениям при ХЛЛ.
Однако, если обратиться ко второму заключению, мы находим свидетельства в пользу острого воспалительного процесса в печени — портального, межуточного и лобулярного гепатита с наличием мостовидных некрозов. Их наличие в отсутствие бластной фазы ХЛЛ свидетельствует против этого диагноза, т.к. некрозы при ХЛЛ являются результатом ишемии гепатоцитов как следствия опухолевой инфильтрации [4].
Таким образом, патоморфологическая дифференциальная диагностика поражения печени при ХЛЛ сложна, ибо зачастую инфильтративные изменения в печени напоминают воспалительные инфильтраты при заболеваниях печени другой этиологии. В дифференциальной диагностике помогает наличие некрозов гепатоцитов, нетипичных для ХЛЛ, и клинические/лабораторные данные, указывающие на возможность бластного криза. С учетом приведенных замечаний следует считать, что данные патоморфологического исследования пациента Ф. более соответствовали острому гепатиту, нежели поражению печени при ХЛЛ.
С учетом усилий, предпринятых для уточнения этиологии заболевания, можно было бы остановиться на диагнозе «хронический гепатит неуточненный» (К 73.9 согласно МКБ-10), который был бы уместен в данной ситуации. Тем не менее дальнейшая дифференциальная диагностика возможна и может быть весьма поучительной.
Прежде всего необходимо остановиться на возможности лекарственного гепатита. Теоретически любой препарат, даже не являющийся гепатотоксичным, должен рассматриваться как потенциальная причина повышения трансаминаз, если оно не может быть объяснено другими причинами. В этом случае отмена потенциально гепатотоксичного препарата должна приводить к снижению или нормализации активности трансаминаз. К сентябрю 2019 года, когда впервые было зарегистрировано повышение АЛТ, АСТ и билирубина, пациент третий месяц подряд принимал венетоклакс. Поражение печени не относится к частым побочным явлениям этого препарата. Более того, при легком и умеренном поражении печени не требуется коррекции дозы венетоклакса, что косвенно указывает на его низкую гепатотоксичность. Тем не менее, поскольку проведенное обследование не позволило установить этиологию развившегося гепатита, венетоклакс был отменен. Однако это никак не повлияло на последующую динамику сывороточных трансаминаз, что ставит под сомнение лекарственную природу поражения печени у данного больного.
При диагностическом поиске необходимо учесть, что мы имеем дело с иммунокомпрометированным пациентом. Последнее обстоятельство связано как с наличием ХЛЛ, так и с использованием для его лечения препаратов, вызывающих иммуносупрессию. В этом случае можно предположить развитие некоей оппортунистической инфекции, которая может протекать с поражением печени.
Наиболее часто иммунодефицит при В-клеточном ХЛЛ развивается вследствие гипогаммаглобулинемии, что увеличивает риск развития инфекций, вызванных инкапсулированными микроорганизмами (S.pneumoniae, N.meningitidis, H.influenzae). Последние являются причиной рецидивирующих инфекций ЛОР-органов и пневмоний, а также септицемии [5]. Однако перечисленные возбудители не вызывают развитие гепатита, что позволяет отвергнуть ХЛЛ как причину развития оппортунистической инфекции с поражением печени и перейти к рассмотрению ятрогенных факторов иммуносупрессии.
Венетоклакс — селективный ингибитор антиапоптозного белка В-клеточной лимфомы, оказывающий цитотоксическое действие на опухолевые клетки с повышенной экспрессией BCL-2. Самыми частыми серьезными нежелательными реакциями (≥ 2 %) при приеме венетоклакса являются пневмония и фебрильная нейтропения [6]. Ибрутиниб, хотя и обладает отличным от венетоклакса механизмом действия на пролиферирующие злокачественные В-клетки, вызывает похожие побочные эффекты [7]. Следствием нейтропении чаще всего бывают бактериальные инфекции, вызванные аэробными грамотрицательными бациллами и грамположительными кокками, а также высшими грибами (чаще Candida spр.). При этом гепатит обычно не развивается.
Таким образом, отсутствие нейтропении на момент развития гепатита у нашего пациента и, как следствие, вызванных ею оппортунистических бактериальных инфекций ставит под сомнение значимость венетоклакса и ибрутиниба как причины гепатита вследствие индуцированной данными препаратами глубокой иммуносупрессии.
Однако угнетение иммунитета как вследствие ХЛЛ, так и в результате приема венетоклакса отрицать все же нельзя. И одним из возможных проявлений этого феномена является снижение способности иммунной системы реагировать на инфекцию путем выработки антител, что может сказаться на качестве диагностики различных инфекций.
Если обратиться к перечню проведенных исследований, то можно сказать, что вирусные гепатиты В, С, вызванные вирусом Эпштейна — Барр, цитомегаловирусом, вирусом простого герпеса, были исключены достаточно надежно, поскольку для их диагностики использовался поиск РНК или ДНК возбудителя методом ПЦР. А вот гепатит Е был отвергнут на основании однократного определения антител класса IgM к возбудителю, что в этой ситуации было явно ошибочным решением.
Подобное невнимание можно объяснить двумя причинами. Во-первых, тем, что гепатит Е продолжает оставаться редкой инфекцией в Украине. Во-вторых, слабой осведомленностью врачей о возможности хронического течения заболевания у пациентов с иммуносупрессией.
Необходимо отметить, что раньше бытовало мнение о завозном характере гепатита Е в Украине. Однако последние публикации позволяют сделать вывод о существовании местных очагов инфекции. Так, в 2011–2013 гг. и в 2015 году в Николаевской области было зарегистрировано 8 случаев заболевания у коренных жителей области, которые в сроки, укладывающиеся в продолжительность инкубационного периода при гепатите Е, не выезжали за ее пределы [8]. Средний возраст заболевших составил 65 лет, причем пятеро из них были старше 70 лет. Примечательно, что в Великобритании, где эта инфекция распространена гораздо шире, чем у нас, средний возраст болеющих гепатитом Е тоже составляет 63 года [9]. Большинство заболевших в Николаеве содержали на приусадебных участках свиней. Последние являются главным источником болезни в Европе, где регистрируется около 2 млн случаев острого гепатита Е в год [10]. Поскольку мы ничего не знаем о генотипах вируса, вызвавшего заболевание в Николаевской области, справедливо будет отметить, что в Азии, где доминируют 1 и 2 генотипы вируса, основным источником инфицирования является человек.
Однако хроническое течение гепатита Е характерно исключительно для случаев, вызванных 3 или 4 генотипами вируса, распространенными преимущественно в Европе. Там хронический гепатит Е в основном описан у реципиентов донорских органов. Более чем у половины из них (55–60 %) заболевание трансформируется в хроническую форму [11]. Другим контингентом болеющих являются пациенты гематологического профиля, ВИЧ-инфицированные, больные с ревматическими заболеваниями, получающие иммуносупрессивную терапию [12, 13]. На фоне иммуносупрессивной терапии заболевание быстро прогрессирует, и риск развития цирроза оценивается около 10 % [14, 15]. В связи с этим в последнем руководстве Европейской ассоциации по изучению печени однозначно указывается на необходимость обследования на гепатит Е всех пациентов с острым гепатитом и больных с иммуносупрессией и необъяснимым повышением трансаминаз [10].
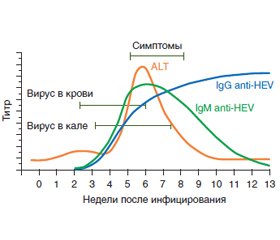
Инкубационный период при гепатите Е составляет 15–60 дней. РНК HEV может быть выявлена приблизительно через 3 недели после заражения — вначале в крови, а потом и в кале больных [16]. Таким образом, вскоре после появления клинических проявлений вирус уже может быть обнаружен. Весьма вероятно, что к этому моменту уже будут выявляться и антитела: вначале — IgM, в последующем — IgG. Классический вариант острого гепатита предполагает наличие IgM, IgG в сочетании с повышением трансаминаз и наличием РНК вируса в крови или в кале (рис. 1). При условии, что будет учтена динамика титров IgM и IgG, для установления диагноза острой инфекции достаточно определения только антител. В любом случае, следует стремиться к выявлению как РНК, так и антител к вирусу, т.к. в некоторых случаях острого гепатита РНК может исчезать рано, и иным способом, кроме как исследованием на антитела, установить диагноз болезни будет невозможно.
/52.jpg)
У больных с иммуносупрессией антитела могут вовсе не образовываться или появляться позже обычного, что и имело место у нашего пациента. В этом случае диагностика должна основываться на выделении РНК вируса или повторных тестированиях на наличие антител. Иногда у пациентов с иммуносупрессией возможна реинфекция. В этом случае IgM обычно не образуются, в то время как IgG и РНК HEV присутствуют (табл. 1) [17].
Руководствуясь изложенным, мы назначили нашему пациенту повторное исследование на антитела IgM и IgG, которые оказались положительными (исследование проведено через 4 месяца после предыдущего).
Скорее всего, этого было бы достаточно для установления правильного диагноза, однако с учетом того, что имела место хроническая форма заболевания и был необходим мониторинг эффективности предстоящей противовирусной терапии, потребовалось исследование на наличие РНК HEV, которая была выявлена в титре 1,9 × 105 МЕ/мл.
Таким образом, диагноз был финализирован спустя 7 месяцев после появления лабораторных признаков гепатита. Отсутствие клинических проявлений заболевания в данном случае не является чем-то удивительным: симптомы острого гепатита развиваются менее чем у 5 % инфицированных [10].
Вопрос об источнике инфекции для нашего пациента остался открытым. В течение последнего года за пределы Украины он не выезжал. С учетом описанной вспышки в Николаевской области мы можем предполагать, что это был местный очаг инфекции. Также немаловажным в контексте рассматриваемой проблемы является факт переливания препаратов крови пациенту в связи с анемией и тромбоцитопенией в конце мая — начале июня 2019 года. И хотя в этом случае инкубационный период должен быть максимальным, заражение гепатитом Е при гемотрансфузии возможно. Наличие виремии у клинически здоровых доноров крови подтверждено многочисленными публикациями. В одном из исследований, проведенных в Шотландии, этот показатель составил 1 случай на 2481 тестирование донорской крови [18]. Во Франции инфицировано 3–4 % доноров, в Нидерландах и Германии — 1 из 600 [19–21]. И если источником инфицирования нашего пациента послужила донорская кровь, то это, со всей очевидностью, требует проведения исследования, целью которого будет определение экономической целесообразности тестирования донорской крови в Украине на маркеры гепатита Е.
Конфликт интересов. Не заявлен.
/52.jpg)
/52_2.jpg)