Резюме
Актуальність. Хронічний гастрит значною мірою пов’язаний із клінічними проявами у вигляді диспепсії, проте часто навіть у тяжкій формі перебігає безсимптомно, що і зумовлює труднощі його своєчасної діагностики. Взаємозв’язок клінічних проявів функціональної диспепсії та гастриту досі є суперечливим у зв’язку з невизначеністю форми коморбідності. Мета дослідження: вивчити клінічні прояви у хворих із передраковими станами шлунка за симптомокомплексами гастроезофагеального рефлюксу (ГЕР) і функціональної диспепсії — синдрому епігастрального болю (СЕБ) та постпрандіального дистрес-синдрому (ПДС). Матеріали та методи. Обстежено 79 хворих, які за результатами морфологічного дослідження розподілені на групи: 1 група (n = 13) — атрофічні зміни слизової шлунка; 2 група (n = 20) — кишкова метаплазія лише в антральному відділі шлунка; 3 група (n = 33) — дифузна кишкова метаплазія; 4 група (n = 13) — хворі із дисплазією. При вивченні клінічної картини аналізували базові характеристики наявності, частоти та ступеня вираженості основних скарг хворих. Ступінь вираженості симптомів визначали за 5-бальною шкалою Лайкерта. Усі симптоми хворих були згруповані у симптомокомплекси, характерні для ГЕР та для функціональної диспепсії, з визначенням ПДС та СЕБ згідно з Римськими критеріями. Результати. Прояви функціональної диспепсії в усіх випадках поєднувалися із клінічною симптоматикою ГЕР. За інтенсивністю симптомів у всіх обстежених домінували симптоми функціональної диспепсії з перевагою ПДС. Для пацієнтів із мультифокальною кишковою метаплазією характерною була максимальна симптоматика ГЕР, що втричі більше, ніж у пацієнтів з атрофією (р < 0,05). Також при мультифокальній кишковій метаплазії спостерігалася максимальна частота симптомів як ПДС (71,4 %), так і СЕБ (63,6 %). При дисплазії слизової оболонки провідне значення мали прояви ПДС — максимальна кількість наявних симптомів у 63,6 %, при тому що частота СЕБ значно менша порівняно із пацієнтами інших груп (45,4 %). Для пацієнтів із дисплазією характерна максимальна інтенсивність скарги на гіркоту у роті порівняно із пацієнтами із кишковою метаплазією в антральному відділі шлунка (р < 0,01) та максимальна вираженість нудоти, що вірогідно більше порівняно із пацієнтами із кишковою метаплазією в антральному відділі шлунка (р < 0,01) та із мультифокальною кишковою метаплазією (р < 0,01). У пацієнтів із диспластичними змінами виражена інтенсивність негативного впливу симптомів на виконання роботи вдень, що була вірогідно вищою порівняно із хворими із атрофією (р < 0,05) та мультифокальною кишковою метаплазією (р < 0,01). Висновки. Клінічна симптоматика у хворих із передраковими станами та змінами слизової шлунка характеризується багатоформністю клінічних проявів функціональної диспепсії та не виключає проявів ГЕР, що ставить під сумнів оцінку стану хворого без проведення езофагогастродуоденоскопії та гістологічного дослідження для належної верифікації діагнозу. Особливої уваги потребують хворі із клінікою ГЕР, яка не виключає атрофічних та перебудовних змін слизової оболонки шлунка.
Актуальность. Хронический гастрит в значительной степени связан с клиническими проявлениями в виде диспепсии, однако часто даже в тяжелой форме протекает бессимптомно, что и обусловливает трудности его своевременной диагностики. Взаимосвязь клинических проявлений функциональной диспепсии и гастрита до сих пор вызывает ряд противоречий в связи с неопределенностью формы коморбидности. Цель исследования: изучить клинические проявления у пациентов с предраковыми состояниями слизистой желудка с учетом симптомокомплексов гастроэзофагеального рефлюкса (ГЭР) и функциональной диспепсии — синдрома эпигастральной боли (СЭБ) и постпрандиального дистресс-синдрома (ПДС). Материалы и методы. Обследовано 79 пациентов, которые по результатам морфологического исследования биоптатов разделены на группы: 1 группа (n = 13) — атрофические изменения слизистой оболочки желудка; 2 группа (n = 20) — кишечная метаплазия только в антральном отделе; 3 группа (n = 33) — диффузная кишечная метаплазия; 4 группа (n = 13) — пациенты с дисплазией. При изучении клинической картины анализировали базовые характеристики наличия, частоты и степени выраженности основных жалоб пациентов. Степень выраженности определяли по 5-балльной шкале Лайкерта. Все симптомы были сгруппированы в симптомокомплексы, характерные для ГЭР и для функциональной диспепсии с определением ПДС и СЭБ согласно Римским критериям. Результаты. Проявления функциональной диспепсии во всех случаях сочетались с клинической симптоматикой ГЭР. По интенсивности симптомов у всех обследованных доминировали симптомы функциональной диспепсии с преобладанием ПДС. Для пациентов с мультифокальной кишечной метаплазией характерной является максимальная симптоматика ГЭР, что в три раза больше, чем у пациентов с атрофией (р < 0,05). Также при мультифокальной кишечной метаплазии наблюдается максимальная частота симптомов как ПДС (71,4 %), так и СЭБ (63,6 %). При дисплазии ведущее значение имеют проявления ПДС — максимальное количество симптомов у 63,6 %, при этом частота СЭБ значительно меньше, чем у пациентов других групп (45,4 %). Для пациентов с дисплазией характерна максимальная интенсивность жалобы на горечь во рту по сравнению с пациентами с кишечной метаплазией в антральном отделе (р < 0,01) и максимальная выраженность тошноты, что достоверно больше по сравнению с пациентами с кишечной метаплазией в антральном отделе (р < 0,01) и с мультифокальной метаплазией (р < 0,01). У пациентов с дисплазией выражена интенсивность негативного влияния симптомов на выполнение работы днем, которая была достоверно выше, чем у пациентов с атрофией (р < 0,05) и мультифокальной кишечной метаплазией (р < 0,01). Выводы. Клиническая симптоматика у пациентов с предраковыми состояниями и изменениями слизистой желудка характеризуется многообразием клинических проявлений функциональной диспепсии и не исключает проявлений ГЭР, что ставит под сомнение оценку состояния пациента без проведения эзофагогастродуоденоскопии и гистологического исследования для должной верификации диагноза. Особого внимания требуют пациенты с симптомами ГЭР, которые не исключают атрофических и перестроечных процессов в слизистой оболочке желудка.
Background. Chronic gastritis is largely associated with clinical manifestations such as dyspepsia, but often, even in a severe form, it is asymptomatic, which causes difficulties in its timely diagnosis. The relationship of the clinical manifestations of functional dyspepsia and chronic gastritis still causes a number of contradictions due to the uncertainty of the form of comorbidity. Objective: to study the clinical manifestations in patients with precancerous lesions of the stomach, taking into account the symptoms of gastroesophageal reflux (GER) and functional dyspepsia — epigastric pain syndrome (EPS) and postprandial distress syndrome (PDS). Materials and methods. Seventy-nine patients were examined. According to the results of a morphological study, they were divided into groups: group 1 (n = 13) — atrophic changes in the gastric mucosa; group 2 (n = 20) — intestinal metaplasia only in the antrum; group 3 (n = 33) — diffuse intestinal metaplasia; group 4 (n = 13) — patients with dysplasia. We analyzed the basic characteristics of the presence, frequency and severity of the main complaints of patients. The severity was determined on a 5-point Likert scale. All symptoms were grouped into the sets of symptoms characteristic of GER and functional dyspepsia with the definition of PDS and EPS according to the Rome criteria. Results. Manifestations of functional dyspepsia in all cases were combined with the clinical symptoms of GER. Symptoms of functional dyspepsia with a predominance of PDS were most intensive in all examined people. For patients with multifocal intestinal metaplasia, the maximum symptomatology of GER is characteristic, which is three times more intensive than in patients with atrophy (p < 0.05). Also, with multifocal intestinal metaplasia, the maximum frequency of both symptoms of PDS (71.4 %) and EPS (63.6 %) is observed. With gastric dysplasia, the manifestations of PDS are of leading importance — the maximum number of symptoms was in 63.6 % of cases, while the frequency of EPS is much lower than in patients of other groups (45.4 %). Individuals with dysplasia are characterized by the maximum intensity of complaints of bitter taste in the mouth, compared to patients with intestinal metaplasia in the antrum (p < 0.01), and the maximum severity of nausea, which is significantly higher compared to people with intestinal metaplasia in the antrum (p < 0.01) and with multifocal metaplasia (p < 0.01). In patients with dysplasia, the intensity of the negative effect of symptoms on day work was expressed, which was significantly higher than in those with atrophy (p < 0.05) and multifocal intestinal metaplasia (p < 0.01). Conclusions. Our data suggest that clinical symptoms in patients with precancerous lesions and changes in the stomach are characterized by a variety of clinical manifestations of functional dyspepsia and do not exclude manifestations of GER, which casts doubt on the assessment of the patient’s condition without upper endoscopy and histological examination for proper verification of the diagnosis. Particular attention is required for patients with symptoms of GER, which do not exclude atrophic changes, intestinal metaplasia and dysplasia in the gastric mucosa.
Вступ
Актуальність проблеми своєчасної діагностики хронічного гастриту та пов’язаних із ним перебудовних і диспластичних станів зумовлена значним поширенням патології та складністю своєчасної неінвазивної діагностики. Сучасні ендоскопічні технології завдяки вузькоспектральній ендоскопії дозволяють визначити перебудовні та диспластичні зміни вже під час огляду слизової оболонки (СО), проте визначення хворих, яким необхідне проведення такого дослідження, має певні труднощі.
Клінічні прояви патології гастродуоденальної зони називають диспепсією. Вона складається із гетерогенної групи симптомів, що локалізуються в епігастральній ділянці і можуть бути визначені як біль або дискомфорт у верхній частині живота. Систематичні огляди демонструють, що в цілому близько 20 % популяції мають симптоми диспепсії [1]. Хронічні диспептичні симптоми за відсутності основного структурного або метаболічного захворювання, яке пояснило б симптоми, виділяють в окрему нозологічну форму — функціональну диспепсію (ФД, за Міжнародною класифікацією хвороб 10-го перегляду: К30). У клінічному перебігу ФД на сьогодні виділяють два симптомокомплекси — постпрандіальний дистрес-синдром (ПДС) та синдром епігастрального болю (СЕБ), наявність яких встановлюють згідно з Римськими критеріями, що мають важливе значення завдяки можливості забезпечити чітке визначення клінічної картини [2, 3].
З іншого боку, більше половини людей у всьому світі страждають від хронічного гастриту тієї чи іншої форми. Наслідком тривалого запалення при хронічному гастриті є деструкція СО шлунка із втратою шлункових залоз — формування атрофічного гастриту. При атрофічному гастриті, у свою чергу, існує високий ризик розвитку перебудовних змін у вигляді заміни втрачених залоз на нові незрілі, що схожі за будовою до тонко- або товстокишкових залоз — так звані елементи кишкової метаплазії, та ризик втрати архітектоніки клітин, тобто диспластичних змін, і, як наслідок, виникнення раку СО шлунка [4]. І хоча такі процеси відбуваються досить тривалий час — роки та десятиріччя, лише у близько 5 % хворих із хронічним гастритом тяжкі соціально-економічні наслідки такого захворювання, як рак шлунка, потребують пошуку механізмів і розробки алгоритмів своєчасного їх виявлення.
Із хронічним гастритом також значною мірою пов’язані клінічні прояви у вигляді диспепсії, проте у деяких хворих хронічний гастрит, а часто навіть у тяжкій формі, перебігає безсимптомно, що і зумовлює труднощі його своєчасної діагностики. Важливим недоліком захворювання є також відсутність певних патогномонічних клінічних проявів тяжких форм гастриту із перебудовними та диспластичними змінами. Отже, навколо варіантів патології верхнього відділу травного тракту: структурних змін СО шлунка з клінічними проявами та без них, клінічної симптоматики із структурними змінами та без них — існує чимала невизначеність. Ключовим є питання залежності чи незалежності поєднання цих двох форм, тобто має місце транссиндромальна чи транснозологічна коморбідність?
Як демонструє дослідження R.A. Brook із співавт., на підставі аналізу даних 300 тисяч обстежених, езофагіт, гастрит і дуоденіт вірогідно асоціюються із ФД (відношення шансів 3,8 і 3,7 відповідно) [5]. Ендоскопічні дослідження J.F. Guo із співавт., проведені через рік у 2350 хворих із первинно встановленим діагнозом ФД, дозволили ендоскопічно виявити наявність ознак неатрофічного (91,4 %) та атрофічного гастриту (13,9 %). Причому наявність абдомінального болю та постпрандіального дискомфорту були найчастішим приводом для проведення дослідження [6]. З іншого боку, результати багатоцентрового дослідження S.E. Kim із співавт. не продемонстрували вірогідної різниці у виявленні ознак атрофічного гастриту у пацієнтів з епігастральним болем та постпрандіальним дискомфортом і без симптомів. Такі результати виходять із ендоскопічного обстеження 3399 пацієнтів, з яких у 694 (20,4 %) були наявні симптоми, у 282 (40,6 %) виявлено ендоскопічні ознаки атрофічного гастриту [7].
Дані, отримані S.M. Arruda із співавт., відкривають такий важливий аспект проблеми, як критерії діагнозу «функціональна диспепсія» та роль ендоскопічного дослідження в його встановленні, оскільки, за їх даними, 25 % хворих із ендоскопічно встановленою ФД мають помірний, а 2,5 % – тяжкий ступінь гастриту за даними гістологічного дослідження [8]. Дещо пізніші дослідження Z. Wei із співавт. показали наявність у 36,3 % пацієнтів із ФД гістологічних ознак хронічного гастриту [9]. Більш ретельно співвідношення диспептичних проявів і гістологічних змін СО шлунка вивчено Y. Du зі співавт. [10]. Багатоцентрове дослідження охоплювало 8892 пацієнтів, з яких прояви диспепсії були відсутні лише у 13,1 % осіб. Наявні симптоми розподілилися таким чином: епігастральний біль — 52,9 %, здуття — 48,7 %, постпрандіальне переповнення — 14,3 % та раннє насичення — 12,7 %. Лише один симптом мали 53,9 %, а 32,9 % мали більше одного симптому. Результати гістологічного дослідження показали, що частота виявлення атрофічного гастриту та кишкової метаплазії становила 25,8 та 23,6 %, із невеликою кількістю хворих, на думку авторів, що мали тяжкий ступінь цих змін. Так, наявність дисплазії виявлено у 7,3 % хворих (n = 652), з них легка та помірна дисплазія — у 98,5 % (n = 642), у 10 осіб — тяжкий ступінь дисплазії [11]. Дещо інші дані отримані M.D. Hosam із співавт., які, за результатами гістологічного дослідження, у 65,7 % хворих із ендоскопічно встановленою ФД виявляли зміни СО, що розподілилися таким чином: нейтрофільна інфільтрація строми — 22,8 %, атрофія залоз — 42,8 %, помірна кишкова метаплазія — 5,7 %. Такі дані дозволили авторам зробити висновок про відсутність кореляції ендоскопічного діагнозу диспепсії із гістологічними даними [12].
Отже, невизначеність співвідношення клінічних проявів та тяжкості ураження СО шлунка не лише у зв’язку із наявністю H.pylori, але й з тяжкістю гастриту та розвитком передракових станів шлунка зумовлює необхідність розгляду скарг пацієнтів із хронічним гастритом із урахуванням симптомокомплексу функціональних розладів травного тракту, а саме ФД та гастроезофагеального рефлюксу (ГЕР).
Мета дослідження: вивчити клінічні прояви у хворих із передраковими станами шлунка за симптомокомплексами гастроезофагеального рефлюксу і функціональної диспепсії.
Матеріали та методи
Обстежено 79 хворих, які, за результатами морфологічного дослідження біоптатів шлунка, розподілені на групи: 1 група (n = 13) — атрофічні зміни СО шлунка; 2 група (n = 20) — кишкова метаплазія (КМ) в антральному відділі шлунка; 3 група (n = 33) — дифузна КМ; 4 група (n = 13) — хворі із дисплазією СО шлунка. Середній вік по групах становив: 1 група — (52,5 ± 4,2) року, 2 група — (56,5 ± 3,3) року, 3 група — (61 ± 2) року, 4 група — (60,1 ± 2,1) року.
Для вивчення клінічної картини обстежених хворих проведено опитування, що включало базові характеристики наявності, частоти та ступеня вираженості основних скарг хворих. Ступінь вираженості симптомів визначали за 5-бальною шкалою Лайкерта: незначна — 1 бал, легка — 2 бали, помірна — 3 бали, тяжка — 4 бали і дуже тяжка — 5 балів. Для оцінки клінічної картини всі симптоми хворих були згруповані у симптомокомплекси, характерні для ГЕР, для ФД з визначенням двох синдромів: ПДС та СЕБ згідно з Римськими критеріями.
Статистичний аналіз здійснювався з використанням програм Excel Microsoft Office 2010 із застосуванням методів варіаційної статистики. Для статистичного аналізу даних використовували дескриптивну статистику; порівняння середніх значень змінних здійснювали за допомогою параметричних методів (t-критерію Стьюдента, F-exact критерію) за нормального розподілу даних ознак. Статистична значимість різниці оцінювалась на рівні 95 % (ризик помилки р < 0,05).
Результати та обговорення
Як видно з даних табл. 1, у переважної більшості хворих усіх груп мали місце клінічні прояви обох симптомокомплексів — ГЕР та ФД. Причому у цих пацієнтів реєстрували симптоми, характерні як для СЕБ, так і для ПДС. У п’ятої частини хворих 2 групи і у 15,1 % у 3 групі прояви ФД характеризувалися лише симптомами ПДС. Безсимптомний перебіг спостерігали лише в 1 хворого, прояви лише ГЕР — у 3 обстежених. Прояви ФД в усіх випадках поєднувалися із клінічною симптоматикою ГЕР.
За інтенсивністю симптомів, згідно зі шкалою Лайкерта, у всіх обстежених домінуюче положення займали симптоми ФД (рис. 1). Інтенсивність проявів ГЕР між групами вірогідної різниці не мала. Важливими є дані про майже рівний рівень інтенсивності ГЕР у хворих із ознаками атрофії та КМ і у пацієнтів із дисплазією СО шлунка.
Клінічна картина проявів ГЕР включала в себе дев’ять питань, аналіз яких показав, що кількість хворих із позитивними відповідями на наявність симптомів рефлюксу була максимальною у 3 групі, що майже втричі більше порівняно із хворими 1 групи (р < 0,05) (рис. 2). У пацієнтів 2 та 4 групи максимальна симптоматика ГЕР спостерігалася у п’ятої частини обстежених.
Щодо аналізу окремих симптомів, то відмінності виявлено відносно частоти скарг на кислоту у роті із мінімальними проявами цього симптому у 1 групі та максимальними — у 3, застрягання їжі у стравоході із максимальною частотою у хворих 4 групи, та відрижку повітрям, яка була характерна для всіх груп, із мінімальною частотою у пацієнтів 2 групи (рис. 3).
Інтенсивність окремих симптомів ГЕР за бальною оцінкою подана на рис. 4, з якого видно, що у 1 групі інтенсивність скарги на кислоту у роті була максимальною. Як й охриплість голосу у цій групі, що вірогідно вище порівняно із 2 групою (р < 0,05), а гіркота у роті була максимальною у 4 групі, що вірогідно вище порівняно із пацієнтами 2 групи (р < 0,01).
Подібним чином до проявів ГЕР було проаналізовано й симптоми ФД. Отримані результати свідчать, що у переважної кількості хворих усіх груп спостерігається максимальна частота позитивних відповідей щодо симптомів ФД (рис. 5).
Інтенсивність проявів СЕБ і ПДС у групах наведено на рис. 6.
Подальший аналіз проведено залежно від наявності СЕБ або ПДС, який показав, що в 1, 2 і 3 групах у більшості хворих обидва питання щодо наявності СЕБ були позитивні, тоді як у 4 групі кількість таких пацієнтів була меншою в 1,6 раза порівняно із 1 групою, в 1,4 раза — із 2 групою та в 1,3 раза — із 3 групою. Це підтверджується і характером розподілу цього показника серед хворих, які в цілому мали симптоми СЕБ (рис. 7).
Характеристика інтенсивності клінічних симптомів, характерних для СЕБ по групах, подана на рис. 8. Як видно, хворі із дисплазією СО мали меншу інтенсивність болю в епігастрії після їди порівняно з іншими групами, а пацієнти із атрофією — меншу інтенсивність скарги на дискомфорт в епігастрії, не пов’язаний з їжею.
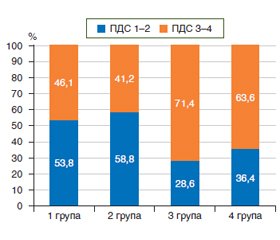
Розподіл хворих у групах залежно від кількості проявів ПДС показав значну кількість відповідей на три питання щодо його симптомів у хворих із мультифокальною КМ та дисплазією — 39,4 та 46,2 % відповідно (рис. 9). Максимальна кількість хворих із позитивними відповідями щодо ПДС спостерігалась у групі також із мультифокальною КМ — 71,4 %, що в 1,5 раза більше порівняно із 1 групою та у 1,7 раза — із 2 групою (р > 0,05). У пацієнтів із дисплазією відсоток таких відповідей також був істотний і становив 63,6 % (рис. 9).
Для подальшого аналізу нами відібрано скарги, що є складовими синдрому постпрандіальної диспепсії, інтенсивність яких подана на рис. 10.
Такий симптом, як нудота, мав вірогідні відмінності між групами і максимальну інтенсивність у групі осіб із диспластичними змінами СО, що вірогідно більше порівняно із пацієнтами із КМ в антральному відділі шлунка та із мультифокальною КМ (р < 0,01 і р < 0,01 відповідно).
Порушення основних компонентів якості життя пацієнтів в аспекті наявності клінічних проявів і синдромів. Основними складовими якості життя пацієнтів були такі: порушення симптомами якості сну, вплив симптомів на прийом їжі та на виконання роботи вдень, які оцінені за частотою виникнення та їх тяжкістю для пацієнта.
Особливістю параметрів якості життя у групах є виражена інтенсивність впливу симптомів на виконання роботи вдень у пацієнтів із диспластичними змінами СО шлунка, яка була вірогідно вищою порівняно із хворими із атрофією (р < 0,05) та мультифокальною КМ (р < 0,01) (рис. 11).
Висновки
1. У клінічній симптоматиці більшості хворих з атрофічними та перебудовними змінами СО шлунка мають місце прояви симптомокомплексів ГЕР та ФД із реєстрацією симптомів як СЕБ, так і ПДС. У п’ятої частини хворих 2 групи й у 15,1 % у 3 групі прояви ФД характеризувалися лише симптомами ПДС.
2. Домінуюче положення в усіх обстежених за інтенсивністю симптомів займають симптоми ФД з перевагою інтенсивності симптомів ПДС при відсутності вірогідної різниці інтенсивності проявів ГЕР між групами.
3. Для пацієнтів із мультифокальною КМ характерною є максимальна симптоматика ГЕР, що втричі більше порівняно із пацієнтами із атрофією (р < 0,05). Також при мультифокальній КМ спостерігається максимальна вираженість симптомів як ПДС (71,4 %), так і СЕБ (63,6 %). При дисплазії СО провідне значення мають прояви ПДС — максимальна кількість наявних симптомів у 63,6 %, при тому що частота СЕБ значно менша порівняно із пацієнтами інших груп (45,4 %).
4. Для пацієнтів із дисплазією СО характерна максимальна інтенсивність скарги на гіркоту у роті, яка вірогідно вища порівняно із пацієнтами із КМ в антральному відділі шлунка (р < 0,01), та максимальна вираженість нудоти, що вірогідно більше порівняно із пацієнтами із КМ в антральному відділі шлунка та із мультифокальною КМ (р < 0,01 і р < 0,01 відповідно).
5. У пацієнтів із диспластичними змінами СО шлунка виражена інтенсивність негативного впливу симптомів на виконання роботи вдень, яка була вірогідно вищою порівняно із хворими із атрофією (р < 0,05) та мультифокальною КМ (р < 0,01).
Отже, клінічна симптоматика у хворих із передраковими станами та змінами СО шлунка характеризується багатоформністю клінічних проявів та не виключає проявів ГЕР, що ставить під сумнів оцінку стану хворого без повноцінного обстеження з проведенням езофагогастродуоденоскопії і гістологічним дослідженням біоптатів для належної верифікації діагнозу. Особливої уваги потребують хворі із клінікою ГЕР, яка не виключає атрофічних і перебудовних змін СО шлунка. Попереднє призначення інгібіторів протонної помпи без обстеження може дати позитивний ефект з боку симптоматики, проте негативно вплинути на перебіг гастриту.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Інформація про фінансування. Робота виконана у межах НДР «Вивчити особливості функціонально-структурних змін слизової оболонки шлунка у хворих з передраковими станами та розробити критерії формування груп ризику і алгоритм лікувальних заходів», ВН 25.01.002.16.
Внесок авторів у підготовку статті: Кушніренко І.В. — дослідження клінічної симптоматики, статистична обробка та аналіз отриманих даних, викладення результатів і формулювання висновків; Мосійчук Л.М. — загальне керування проєктом; Сімонова О.В. — проведення та аналіз результатів ендоскопічного дослідження.
Список литературы
1. Moayyedi P., Lacy B.E., Andrews C.N., Enns R.A., Howden C.W., Vakil N. ACG and CAG Clinical Guideline: Management of Dyspepsia. Am. J. Gastroenterol. 2017 Jul. 112(7). 988-1013. doi: 10.1038/ajg.2017.154.
2. Schmulson M. How to use Rome IV criteria in the evaluation of esophageal disorders. Curr. Opin. Gastroenterol. 2018 Jul. 34(4). 258-265. doi: 10.1097/MOG.0000000000000443.
3. Drossman D.A. Functional Gastrointestinal Disorders: History, Pathophysiology, Clinical Features and Rome IV. Gastroenterology. 2016 Feb 19. S0016-5085(16)00223-7. doi: 10.1053/j.gastro.2016.02.032.
4. Sipponen P., Maaroos H.I. Chronic gastritis. Scand. J. Gastroenterol. 2015 Jun. 50(6). 657-67. doi: 10.3109/00365521.2015.1019918.
5. Brook R.A., Kleinman N.L., Choung R.S., Smeeding J.E., Talley N.J. Excess comorbidity prevalence and cost associated with functional dyspepsia in an employed population. Dig. Dis. Sci. 2012 Jan. 57(1). 109-18. doi: 10.1007/s10620-011-1822-8.
6. Guo J.F., Bai Y., Li Z.S. Diagnostic yield of repeat upper gastrointestinal endoscopy for patients with functional dyspepsia. J. Dig. Dis. 2013 Nov. 14(11). 574-8. doi: 10.1111/1751-2980.12090.
7. Kim S.E., Park H.K., Kim N., Joo Y.E., Baik G.H., Shin J.E. et al. Prevalence and risk factors of functional dyspepsia: a nationwide multicenter prospective study in Korea. J. Clin. Gastroenterol. 2014 Feb. 48(2). e12-8. doi: 10.1097/MCG.0b013e31828f4bc9.
8. Arruda S.M., Forones N.M., Jucá N.T., de Barros K.S. Gould gastric histology be a useful marker for making decision on Helicobacter pylori eradication therapy in patients with dyspepsia? Arq. Gastroenterol. 2009 Jul-Sep. 46(3). 209-13. doi: 10.1590/s0004-28032009000300013.
9. Wei Z., Ying L., Wen G., Mengnan Z., Yali Z. ROME III criteria cannot distinguish patients with chronic gastritis from those functional dyspepsia patients. Helicobacter. 2014 Apr. 19(2). 124-8. doi: 10.1111/hel.12108.
10. Du Y., Bai Y., Xie P., Fang J., Wang X., Hou X. et al. Chronic gastritis in China: a national multi-center survey. BMC Gastroenterol. 2014 Feb 7. 14. 21. doi: 10.1186/1471-230X-14-21.
11. Dawod H.M., Emara M.W. Histopathological Assessment of Dyspepsia in the Absence of Endoscopic Mucosal Lesions. Euroasian J. Hepatogastroenterol. 2016 Jul-Dec. 6(2). 97-102. doi: 10.5005/jp-journals-10018-1178.
/13_2.jpg)

/11.jpg)
/11_2.jpg)
/12.jpg)
/12_2.jpg)
/13.jpg)
/13_3.jpg)
/14.jpg)