Вступ
Лікування артеріальної гіпертензії (АГ) на сьогодні залишається складним завданням сучасної медицини з огляду на високу частоту у хворих коморбідних станів, резистентної АГ, тривають пошуки оптимальних комбінацій для досягнення цільових значень артеріального тиску (АТ) і профілактики ускладнень. Резистентна АГ найчастіше зустрічається у хворих на хронічну хворобу нирок (ХХН), а за наявності цукрового діабету (ЦД) і ХХН пацієнт належить до категорії дуже високого кардіоваскулярного ризику (КВР). Сучасні підходи до лікування хворих на АГ високого й дуже високого КВР значно розширюють показання до застосування комбінованої антигіпертензивної терапії, що передбачає призначення як стартової терапії комбінації двох або більше препаратів, враховують наявність органопротекторних властивостей антигіпертензивних засобів. Серед переваг фіксованих комбінацій можна відзначити більш виражений гіпотензивний ефект, меншу частоту розвитку побічних реакцій, простоту призначення й процесу титрування дози [1, 9]. Як показали метааналізи досліджень, застосування фіксованих комбінацій підвищує прихильність пацієнтів до антигіпертензивної терапії на 24 % [2]. Звичайно, переваги комбінованої терапії притаманні виключно раціональним комбінаціям. Високу зацікавленість клініцистів останнім часом викликає використання в клінічній практиці комбінації інгібітору ангіотензинперетворюючого ферменту (іАПФ) і дигідропіридинового антагоніста кальцію (АК), що обумовлено, по-перше, рекомендаціями Європейського товариства кардіологів від 2018 року (це препарати вибору й оптимальна комбінована стартова терапія в стратегії медикаментозного лікування неускладненої гіпертензії, а також при поєднанні АГ із ХХН) [1], а по-друге, результатами численних досліджень, зокрема ASCOT і ACCOMPLISH. У дослідженні ASCOT показана більш висока ефективність комбінації дигідропіридинового АК та іАПФ порівняно з комбінацією бета-блокатора і гідрохлортіазиду щодо зниження АТ і ризику серцево-судинних подій [7]. Дані дослідження ACCOMPLISH продемонстрували вірогідну перевагу комбінації амлодипіну й іАПФ перед комбінацією гідрохлортіазиду й іАПФ в зниженні ризику інфаркту міокарда, коронарної смерті, розвитку ниркової дисфункції і нових випадків ЦД. Згідно з рекомендаціями Європейського товариства кардіологів та Асоціації кардіологів України, у стратегії медикаментозного лікування АГ у поєднанні з ЦД, ІХС або ХХН як початкова терапія пропонується подвійна комбінація іАПФ або БРА з АК [1, 13].
Атеросклероз, що розвивається в судинній стінці, призводить до порушення барорефлекторної регуляції АТ, посилення транспорту іонів кальцію через мембрану тучних клітин, підвищення продукції нейрогормонів, зниження еластичності аорти й великих артерій. Підвищення на цьому тлі судинного тонусу й ремоделювання судин викликає дисфункцію ендотелію і збільшення рівня АТ. Саме цим пояснюється доцільність застосування при АГ препаратів, здатних не тільки знижувати рівень АТ, але й запобігати прогресуванню атеросклерозу. Для хворих із ЦД і нефропатією пріоритети у використанні мають комбінації іАПФ або БРА. Саме ці препарати здатні уповільнити прогресування нефропатії і забезпечити регресію протеїнурії.
Амлодипін — один з найбільш ефективних і добре вивчених дигідропіридинових АК з позиції доказової медицини, що характеризується не тільки високою антигіпертензивною ефективністю, а й антиатерогенною та антиішемічною дією [5, 10, 12]. У хворих із ЦД 2-го типу ефективна антигіпертензивна терапія амлодипіном сприяє зниженню інсулінорезистентності тканин за індексом HOMA і зниженню рівня фактора некрозу пухлини [6].
Інгібітор АПФ лізиноприл також є унікальним серед препаратів свого класу, оскільки його активність не залежить від функції печінки. Це робить його препаратом вибору, наприклад, у пацієнтів зі стеатогепатозом, хронічними гепатитами. Численні дослідження демонструють органопротекторні властивості лізиноприлу: кардіо-, нейро-, нефропротекторні ефекти, а також додаткові плейотропні ефекти в зниженні серцево-судинного ризику — вплив на рівень сечової кислоти [8], що є актуальним для пацієнтів із ХХН у зв’язку з розвитком вторинної подагри й для пацієнтів із метаболічним синдромом. Отже, додаткові позитивні метаболічні ефекти лізиноприлу щодо вуглеводного обміну потрібно враховувати при виборі антигіпертензивної комбінації пацієнтам із ЦД [15].
Нерідко пацієнти з АГ мають ниркову дисфункцію, поєднання порушень вуглеводного, жирового й пуринового обміну. Ожиріння, відповідальне за розвиток жирового перетворення гепатоцитів, призводить до інсулінорезистентності, прогресування атеросклеротичного ураження судин і ризику серцево-судинних подій. Разом з тим гіперінсулінемія стимулює вироблення факторів росту, що веде до проліферації гладком’язових клітин і фібробластів і в підсумку — до вазоконстрикції [3]. У дослідженні TROPHY за участю 232 хворих на ожиріння й АГ була показана вірогідна перевага лізиноприлу перед гідрохлортіазидом за впливом на варіабельність АТ [11].
Хворі, які мають поєднання ЦД і АГ, розглядаються як група високого ризику серцево-судинних ускладнень і ускладнень ЦД (як макро-, так і мікроангіопатії, ретинопатії, нефропатії). Ефективне зниження АТ у хворих із ЦД не менш значуще для зниження ризику ускладнень, ніж ретельний контроль глікемії. Показано, що початок лікування хворих з АГ відразу з фіксованих комбінацій дозволяє покращити контроль АТ і досягти нормалізації АТ протягом 1 року в 68 % хворих, що значно більше, ніж при використанні монотерапії або вільних комбінацій (59 % хворих) [4, 9].
Прикладом раціональної комбінації «дигідропіридиновий АК + іАПФ» є препарат Екватор («Гедеон Ріхтер», Угорщина), що містить фіксовану комбінацію лізиноприлу й амлодипіну в дозах 10/5, 20/5 і 20/10 мг відповідно. Різноманітність вибору й простота процесу титрування доз дозволяють індивідуалізувати підхід до лікування хворих залежно від ступеня АГ.
Мета дослідження: клінічна оцінка ефективності фіксованої комбінації лізиноприлу з амлодипіном (Екватор) у дозі 20/10 мг у лікуванні АГ у пацієнтів із ХХН ІІІ стадії на тлі ЦД 2-го типу.
Матеріали та методи
У дослідження включено 40 пацієнтів (чоловіків — 22, жінок — 18) із ХХН ІІІ стадії (діабетична нефропатія) і АГ, які перебували на амбулаторному лікуванні в умовах Київського міського центру нефрології та діалізу. У пацієнтів, які увійшли в дослідження, при офісному вимірюванні АТ фіксувалася АГ I–II ступеня (ESH/ESC 2018). Усім пацієнтам визначали індекс маси тла, лабораторні показники: рівень креатиніну для розрахунку швидкості клубочкової фільтрації, сечову кислоту, сечовину, гемоглобін крові, сироваткові рівні альбуміну, загального білка, загального холестерину, тригліцеридів, ліпопротеїдів високої щільності, ліпопротеїдів низької щільності, добову протеїнурію, електроліти крові, паратгормон (табл. 1). Офісне вимірювання АТ виконували з аналізом систолічного АТ (САТ), діастолічного АТ (ДАТ), пульсового АТ. За цільовий рівень АТ приймали середній АТ ≤ 135/85 мм рт.ст. у домашніх умовах. Добовий моніторинг АТ (ДМАТ) проводився за допомогою портативної системи монітора АТ ABPM-04, Meditech (Угорщина) після попереднього інструктажу пацієнта у звичайному режимі фізичної активності з постійним автоматичним вимірюванням АТ з інтервалом 15 хв у денний час і кожні 30 хв у нічний час. Аналіз лабораторних показників проводили в динаміці впродовж 3 місяців, ДМАТ — через 3 тижні від початку призначення фіксованої комбінації лізиноприлу з амлодипіном 20/10 мг.
/6_u.jpg)
Критерії виключення: відмова хворого від участі в дослідженні, гострі порушення мозкового кровообігу в анамнезі, хронічна серцева недостатність III–IV функціонального класу (за класифікацією NYHA), гострі інфекційні процеси будь-якої етіології, анемія тяжкого й середнього ступеня, трансплантація нирки в анамнезі, цироз печінки будь-якої етіології, онкологічні захворювання, алкогольна залежність, ревматологічні захворювання. Дослідження проведено відповідно до принципів біоетики з дотриманням правил безпеки пацієнтів, при збереженні прав пацієнтів, а також з дотриманням морально-етичних норм відповідно до основних нормативних актів.
Статистичний аналіз отриманих даних проводився за допомогою програмного пакета Statistica SPSS 12.0 для Windows. При нормальному розподілі дані наведені як середнє ± стандартне відхилення, в інших випадках — як медіана [25–75-й перцентилі]. Для оцінки значущості міжгрупових відмінностей використовувався метод Пірсона. При перевірці гіпотез за критичний рівень значущості р прийнято значення 0,05. Для оцінки ступеня взаємозв’язку кількісних ознак використовували коефіцієнт рангової кореляції Спірмена.
Результати
При проведенні ДМАТ в обстежуваних хворих середні показники нічних і денних САТ, ДАТ, індексу часу, варіабельності тиску значно перевищували нормальні значення, що подано в табл. 2.
За добовим індексом САТ і ДАТ серед обстежених хворих переважали несприятливі типи добових профілів АТ, а саме non-dipper (їх кількість становила 85 %) і night-peakers (зареєстровано в 10 % пацієнтів).
Отримані результати щодо швидкості ранкового підйому (ШРП) і САТ, і ДАТ демонструють їх значне підвищення, що перевищувало нормальні значення у 2,3 раза.
За результатами ДМАТ обстежених пацієнтів до призначення Екватору було виявлено, що всі показники навантаження високим тиском перевищують цільові значення в денний, нічний час і за добу в цілому.
Аналіз гемодинамічних показників на фоні 3-тижневого лікування препаратом Екватор у дозі 20/10 мг виявив зниження середніх значень САТ і ДАТ, що наведено в табл. 3.
Порівняльний аналіз САТ у динаміці на тлі лікування продемонстрував вірогідне (р < 0,05) зниження денного САТ на 14,7 % і нічного САТ — на 16,7 %. Денний ДАТ знизився на 10,4 %, нічний ДАТ зменшився на 8,5 %.
При аналізі показників індексу часу денного САТ і денного ДАТ упродовж періоду спостереження відмічене зниження на 6 і 12,5 % відповідно (р < 0,05). Що стосується індексу часу за нічний період, то його зниження було більш значним: так, нічний САТ став нижче на 8 %, нічний ДАТ — на 15 % (обидва р < 0,05).
На фоні 3-тижневої антигіпертензивної терапії з додаванням препарату Екватор відмічається статистично значимий приріст осіб із добовими профілем dipper з 28,3 до 54,5 % у загальній структурі (р < 0,05 %). Частка пацієнтів із профілем non-dipper, навпаки, знизилася з 36,5 до 22,4 %, як і частка пацієнтів із добовим профілем АТ night-peakear — з 22,4 до 6,8 % (р < 0,05 %).
Аналіз рівня добової протеїнурії за час дослідження в динамці через 3 місяці продемонстрував нефропротекторні властивості Екватору: спостерігалося вірогідне зменшення добової протеїнурії, що продемонстровано в табл. 3.
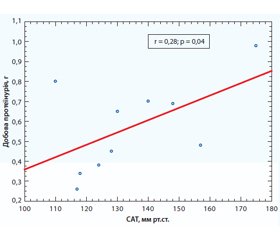
Аналіз кореляційних зв’язків виявив позитивні зв’язки — зменшення добової протеїнурії на фоні зниження рівнів САТ (r = 0,28, р = 0,04), що продемонстровано на рис. 1.
Висновки
Клінічна оцінка використання фіксованої комбінації лізиноприлу й амлодипіну в дозі 20/10 мг у лікуванні АГ у пацієнтів із ХХН III стадії з діабетичною нефропатією продемонструвала ефективність і безпечність препарату Екватор для пацієнтів дуже високого КВР. Достатній антигіпертензивний ефект супроводжувався позитивними змінами добових профілів АТ. Так, за даними ДМАТ відмічається статистично значимий приріст осіб із добовим профілем dipper з 28,3 до 54,5 %, частка пацієнтів з профілем non-dipper знизилася з 36,5 до 22,4 %, як і частка пацієнтів з добовим профілем АТ night-peakear — з 22,4 до 6,8 % (р < 0,05 %), що можна розглядати як суттєву профілактику ризику кардіоваскулярних подій. Зниження рівня добової протеїнурії підтверджує нефропротекторні властивості даної комбінованої терапії, що сприяє сповільненню темпів прогресування ХХН.
Список литературы
1. 2018 ESC/ESH Guidelines for the management of arterial hypertension. European Heart Journal. 2018. Vol. 39. Issue 33. P. 3021-3104.
2. Bangalore S., Kamalakkannan G., Parkar S., Messerli F.H. Fixed-dose combinations improve medication compliance: a meta-analysis. Am. J. Med. 2007. Vol. 120. № 8. P. 713-719.
3. Cleland S.J., Petrie J.R., Ueda S., Elliott H.L., Connell J.M. Insulin as a vascular hormone: implications for the pathophysiology of cardiovascular disease. Clin. Exp. Pharmacol. Physiol. 1998. 25 (3–4). 175-84.
4. Egan B.M., Bandyopadhyay D., Shaftman S.R. et al. Initial monotherapy and combination therapy and hypertension control the first year. Hypertension. 2012 Jun. 59 (6). 1124-1131.
5. Effectiveness and safety of combined antihypertensive and cholesterol-reducing therapy (lisinopril-amlodipine and rosuvastatin) in high and very high risk patient populations. Cardiologia Hungarica. 2015. Vol. 45. P. 71-83.
6. Ersoy C., Imamoğlu S., Budak F. et al. Effect of amlodipine on insulin resistance & tumor necrosis factor-alpha levels in hypertensive obese type 2 diabetic patients. Indian J. Med Res. 2004 Nov. 120 (5). 481-488.
7. Dahlof B., Sever P.S., Poulter N.R. et al. Prevention of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm (ASCOT-BPLA): a multicentre randomised controlled trial. Lancet. 2005. Vol. 366. № 9489. P. 895-906.
8. Drazner M.H. The progression of hypertensive heart disease. Circulation. 2011. Vol. 123. № 3. P. 327-334.
9. Gradman A.H., Parisé H., Lefebvre P. et al. Initial combination therapy reduces the risk of cardiovascular events in hypertensive patients: a matched cohort study. Hypertension. 2013 Feb. 61(2). 309-318.
10. Kloner R.A., Neutel J., Roth E.M. et al. Blood pressure control with amlodipine add-on therapy in patients with hypertension and diabetes: results of the Amlodipine Diabetic Hypertension Efficacy Response Evaluation Trial. Ann Pharmacother. 2008 Nov. 42(11). 1552-1562.
11. Reisin E., Weir M.R., Falkner B. et al. Lisinopril versus hydrochlorothiazide in obese hypertensive patients: a multicenter placebo-controlled trial. Treatment in Obese Patients With Hypertension (TROPHY) Study Group. Hypertension. 1997. Vol. 30. № 1. Pt. 1. P. 140-145.
12. Zamorano J., Rodriguez Padial L., Cosín J. et al. Amlodipine reduces predicted risk of coronary heart disease in high-risk patients with hypertension in Spain (The CORONARIA Study). J. Int. Med. Res. 2008 Nov-Dec; 36 (6). 1399-1417.
13. Класифікація та стандарти надання медичної допомоги хворим на артеріальну гіпертензію Асоціації кардіологів України. Артеріальна гіпертензія. 2018. 4(60).
14. Лазарев П.О. Як правильно вибрати й призначити інгібітор АПФ. Новини медицини і фармації. 2019. № 4(686).
15. Остроумова О.Д. Лечение артериальной гипертензии при метаболическом синдроме. Артериальная гипертензия. 2012. № 3.

/6_u.jpg)
/7_u.jpg)
/7_u2.jpg)