Журнал «Травма» Том 21, №1, 2020
Вернуться к номеру
Роль візуалізаційних методів дослідження в діагностиці та менеджменті аксіального спондилоартриту
Авторы: Головач І.Ю.(1), Єгудіна Є.Д.(2), Тер-Вартаньян С.Х.(2)
(1) — Клінічна лікарня «Феофанія» Державного управління справами, м. Київ, Україна
(2) — Клініка сучасної ревматології, м. Київ, Україна
Рубрики: Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Труднощі діагностики спондилоартритів обумовлені в основному повільним, зазвичай протягом декількох років, розвитком характерних рентгенологічних змін (сакроілеїт, синдесмофіти та ін.). Магнітно-резонансна томографія (МРТ) крижово-клубових суглобів вважається провідним візуалізаційним методом дослідження в ранній діагностиці аксіального спондилоартриту (аксСпА) і відіграє важливу роль у прогнозуванні перебігу цього захворювання. МРТ дозволяє виявити запальні зміни різних тканин, у першу чергу набряк кісткового мозку, який передує розвитку структурних змін. Однак обмежений доступ до МРТ, висока вартість цього дослідження і брак досвіду лікарів-діагностів в інтерпретації МРТ сприяли відродженню інтересу до комп’ютерної томографії (КТ), особливо до розробки протоколів з випромінюванням малої інтенсивності для оцінки крижово-клубових суглобів. Дослідження оцінки ефективності інгібіторів фактора некрозу пухлини у пацієнтів з нерентгенографічним аксСпА привели до кращого розуміння ролі МРТ і КТ у відборі пацієнтів, які можуть добре відповідати на цю терапію. Діагностична цінність активних і структурних ушкоджень для оцінки прогностичного ризику і вибору підходящого лікування також є галуззю сучасних досліджень. Метою цього огляду літератури є характеристика діагностичної оцінки аксСпА з використанням звичайної рентгенографії, КТ та МРТ і можливості застосування різних методів на практиці. Обговорюються нові перспективні дані, що пояснюють еволюцію недавно описаних на МРТ уражень і те, як ці дані можуть поліпшити розуміння ролі МРТ як діагностичного та прогностичного інструмента згідно з новими рекомендаціями ASAS з МРТ-діагностики аксСпА.
Трудности диагностики спондилоартритов обусловлены в основном медленным, обычно в течение нескольких лет, развитием характерных рентгенологических изменений (сакроилеит, синдесмофиты и др.). Магнитно-резонансная томография (МРТ) крестцово-подвздошных суставов считается ведущим визуализационным методом исследования в ранней диагностике аксиального спондилоартрита (аксСпА) и играет важную роль в прогнозировании течения этого заболевания. МРТ позволяет выявить воспалительные изменения различных тканей, в первую очередь отек костного мозга, который предшествует развитию структурных изменений. Однако ограниченный доступ к МРТ, высокая стоимость этого исследования и недостаток опыта врачей-диагностов в интерпретации МРТ привели к возрождению интереса к компьютерной томографии (КТ), особенно к разработке протоколов с излучением малой интенсивности для оценки крестцово-подвздошных суставов. Исследования оценки эффективности ингибиторов фактора некроза опухоли у пациентов с нерентгенографическим аксСпА обусловили лучшее понимание роли МРТ и КТ в отборе пациентов, которые могут хорошо отвечать на эту терапию. Диагностическая ценность активных и структурных повреждений для оценки прогностического риска и выбора подходящего лечения также является областью современных исследований. Цель данного обзора литературы — характеристика диагностической оценки аксСпА с использованием обычной рентгенографии, КТ и МРТ и возможности применения различных методов на практике. Обсуждаются новые перспективные данные, поясняющие эволюцию недавно описанных на МРТ поражений и то, как эти данные могут улучшить понимание роли МРТ как диагностического и прогностического инструмента согласно новым рекомендациям ASAS по МРТ-диагностике аксСпА.
Difficulties in the diagnosis of spondyloarthritis are mainly due to the slow, usually for several years, development of characteristic radiological changes (sacroiliitis, syndesmophytes, etc.). Magnetic resonance imaging (MRI) of the sacroiliac joints is considered the leading imaging method in the early diagnosis of axial spondyloarthritis and plays an important role in predicting the disease course. MRI helps detect inflammatory changes in various tissues, primarily bone edema, which precedes the development of structural changes. However, the limited access to MRI, the high cost of this study, and the lack of expertise in interpretation have revived interest in computed tomography (CT), especially the development of low-intensity radiation protocols for assessing the sacroiliac joints. Trials evaluating the efficacy of tumor necrosis factor inhibitors in patients with non-radiographic axial spondyloarthritis have led to a better understanding of MRI and CT role in selecting patients, which might respond well to this therapy. The diagnostic value of active and structural damage in assessing prognostic risk and selecting the appropriate treatment is also an area of modern researches. The purpose of this literature review is to characterize the diagnostic assessment of axial spondyloarthritis using conventional radiography, CT and MRI and the possibility of applying various methods in practice. New promising data are discussed explaining the evolution of recently described MRI lesions and how these data can improve understanding of MRI role as a diagnostic and prognostic tool according to new recommendations of the Assessment of SpondyloArthritis international Society for MRI diagnosis of axial spondyloarthritis.
аксіальний спондилоартрит; діагностика; МРТ, КТ, рентгенографія
аксиальный спондилоартрит; диагностика; МРТ, КТ, рентгенография
axial spondyloarthritis; diagnosis; magnetic resonance imaging; computed tomography; radiography
Вступ
На даний момент рання діагностика аксіального спондилоартриту (аксСпА) являє значні проблеми для клініцистів, які проводять оцінку і менеджмент пацієнтів з болями у спині [1]. Синдром болю в нижній частині спини часто зустрічається в популяції в цілому. Він може бути специфічною ознакою, що вказує на запалення в крижово-клубових суглобах (ККС) і хребті, не маючи специфічності щодо інших причин болю в спині, таких як дегенеративні захворювання. Лабораторна оцінка обмежується неспецифічними гострофазовими білками і генетичним маркером HLA-B27. Структурне прогресування до розвитку анкілозів хребта відбувається повільно, зазвичай упродовж декількох років та навіть десятиліть. Утім мало що відомо про прогностичні показники, які могли б допомогти стратифікувати пацієнтів із прогресуючим перебігом, що вимагає якомога більш раннього лікування біологічними хворобомодифікуючими препаратами.
Рентгенографія кісток таза була основним елементом діагностичної оцінки аксСпА протягом останніх декількох десятиліть. Обмежена надійність і чутливість рентгенографії крижово-клубових суглобів і хребта при спондилоартриті (СпА) обмежують призначення потенційно ефективної терапії, що модифікує захворювання. Нині цікавість до більш чутливих методів візуалізації при аксСпА зростає в геометричній прогресії для удосконалення ранньої діагностики та прогностичної оцінки захворювання. Зокрема, розширюється спектр високоефективних терапевтичних агентів [2], при цьому підкреслюється важливість ранньої діагностики, відкриваються можливості для більш ефективного та сталого контролю захворювання і підвищується ймовірність запобігання довгостроковим структурним ушкодженням.
За останні 2 роки технічні розробки комп’ютерної томографії (КТ), магнітно-резонансної томографії (МРТ) та збільшення роздільної здатності зображень підвищили їх можливості й цінність для використання в клінічній практиці і особливо для виявлення структурних ушкоджень. Комп’ютерну томографію ККС і хребта тепер можна виконувати з використанням низькорадіаційних методів без обмежень для оцінки при візуалізації, тоді як використання нових режимів у МРТ поліпшило зображення осьових відділів.
Метою цього огляду літератури є характеристика діагностичної оцінки аксСпА з використанням звичайної рентгенографії, КТ, МРТ і можливості застосування цих методів на практиці. Проведено аналіз ефективності передових методів візуалізації для поліпшення діагностики та менеджменту пацієнтів з аксСпА. Обговорюються нові перспективні дані, що пояснюють еволюцію недавно описаних на МРТ уражень і те, як ці дані можуть поліпшити розуміння ролі МРТ як діагностичного та прогностичного інструмента згідно з новими рекомендаціями ASAS (Міжнародної робочої групи з вивчення СпА) з МРТ-діагностики аксСпА. Узагальнено нові напрямки у використанні візуалізації для оцінки хворобомодифікуючого потенціалу терапевтичних агентів.
Рентгенографія
Рентгенографія кісток таза для виявлення сакро-ілеїту продовжує залишатися найбільш широко використовуваним методом візуалізації для діагностичної оцінки, хоча останні дані когортних досліджень підкреслюють як обмежену чутливість, так і низьку надійність цього методу візуалізації у пацієнтів з підозрою на ранню стадію аксСпА. Вірогідний рентгенографічний сакроілеїт відповідно до модифікованих Нью-Йоркських класифікаційних критеріїв було виявлено тільки у 13,5 % з 684 пацієнтів віком від 18 до 50 років із симптомами запального болю в спині протягом 3 років в когорті DЕvenir des Spondylarthopathies Indifférenciées Récentes (DESIR) (французька когорта пацієнтів з недиференційованим СпА) [3, 4]. Крім того, ці критерії були виявлені тільки у 11,6 % з 500 пацієнтів у когорті SРondyloАrthritis Caught Early (SPACE) із недіагностованим болем у спині тривалістю < 2 років та появою симптомів у віці < 45 років [5, 6].
За оцінкою 110 пацієнтів із недіагностованим болем у спині та підозрюваним діагнозом аксСпА продемонстровано, що традиційна рентгенографія «пропустила» діагноз у більше ніж 2/3 пацієнтів зі структурними змінами, характерними для аксСпА, за даними КТ [7]. Незважаючи на ці обмеження, і EULAR, і Європейське співтовариство скелетно-м’язової радіології (European Society of Musculoskeletal Radiology, ESSR) рекомендують звичайну рентгенографію ККС як перший метод візуалізації задля діагностичної оцінки пацієнта з аксСпА, головним чином з причин низької вартості й доступності [8, 9]. Однак вагомі аргументи на користь використання вдосконаленої візуалізації МРТ виправдані в ситуаціях, коли результати рентгенографії не є абсолютно певними для сакроілеїту, у разі прийняття рішення про патогенетичне лікуванні через вираженість симптомів у пацієнта і необхідності діагностичної вірогідності результатів. Це підтверджується зростаючими даними про можливості запобігання структурним змінам у пацієнтів з аксСпА за допомогою доступних на даний час біологічних хворобомодифікуючих препаратів, що підкреслює важливість ранньої і претензійної діагностики [10].
Комп’ютерна томографія
Комп’ютерна томографія ККС постає більш чутливим методом дослідження, аніж звичайна рентгенографія. Метод надійніше виявляє структурні аномалії, оскільки відображає складну анатомію ККС в тривимірному вигляді [11]. Проте висока доза опромінення при стандартній КТ виключає рутинне використання цього методу діагностики для оцінки пацієнтів з аксСпА [12].
КТ дозволяє проводити добру диференціацію «кістка — хрящ» без накладання кісткових структур або кишечника з високою чутливістю для виявлення сакроілеїту [11]. Додатковою перевагою використання низькопільної КТ порівняно зі звичайною рентгенографією є покращений контроль за ділянкою, що піддається впливу пучка випромінювання [13]. Ці спостереження вказують, що доза від сучасної мультидетекторної КТ може бути додатково зменшена шляхом оптимізації положення зрізу і кута нахилу рентген-пучка. Зважаючи на ці висновки і більш низькі витрати на КТ порівняно з МРТ, на даний час розумно запропонувати низькопільну КТ для рутинної діагностичної оцінки пацієнтів з аксСпА замість звичайної рентгенографії, особливо там, де доступ до МРТ є обмеженим. Цей метод візуалізації має переваги для кількісної оцінки структурної прогресії при аксСпА, але не рекомендується для діагностичної оцінки [14].
Магнітно-резонансна томографія
МРТ-оцінка ККС дозволила удосконалити діагностичну оцінку пацієнтів з аксСпА завдяки її унікальній здатності безпосередньо візуалізувати запальні ураження в сакроїліальних зчленуваннях, а також наслідки запалення, наприклад структурні ушкодження. Саме цей метод візуалізації дозволяє верифікувати діагноз на більш ранній стадії, ніж рентгенографія і КТ. Z.І. Ez-Zaitouni та співавт. (2018) провели аналіз 513 пацієнтів з підозрою на аксСпА і тривалістю симптомів ≤ 2 роки та встановили, що оцінка за допомогою МРТ змінила діагноз експерта-клініциста у 21 % пацієнтів [15].
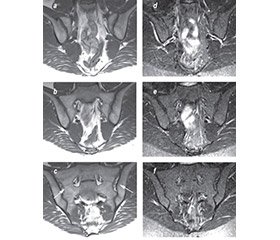
Рекомендації підкомітету ESSR щодо відповідних протоколів МРТ-сканування кісток таза для діагностики аксСпА охоплюють одночасну оцінку послідовностей T1-зваженого режиму (T1W) і режимів із пригніченням сигналу від жирової тканини: STIR-режим (інверсія-відновлення з коротким часом релаксації) і T2-FS-зважений режим із внутрішньовенним уведенням гадолінію або без такого (T1 w/wo FS post Gd) [9] (табл. 1; рис. 1). Губчаста речовина хребців, крижів і клубових кісток у нормі в дорослих містить жировий (жовтий) кістковий мозок, який може «перекривати» прояви запального набряку високим МР-сигналом, через що і необхідна технологія пригнічення МР-сигналу від жирової тканини кісткового мозку. Найкраще запальні зміни можна побачити у STIR-режимі, цей білий запальний сигнал контрастує з темним забарвленням кортикальної кістки і забезпечує добрий анатомічний поділ крижового і клубового кортикальних шарів ККС. T1W-режим на даний час є основним для виявлення кісткових ерозій за МРТ.
Рекомендації EULAR [8] і ESSR [9] підкреслюють найважливішу концепцію одночасної і контекстної інтерпретації МРТ-результатів у T1W- і STIR-режимах, оскільки ці два типи сканування доповнюють один одного та надають додаткову інформацію. Наприклад, виявлення незначного набряку кісткового мозку (НКМ) за допомогою сканування в STIR-режимі може виявитися недостатнім для впевненого встановлення діагнозу аксСпА. Проте виявлення ерозії за допомогою T1W-сканування може підвищити вірогідність діагнозу, особливо за умов високого індексу клінічних підозр у HLA-B27-позитивних пацієнтів. Дослідження, в яких використовувався цей підхід, подемонстрували набагато більш високу діагностичну значущість МРТ при аксСпА (на що вказують відношення правдоподібності результатів дослідження — 44,6 і 26,0 для анкілозивного спондиліту і нерентгенографічного аксСпА відповідно) [17], порівняно з ігноруванням цієї методики (відношення правдоподібності результатів — 9,0) [18]. Утім оцінка діагностичної значущості МРТ є досить складним і суб’єктивним завданням, оскільки інтерпретація результатів залежить від досвіду лікаря-діагноста.
Питання щодо цінності та діагностичної корисності досліджень із контрастуванням залишається дискутабельним. У рекомендаціях ESSR йдеться, що цей підхід може бути корисний у разі сумнівного діагнозу, особливо в дітей; водночас у рекомендаціях EULAR вказується, що досліджень у STIR-режимі достатньо для виявлення запалення, відтак у контрастуванні немає необхідності [2, 8]. Синовіт може бути виявлений тільки з використанням жиропригнічуючих режимів після введення контрастної речовини, але синовіт рідко виникає за відсутності НКМ, і ці режими, як повідомляється, не додають діагностичної цінності порівняно з ізольованим використанням STIR-режиму [19].
Для підвищення діагностичної цінності та полегшення порівнянь між дослідженнями був розроблений стандартизований метод оцінки уражень за даними МРТ. Використовуються принципи Канадського дослідницького консорціуму зі спондилоартриту (SPondyloArthritis Research Consortium of Canada, SPARCC): поділ ККС на квадранти й оцінка послідовних напівкорональних зрізів через хрящову частину суглоба [20]. Крім того, робоча група з оцінки МРТ Міжнародного товариства з оцінки спондилоартриту (Assessment of SpondyloArthritis international Society, ASAS) недавно оновила рекомендації міжнародного консенсусу зі стандартизованого визначення ушкоджень на МРТ як для активних, так і для структурних уражень у ККС у пацієнтів із СпА. Цей перегляд повинен сприяти подальшій оцінці інформативності та необхідності МРТ у діагностиці, класифікації та прогнозі аксіальних уражень при СпА [21].
Набряк кісткового мозку
Набряк кісткового мозку у субхондральній ділянці хрящового відділу ККС є найбільш раннім і найчастішим ураженням, виявленим при МРТ-скануванні в режимі з пригніченням жиру в пацієнтів з аксСпА при встановленні діагнозу. Дослідження когорт пацієнтів із раннім аксСпА вказали на частоту НКМ у межах від 15 до 60 % [4, 6, 17], варіабельність якої може бути пояснена різними критеріями включення до когорт. У цих дослідженнях наявність НКМ встановлювалася відповідно до консенсусних визначень груп ASAS/OMERACT [22]. Ця МРТ-ознака була розроблена ASAS як частина візуалізаційних класифікаційних критеріїв сакроілеїту за даними МРТ.
НКМ як дефініція аксСпА, за даними ASAS, вимагає наявності не менше двох субхондральних вогнищ набряку на одному напівкорональному зрізі або одного вогнища ураження, виявленого на двох послідовних зрізах [22]. Наявність НКМ можна легко оцінити відповідно до методу SPARCC, для якого оцінка 2 або більше вказує на наявність щонайменше двох квадрантів ККС із НКМ. Дослідження пацієнтів із невеликою тривалістю симптомів (< 3 років) показали, що цей критерій має більшу надійність, ніж модифіковані Нью-Йоркські критерії, для виявлення рентгенографічного сакроілеїту [23, 24].
Існує зростаюча стурбованість щодо нераціонального використання МРТ без показань, що може призвести до хибнопозитивного діагнозу у 40 % пацієнтів з неверифікованим болем у спині [25]. Для належної оцінки діагностичної необхідності МРТ на додаток до клінічних, рентгенографічних і лабораторних даних важливо ретельно оцінювати МРТ при станах, які клінічно імітують спондилоартрит, і використовувати діагностичні критерії, що не включають оцінку МРТ, як золотий стандарт. Наявність НКМ за даними МРТ, відповідного критерію МРТ-ASAS, може зміщувати рішення на користь позитивного діагнозу. Проте найчастіше досить важко встановити діагноз аксСпА, не включаючи оцінку МРТ, особливо на ранніх стадіях, із недостатньою кількістю неінструментальних критеріїв. Так, серед 250 пацієнтів із діагнозом аксСпА в когорті SPACE у 40 % було дві або менше клініко-лабораторних ознаки СпА [6].
Проведено два високодоказових дослідження інформативності МРТ. У першому дослідженні в ревматологів не було можливості оцінити зміни ККС за даними МРТ при встановленні остаточного діагнозу [17, 26]. Діагностика ґрунтувалася на оцінці фахівцем клінічних та лабораторних особливостей водночас із рентгенографією кісток таза. При подальшому аналізі набряк кісткового мозку, що відповідав критерію МРТ-ASAS, був виявлений у 85,3 % пацієнтів із діагностованим без МРТ анкілозивним спондилітом, у 66,7 % пацієнтів із запальними болями у спині, але без рентгенографічного сакроілеїту, у 23,1 % пацієнтів із неспецифічним болем у спині й у 6,8 % здорових людей без болю в спині [17].
У другому дослідженні аналогічний дизайн був використаний для порівняння двох когорт пацієнтів віком понад 50 років із недіагностованим болем у спині. Когорта A включала 69 пацієнтів із підозрою на аксСпА і 20 людей відповідного віку в групі порівняння; когорта B об’єднала 88 пацієнтів із гострим переднім увеїтом і болями у спині в минулому або в даний час [26]. Пацієнтам були встановлені діагнози: нерентгенографічний аксСпА, анкілозуючий спондиліт або неспецифічний біль у спині. МРТ-ASAS-критерій НКМ був наявний у 82,5 і 70,8 % пацієнтів з анкілозуючим спондилітом, у 80,0 і 41,9 % пацієнтів з нерентгенографічним
аксСпА і у 23,1 і 26,5 % пацієнтів з неспецифічним болем у спині в групах А і В відповідно. Це дослідження продемонструвало, що наявність НКМ принаймні в трьох квадрантах ККС (а не в двох) мало більш високу специфічність (89 і 84 % для когорт A і В відповідно), що значно поліпшило діагностичну цінність цього критерію, ніж традиційний критерій МРТ-ASAS.
Ще в одному підході для оцінки цінності МРТ як золотого стандарту діагностики використовувалася гістологічна оцінка тканини при біопсії ККС. У дослідженні взяли участь 109 пацієнтів із клінічно пі-дозрюваним аксСпА і тривалістю симптомів 4 роки, але без рентгенографічних ознак захворювання [27]. МРТ було проведено у 77 пацієнтів, чутливість і специфічність критеріїв МРТ-ASAS становили 38 і 100 % відповідно.
Хибнопозитивні результати при діагностиці набряку кісткового мозку
НКМ, який відповідає критеріям MRТ-ASAS, виявляється у 20–40 % пацієнтів із неспецифічними болями у спині, а також у здорових людей. Дослідження, проведені для оцінки хибнопозитивних результатів НКМ у різних популяціях пацієнтів без аксСпА, привели до деяких важливих висновків щодо діагностичної цінності цього критерію (рис. 2).
/118-1.jpg)
МРТ-детермінований набряк кісткового мозку в діагностиці аксСпА
Фактори, на які слід зважати при інтерпретації набряку кісткового мозку на МРТ крижово-клубових суглобів, що підтверджують діагноз аксіального спондилоартриту:
1. Набряк кісткового мозку в крижово-клубових суглобах слід інтерпретувати в контексті клінічної картини.
2. Верифікація змін, що відповідають набряку кісткового мозку, який характерний для аксСпА, може бути складною навіть для досвідчених фахівців.
3. Слід проявляти обережність при інтерпретації вогнищевих уражень кісткового мозку в крижах і задньонижніх відділах клубової кістки (рис. 2).
4. Набряк кісткового мозку, що відповідає критерію МРТ-ASAS, не повинен ізольовано використовуватися з діагностичною метою через ризик хибнопозитивної діагностики аксСпА (зустрічається в 25–40 % фізично активних молодих людей) [17, 25, 28, 29].
5. Кількісні визначення, засновані на Консорціумі досліджень спондилоартриту Канади (SPARCC): метод квадранта крижово-клубового суглоба і великий набряк кісткового мозку (принаймні, три квадранти крижово-клубового суглоба та/або глибина > 1 см) повинні бути далі валідовані.
6. Контекстуальна інтерпретація набряку кісткового мозку зі структурними ураженнями має вирішальне значення, оскільки їх наявність збільшує специфічність для діагностики аксСпА.
У дослідженні 1020 датських пацієнтів із хронічним болем у спині у 21 % був виявлений НКМ відповідно до критеріїв МРТ-ASAS, але він не був асоційований з ознаками запального болю у спині [30]. Дослідники припустили, що механічний стрес, обумовлений інтенсивним фізичним навантаженням, може бути асоційований із НКМ у ККС. НКМ, який відповідає критеріям MРТ-ASAS, спостерігався у 35 % бігунів-аматорів до бігового тренування і у 30 % після тренування, а також у 41 % професійних хокеїстів [25]. Ці висновки можна порівняти з дослідженням, проведеним у бельгійських військових новобранців, у яких відсоток виявлення НКМ, який задовольняв критерію МРТ-ASAS, також збільшився з 23 до 36 % після 6-тижневого періоду інтенсивного навчання [29].
У дослідженні SPACE при порівнянні 47 здорових людей без болю в спині та 47 пацієнтів з аксСпА у 23,4 % був виявлений НКМ порівняно з 91,5 % пацієнтів з аксСпА [23, 24]. Хибнопозитивні результати в усіх цих дослідженнях частіше були представлені НКМ у передній і задній частинах нижнього відділу клубової кістки. А виявлення НКМ, який простягався як мінімум на 1 см від краю субхондральної кістки (так зване глибоке ушкодження), було на 100 % специфічним для аксСпА і не виявлено у здорових людей або у пацієнтів із біомеханічними змінами хребта.
У двох ретроспективних дослідженнях НКМ був встановлений майже у половини (48,1 і 46 %) жінок у післяпологовому періоді, що асоціювався зі склерозом і, головним чином, розташовувався в хрящовій частині нижнього відділу ККС [31, 32]. На додаток до НКМ у деяких жінок також виявлявся капсуліт, ентезит і синовіт цих суглобів. Автори висновували, що ці процеси розвивалися в другому і третьому триместрах вагітності і, ймовірно, були обумовлені біомеханічним стресом на ділянку нижньої половини ККС. Усі ці зміни поступово регресували під час спостереження, хоча 10 % жінок із дифузним НКМ були схильні до прогресування аж до аксСпА, на відміну від жінок з вогнищевим ураженням. Такий тип НКМ і відсутність жирової метаплазії або ерозій так само відрізняють НКМ внаслідок конденсуючого ілеїту від аксСпА.
Жирова метаплазія
Жирова метаплазія виявляється при скануванні в T1W-режимі як яскравий білий сигнал у субхондральному кістковому мозку. Це ушкодження з’являється як еволюція НКМ і, зазвичай, розташовується поряд із субхондральною кісткою, з чіткою межею й однорідним білим сигналом по всій зоні ушкодження [21] (рис. 3a). Ця характерна ознака є високоспецифічною для аксСпА на відміну від гетерогенного розподілу білого сигналу, характерного для фізіологічної інфільтрації жиру в крижах [33]. Жирова метаплазія часто спостерігається разом з іншими структурними ушкодженнями в ККС при аксСпА [33].
Перша систематизована оцінка діагностичної цінності жирової метаплазії в діагностиці СпА була сфокусована тільки на наявності яскравого сигналу в T1W-режимі, а не на додаткових ознаках жирової метаплазії, таких як наявність вираженого кордону [17]. Наявність жирової метаплазії принаймні у двох секторах ККС була виявлена у 37 % пацієнтів із запальним болем у спині, але без рентгенографічного сакроілеїту, у 15,3 % здорових людей і 19,2 % пацієнтів із неспецифічним болем у спині [17]. У другому дослідженні й іншій когорті пацієнтів дослідники оцінили діагностичну цінність жирової метаплазії в поєднанні з іншими МРТ-ознаками для діагностики аксСпА [33]. Жирову метаплазію і наявність як мінімум двох різних ознак аксСпА було встановлено у 25 % пацієнтів із нерентгенографічним аксСпА, у 2,6 % пацієнтів із неспецифічним болем у спині та в жодного здорового суб’єкта. Аналогічним чином, в когорті SPACE у 23,5 % пацієнтів із діагнозом нерентгенографічного аксСпА відповідно до класифікаційних критеріїв ASAS і у 6,9 % пацієнтів без аксСпА спостерігалася жирова метаплазія при-
наймні в двох квадрантах ККС [34]. Крім того на відміну від НКМ тільки 10 % спортсменів мали жирову метаплазію в більше ніж двох секторах ККС [25]. Ці дані вказують на те, що жирова метаплазія має дискримінаційний потенціал і є ознакою, яка може бути корисною при контекстній інтерпретації МРТ-сканування для діагностичних цілей.
Кісткові ерозії
При скануванні в T1W-режимі ерозії кісткової тканини визначаються як повна втрата темного кортикального шару кісткової тканини, а також матриці сусіднього кісткового мозку [21] (рис. 3b). Ерозії виявляються як поодинокі або множинні кісткові дефекти суглобових поверхонь ККС. Велика ерозія визначається у вигляді локального розширення суглобової щілини. Ерозії мають гіпоінтенсивний МР-сигнал в Т1- і в STIR-режимах та часто поєднуються з субхондральним остеосклерозом і жировою метаплазією кісткового мозку. При активно запаленій ерозії яскравий сигнал також буде присутній у суглобовому просторі в режимі з пригніченням жиру, вказуючи на наявність запальної суглобової рідини.
МРТ, так само як і низькодозова КТ, була валідована щодо візуалізації кісткових ерозій ККС. МРТ має більш високу чутливість і специфічність щодо цього ураження, ніж рентгенографія (79 проти 42 % і 93 проти 86 % відповідно) [7]. Частота ерозії кістки, виявленої за допомогою МРТ, у пацієнтів із недіагностованим болем у спині та підозрюваним діагнозом раннього аксСпА значно варіює серед різних когорт пацієнтів. Ерозії були виявлені як мінімум у двох квадрантах ККС у 59,3 % пацієнтів із запальним болем у спині, але без рентгенографічного сакроілеїту (із середньою тривалістю симптомів 29 місяців), і тільки у 3,4 % здорових людей і 7,7 % пацієнтів із неспецифічним болем у спині [17].
У датському дослідженні 1020 молодих пацієнтів із постійними болями у спині тривалістю 2–12 місяців 8 % пацієнтів мали ерозії кісткової тканини, наявність яких позитивно корелювала із серопозитивністю за HLA-B27 і доброю відповіддю на нестероїдні протизапальні препарати (НПЗП) і негативно — з віком [30]. Крім того, ерозії ККС були виявлені у ~10 % пацієнтів із нерентгенографічним аксСпА за відсутності НКМ [17, 26, 35]. Ці дані свідчать про те, що оцінка ерозій в поєднанні з НКМ може потенційно поліпшити діагностичну цінність МРТ.
Проспективні спостереження подемонстрували, що морфологія ерозій змінюється у міру зворотного розвитку запалення згідно з T1W-скануванням ККС [36]. Зокрема, яскравий сигнал при скануванні у STIR-режимі зникає і з’являється посилений сигнал в суглобовому просторі на місці ерозивної порожнини при скануванні в T1W-режимі (рис. 3c і 4). Вважається, що ці зміни відображають репаративний процес в місці ерозії, що нагадує трансформацію НКМ у жирову метаплазію в субхондральній кістковій тканині. Цей репаративний процес відновлення ушкодження в місці ерозії був названий зворотним засипанням для позначення заповнення ерозивної порожнини новою тканиною, хоча також був недавно запропонований інший термін — «жирова метаплазія в ерозивній порожнині» [21]. Дані плацебо-контрольованого рандомізованого дослідження показують, що цей процес відбувається вже через 12 тижнів після початку лікування інгібітором фактора некрозу пухлин [37].
У ретроспективному аналізі 363 пацієнтів, включаючи пацієнтів з аксСпА (згідно з класифікаційними критеріями ASAS), чутливість і специфічність інтенсивного сигналу в суглобовому просторі в T1W-режимі для діагностики аксСпА становили 38,4 і 95,8 % відповідно [38]. Варіабельність форм ерозій, а також особливості візуалізації кортикального шару кістки (кортикальна кістка темна на всіх послідовностях, а нерівномірність контурів кортикальної кістки ККС також характерна для здорових осіб внаслідок зв’язкового апарату суглобів) можуть пояснювати нижчу діагностичну цінність ерозій (порівняно з НКМ) у діагностиці аксСпА. Для надійного виявлення й оцінки ерозивного ураження ККС потрібний значно більший досвід лікаря, який інтерпретує дані МРТ. Так само необхідно чітко диференціювати при оцінці МРТ ерозії і їх оборотний розвиток, оскільки ці ушкодження пов’язані з різними стадіями запалення.
Остеосклероз
Склероз кісткової тканини при аксСпА найкраще виявляється за допомогою рентгенографічних методів дослідження, особливо КТ. На МРТ ККС остеосклероз проявляється як сигнал низької інтенсивності при дослідженні в усіх режимах. Ця особливість є найменш специфічним структурним ушкодженням для аксСпА, що виявляються за допомогою МРТ [34]. Утім одне дослідження продемонструвало, що склероз, який виявляється на звичайній КТ, розташований уздовж хрящового простору, що становить > 5 мм у всіх трьох площинах і поширюється на більше ніж 5 мм від поверхні суглоба, може мати таку ж специфічність, як і ерозії й анкілоз, для діагностики аксСпА [39].
МРТ хребта
Рекомендованим підходом для візуалізації хребта у пацієнтів з аксСпА є МРТ-сканування в T1- і STIR-режимах у сагітальній площині [9]. При МРТ-скануванні хребта з пригніченням жиру можна виявити такі особливості аксСпА, як запальні ураження кісткового мозку в ділянці кутів тіл хребців, що примикають до кінцевих пластин, у реберно-хребетних і фасеткових суглобах, а також в остистих відростках, у м’яких тканинах і ентезисах [40]. У T1W-режимі виявляють жирову метаплазію кісткового мозку в тих самих місцях.
У кількох дослідженнях вивчалася діагностична цінність МРТ хребта, але не були розглянуті ключові клінічні питання щодо того, чи додає візуалізація даної локалізації діагностичну цінність до інформації, отриманої при візуалізації тільки ККС. Для відповіді на це питання у швейцарсько-канадському дослідженні двох когорт (когорти A і B, в які увійшли 130 пацієнтів із недіагностованим болем у спині та попереднім діагнозом аксСпА та 20 здорових осіб) проводилась незалежна оцінка МРТ ККС і хребта з інтервалом 6 місяців [41]. Через 1–12 місяців провели одночасну оцінку даних МРТ ККС і хребта (комбінована МРТ): 15,8 і 24,2 % пацієнтів у когортах A і B відповідно, в яких на МРТ ККС зміни не були виявлені, після глобальної оцінки комбінованих сканів МРТ були класифіковані як такі, що мають аксСпА. Проте у пацієнтів із неспецифічним болем у спині, 26,8 і 11,4 % в когортах A і B відповідно, і у 17,5 % здорових добровольців після проведення комбінованого МРТ-аналізу був помилково діагностований аксСпА. Автори дійшли висновку, що МРТ хребта має невелику додаткову цінність для діагностичної оцінки пацієнтів з аксСпА [41].
Робоча група ASAS/OMERACT надала узгоджене визначення результатів МРТ хребта, які вказують на аксСпА [40]. Це запалення в трьох або більше передніх і/або задніх кутах тіл хребців принаймні на двох послідовних сагітальних зрізах. Однак два наступних дослідження, в яких оцінювали МРТ-сканування хребта, швейцарсько-канадське дослідження [42] 130 пацієнтів із недіагностованим болем у спині віком < 50 років і 284 пацієнти з когорти SPACE [34], показали, що це визначення ASAS/OMERACT не має діагностичної значущості. В обох дослідженнях наявність запалення щонайменше в п’яти тілах хребців мало специфічність ~95 і 90 % і чутливість 15–30 і 14 % (у швейцарсько-канадському дослідженні та когортному дослідженні SPACE відповідно).
У когортних дослідженнях SPACE і DESIR оцінювали частоту наявності п’яти вогнищ ураження в кутах тіл хребців у вигляді жирової метаплазії у 541 і 650 пацієнтів відповідно з хронічним болем у спині. Жирова метаплазія була виявлена тільки у 1 і 2 % пацієнтів відповідно [43]. Ці дані вказують, що візуалізація хребта не має достатньої діагностичної цінності, щоб виправдати її рутинне використання для діагностичної оцінки пацієнта з підозрою на аксСпА без змін на зображеннях ККС [44].
Запалення в реберно-хребетних суглобах, навпаки, мають високу специфічність (> 90 %) для діагностики аксСпА, але низьку чутливість (< 20 %) [45]. Візуалізація хребта може бути виправдана, якщо індекс клінічної підозри є високим, необхідно прийняти важливе рішення щодо лікування й є аномалії при візуалізації ККС, які недостатньо властиві аксСпА. Було висловлено припущення, що локальний біль у хребті може бути асоційованим із місцем локалізації уражень СпА на МРТ. Отже, саме сегментарна МРТ хребта може бути корисною при оцінці пацієнтів з вогнищевим болем у хребті. Одне дослідження з когорти DESIR продемонструвало, що ураження грудного відділу хребта частіше зустрічаються у пацієнтів із міжлопатковим болем, ніж у пацієнтів без такого [46]. Однак в когорті SPACE біль у хребті був асоційований саме з дегенеративними ураженнями хребта, а не зі змінами, що вказують на аксСпА [47].
Класифікація
Діагностично значущі рентгенографічні ознаки сакроілеїту з’являються через декілька років від початку хвороби. Класифікаційні критерії ASAS для аксСпА 2009 року були розроблені та спрямовані на більш ранню діагностику аксСпА у пацієнтів із запальним болем у спині шляхом включення ознак сакроілеїту, за даними МРТ, і принаймні однієї клінічної ознаки аксСпА [22].
Визначення вірогідного МРТ-сакроілеїту ASAS/OMERACT–2009. Адаптовано нами за [22]:
1. Для визначення сакроілеїту необхідна наявність запальних змін ККС при МРТ.
2. НКМ/остеїт повинні чітко візуалізуватися і розташовуватися в типових анатомічних ділянках (субхондрально або періартикулярно).
3. Ізольованої наявності інших запальних змін (синовіт, ентезит, капсуліт без НКМ/остеїту) недостатньо для визначення вірогідного МРТ-сакроілеїту.
4. Структурні зміни (жирова інфільтрація, склероз, ерозії і кістковий анкілоз) відображають результат запалення. Наявності тільки структурних змін без НКМ недостатньо для встановлення МРТ-діагнозу сакроілеїту.
5. Якщо є тільки один запальний сигнал/запальне вогнище НКМ на зрізі, то вони повинні визначатися як мінімум на двох послідовних зрізах. Якщо виявляється більше двох сигналів на одному зрізі, то одного зрізу достатньо для верифікації сакроілеїту.
При тестуванні візуалізаційних критеріїв ASAS чутливість МРТ-діагностики становила 66 %, а специфічність — 97 % [48]. Подальше дослідження класифікаційних критеріїв ASAS, яке оцінювало пацієнтів через 4,4 року від маніфестації захворювання, показало, що візуалізаційні критерії мали високу позитивну прогностичну вірогідність, підтверджуючи, що цей критерій не призводить до хибнопозитивної помилкової діагностики [49]. Як альтернативу візуалізаційним критеріям ASAS 2009 року також запропонувало клінічні ознаки для діагностики СпА (наявність HLA-B27 і дві клінічні ознаки СпА) [23].
Незважаючи на доказові дані надійності цього критерію візуалізації, є побоювання, що виявлення локального набряку кісткового мозку на одному зрізі, що відповідає критерію ASAS МРТ, може надмірно вплинути на думку ревматолога та схилити його на користь аксСпА. Аналіз, проведений у когорті SPACE, продемонстрував 48 % хибнопозитивних результатів за даними МРТ-вірогідного сакроілеїту і 60 % для рентгенографічного сакроілеїту, за даними менш досвідчених діагностів, що призвело до зміни діагнозу у 10 % пацієнтів [50].
Відомо, що критерій візуалізації, заснований винятково на НКМ, може вірогідно визначати аксСпА у молодих пацієнтів із короткою тривалістю симптомів, але класифікаційні критерії аксСпА повинні мати високу специфічність в широкому діапазоні вікових характеристик пацієнтів. Частота виявлення хибнопозитивного НКМ збільшується з віком через розвиток остеоартриту ККС, що викликає потенційну стурбованість низькою специфічністю цього критерію у популяції пацієнтів середнього і похилого віку [30].
У когортах DESIR і SPACE також проводилося порівняння діагностичної значущості рентгенологічного сакроілеїту і структурних уражень за даними МРТ [51, 52]. Наявність структурних уражень було задокументовано з використанням методу SPARCC, згідно з яким ураження вважалося діагностично значущим при виявленні не менше як у двох квадрантах ККС і в двох послідовних зрізах. До структурних МРТ-критеріїв було віднесено наявність будь-якої з таких ознак: три або більше ерозій, три або більше ділянок жирових дегенерацій, що передбачає наявність структурних уражень щонайменше в шести квадрантах ККС. Цей структурний критерій МРТ був обраний на підставі його низької поширеності (< 5 %) у пацієнтів без СпА [34]. При цьому ступені структурного ушкодження більшість пацієнтів мали значний НКМ (80–84 % у когорті SPACE) і, отже, відповідали візуалізаційним критеріям аксСпА ASAS 2009 року. При використанні цього критерію замість рентгенографічних діагноз аксСпА був вірогідним у 80 % пацієнтів у когорті DESIR і 97,3 % пацієнтів у когорті SPACE.
Слід зазначити, що дослідження когорт пацієнтів з аксСпА і коротким анамнезом показали, що наявність ерозій і метаплазії жиру всього в двох квадрантах ККС має низьку діагностичну значущість [17, 26]. Отже, залишається можливим, що включення структурних уражень ККС за даними МРТ замість рентгенографії в класифікаційні критерії може вплинути на чутливість і/або специфічність критеріїв ASAS 2009 року. Це вимагає вивчення цього явища у пацієнтів із більшою тривалістю симптомів, ніж у когортах SPACE і DESIR.
Менеджмент і візуалізаційні методи дослідження
З’являються дані, які підтверджують роль візуалізації в менеджменті аксСпА як прогностичного інструмента для прогнозування розвитку і прогресування анкілозу хребта — основної причини інвалідності при аксСпА. Важливість раннього виявлення аксСпА підкреслюється зростаючою кількістю доказів того, що лікування інгібітором фактора некрозу пухлини (іФНП) може запобігти утворенню нової кісткової тканини і подальшій інвалідизації пацієнтів [10, 53]. Крім того, візуалізація відіграє певну роль у виборі лікування в пацієнтів з нерентгенографічним аксСпА.
Менеджмент аксСпА: як візуалізація може допомогти лікарю
Рентгенографія
Рентгенограма хребта з ознаками утворення нової кісткової тканини постає прогнознегативним чинником ризику структурного прогресування [54] і, отже, може схилити чашу терезів убік більш інтенсивної терапії, особливо з урахуванням появи даних, які свідчать про те, що застосування іФНП може сприяти оборотному розвитку і призупиненню структурної прогресії [53].
Магнітно-резонансна томографія
— Виявлення запалення в крижово-клубових суглобах за допомогою МРТ корисно при відборі пацієнтів із нерентгенографічним аксСпА для лікування іФНП, тоді як відсутність запалення при МРТ і за умов нормальної концентрації С-реактивного білка в сироватці пророкує невдачу лікування.
— Подальші МРТ-дослідження можуть бути корисними в умовах, коли у пацієнта формується вторинна резистентність до біологічної терапії, при якій розглядається можливість переходу на альтернативний агент. Поява запальних уражень сприятиме застосуванню альтернативної терапії, особливо для лікарського засобу з іншим механізмом дії. І навпаки, відсутність запалення при подальшій МРТ може привести до іншої стратегії, орієнтованої на фізичні вправи і втрату маси тіла.
— МРТ-запалення та жирова метаплазія в крижово-клубових суглобах і жирова метаплазія в хребті можуть передбачати утворення нової кістки в хребті. Ці ознаки слід мати на увазі при прийнятті рішення щодо інтенсифікації лікування біологічними агентами, особливо у молодих пацієнтів з активними симптомами, незважаючи на прийом НПЗП.
Рентгенографія
Після встановлення діагнозу аксСпА подальше спостереження за станом ККС за допомогою рентгенографії не прийнятно в звичайній практиці через її обмежену чутливість щодо виявлення змін. Рентгенографія хребта так само відіграє обмежену роль. У проспективних дослідженнях доведено, що формування нової кісткової тканини в хребті було більш імовірним у пацієнтів, у яких вже були синдесмофіти або анкілози на рентгенограмі хребта, ніж у пацієнтів без цих симптомів [54]. У пацієнтів із раннім аксСпА в когорті DESIR рентгенографічне прогресування в хребті через 5 років було виявлено у 42 % пацієнтів, у яких були синдесмофіти на початку дослідження, і у 17 % пацієнтів, у яких був рентгенографічний сакроілеїт [55]. Отже, тільки така ознака, як утворення нової кісткової тканини в хребті на рентгенографії, може бути інформативною для оцінки прогностичного ризику пацієнта і, отже, вибору іФНП на ранніх стадіях захворювання у пацієнтів, в яких НПЗП неефек-
тивні.
МРТ
МРТ відіграє важливу роль у виборі тактики лікування, особливо це стосується застосування іФНП. У декількох плацебо-контрольованих дослідженнях іФНП у пацієнтів з нерентгенографічним аксСпА відповідно до критеріїв МРТ-ASAS з виявленням НКМ продемонстрована добра клінічна відповідь на лікування цими біологічними агентами [56, 57]. Крім того, в одному з досліджень більш високі показники відповіді на лікування асоціювалися з більш високим ступенем запалення в ККС, за даними МРТ [57]. Цей факт був підтверджений і у проспективній когорті DESIR, де критерій МРТ-ASAS НКМ був єдиним незалежним чинником, прогнозуючим клінічну відповідь на терапію іФНП [58]. У всіх цих клінічних випробуваннях не відзначено переваги терапії іФНП над плацебо у пацієнтів, які не відповідали критерію МРТ-ASAS щодо НКМ і які мали нормальні концентрації сироваткового С-реактивного білка (СРБ).
Ревматологи часто стикаються з менеджментом пацієнтів із запальним болем у спині, які мають нормальні концентрації СРБ в сироватці, нормальні або сумнівні дані рентгенографії і/або МРТ ККС і не відповідають на лікування НПЗП. Все це викликає велике бажання у фахівця почати терапію іФНП, але, як показують сучасні дані, цей підхід не послабить симптоми пацієнта. Отже, оцінка НКМ за допомогою МРТ допомагає відібрати пацієнтів з нерентгенографічним аксСпА, які дадуть відповідь на лікування іФНП, водночас відсутність НКМ на МРТ і нормальні концентрації СРБ в сироватці крові свідчать про недостатню реакцію на можливе лікування іФНП в майбутньому.
На сьогодні дуже мало досліджень, що стосуються вивчення того, як скоро можуть з’являтися нові зони уражень на МРТ при подальшому спостереженні. Один аналіз пацієнтів із нерентгенографічним аксСпА в 12-тижневому плацебо-контрольованому дослідженні адалімумабу показав, що у 30 % пацієнтів відзначався перехід від МРТ-негативних (тобто без НКМ) до МРТ-позитивних ознак, і 25 % пацієнтів перейшли від нормальних до підвищених концентрацій СРБ в сироватці через 12 тижнів [59]. Однак у цих пацієнтів було клінічно активне захворювання, і не було надано жодної інформації щодо структурних уражень на МРТ ККС і їх відповіді на лікування адалімумабом через 12 тижнів.
Аналіз пацієнтів когорти SPACE продемонстрував, що швидкість переходу від негативних до позитивних результатів на МРТ була низькою (< 7 %) протягом 3 місяців і 1 року [29]. Зміни даних МРТ-сканування під час спостереження були більш імовірними у HLA-B27-позитивних пацієнтів (11 %) і у чоловіків (12 %) [29]. У додатковому дослідженні, в якому були проведені контрольні огляди у 29 пацієнтів із запальним болем у спині через 4, 8 і 12 тижнів, тільки у чотирьох МРТ-негативних пацієнтів з’явилися характерні для аксСпА зміни на МРТ. Усі четверо пацієнтів були HLA-B27-позитивні, троє з них — чоловіками [60].
З огляду на отримані результати вважається обґрунтованою стратегія моніторингу пацієнтів із клінічно активним захворюванням, але у яких відсутній певний рентгенографічний сакроілеїт або активне запалення, типове для аксСпА за даними МРТ. Проведення наступного МРТ можна буде розглянути через 3–6 місяців у HLA-B27-позитивних пацієнтів із стійким активним захворюванням, яке не піддається лікуванню НПЗП. Оскільки ці дослідження не оцінювали структурні ураження на МРТ, залишається неясним, чи буде лікування іФНП викликати відповідь у пацієнтів тільки зі структурними ураженнями на МРТ. Окреме питання полягає в тому, чи відіграє МРТ роль в оцінці пацієнтів після лікування, які отримують активну терапію біологічним агентом.
МРТ в динаміці так само може бути корисним для виявлення відсутності реакції на біологічну терапію в пацієнтів, у яких розглядається питання про перехід на альтернативний препарат. Повторна поява запальних уражень доведе рішення про необхідність початку альтернативної терапії агентом з механізмом дії, відмінним від даного. І навпаки, відсутність запалення при подальшій МРТ може допомогти прийняти рішення про скасування іФНП і перехід до стратегії, орієнтованої на фізичні вправи.
На сьогодні рекомендацій щодо проведення МРТ в динаміці, незалежно від клінічної відповіді, не існує. Водночас цей підхід вимагає чітких доказів того, що персистуюче запалення на МРТ є прогностичним фактором прогресування рентгенографічних змін, таких як утворення нової кісткової тканини в хребті. За даними декількох проспективних когортних досліджень пацієнтів з нерентгенографічним аксСпА, запалення в ККС на МРТ є предиктором переходу від нерентгенографічного до рентгенографічного сакроілеїту відповідно до модифікованих Нью-Йоркських критеріїв [29, 61]. Більше того, у когорті DESIR під час 5-річного спостереження запалення на МРТ відповідно до критеріїв МРТ-ASAS було єдиним предиктором рентгенографічного прогресування аксСпА як у HLA-B27-позитивних, так і у HLA-B27-негативних пацієнтів, а ризик розвитку прогресування змін збільшився з 5,7 до 17,7 % при виявленні запалення за даними МРТ [4].
При проведенні комбінованого аналізу пацієнтів класифікаційної когорти ASAS і когорти DESIR було акцентовано, що запалення в ККС при МРТ, виявлене в повсякденній рутинній практиці, було пов’язано з 3–7-разовим рентгенологічним прогресуванням в ККС в обох когортах (після 4,6 і 5,1 року спостереження відповідно), незалежно від вихідних факторів, таких як концентрація СРБ в сироватці, HLA-B27-позитивність і стать [62]. Подальший аналіз когорти DESIR показав, що у більшої кількості пацієнтів, які відповідали інструментальним критеріям аксСпА, згідно з ASAS, через 5 років з’явилися нові синдесмофіти в хребті порівняно з пацієнтами, які відповідали клінічним критеріям ASAS [55]. Ця прогресія була найбільшою у пацієнтів, в яких було виявлено запалення на МРТ і рентгенографічний сакроілеїт. Цікаво, що високі концентрації СРБ не впливали на прогресування у пацієнтів з клінічними критеріями аксСпА. Залишається нез’ясованим, чи є тяжкість запалення хребта при МРТ предиктором утворення нової кістки.
У декількох проспективних дослідженнях був вивчений зв’язок між запаленням у кутах тіл хребців і подальшим утворенням нової кістки, виявленим при рентгенографії [63, 64]. Дані цих досліджень свідчать про те, що ураження саме кутів тіл хребців має найбільшу негативну прогностичну цінність. У цих місцях запалення трансформується в жирову метаплазію, що з високою ймовірністю пов’язано з утворенням нової кістки. Цей висновок узгоджується з аналізом пре-дикторів анкілозу ККС, оціненого за допомогою МРТ, який продемонстрував, що жирова метаплазія, а не запалення є основним ушкодженням (за даними МРТ), пов’язаним з утворенням нової кістки [36]. Більше того, жирова метаплазія в ККС пророкує утворення нової кістки при рентгенографії хребта [65]. Отже, репаративна відповідь на запалення, а не саме запалення може бути основним фактором, який передбачає процес анкілозування. Такі МРТ-ураження ККС і хребта є вагомими факторами при прийнятті рішення про доцільність інтенсифікації лікування з додаванням біологічного препарату, особливо у молодих пацієнтів з активним захворюванням, незважаючи на прийом НПЗП.
Висновки
Упровадження МРТ ККС являє собою важливий крок уперед порівняно зі звичайною рентгенографією для діагностики аксСпА. Низькодозована КТ ККС також перевершує звичайну рентгенографію і може використовуватися в діагностичних цілях, коли доступ до МРТ обмежений. НКС у ККС є найпоширенішим ураженням на МРТ у пацієнтів з раннім аксСпА, але не має високої специфічності у молодих людей, які фізично активні. На відміну від цього ерозія і жирова метаплазія постають більш специфічними і можуть потенційно поліпшити діагностичну цінність у широкого кола пацієнтів, які звертаються до ревматолога з недіагностованим болем у спині. Якою мірою структурні МРТ-ураження ККС покращують класифікаційні критерії ASAS, залишається утаємненим, і це питання повинне бути розглянуто у подальших дослідженнях.
Подяки. Висловлюємо глибоку і щиру вдячність діагностичним центрам «Омега» і «М-24» за наданий ілюстративний матеріал.
1. Maksymowyc W.P. The role of imaging in the diagnosis and management of axial spondyloarthritis. Nature Reviews. Rheumatology. 2019. 15(11). 657-672. https://doi.org/10.1038/s41584-019-0309-4.
2. van Mens L.J., van de Sande M.G., Baeten D.L. New treatment paradigms in spondyloarthritis. Curr. Opin. Rheumatol. 2018. 30. 79-86. doi: 10.1097/BOR.0000000000000457.
3. Dougados M., D'Agostino M.A., Benessiano J. et al. The DESIR cohort: a 10-year follow-up of early inflammatory back pain in France: study design and baseline characteristics of the 708 recruited patients. Joint Bone Spine. 2011. 78(6). 598-603. doi: 10.1016/j.jbspin.2011.01.013.
4. Dougados M., Sepriano A., Molto A. et al. Sacroiliac radiographic progression in recent onset axial spondyloarthritis: the 5-year data of the DESIR cohort. Ann. Rheum. Dis. 2017. 76(11). 1823-1828. doi: 10.1136/annrheumdis-2017-211596.
5. van den Berg R., de Hooge M., van Gaalen F., Reijnierse M., Huizinga T., van der Heijde D. Percentage of patients with spondyloarthritis in patients referred because of chronic back pain and performance of classification criteria: experience from the Spondyloarthritis Caught Early (SPACE) cohort. Rheumatology. 2013. 52(8). 1492-1499. doi: 10.1093/rheumatology/ket164.
6. Ez-Zaitouni Z., Bakker P.A.C., van Lunteren M. et al. Presence of multiple spondyloarthritis (SpA) features is important but not sufficient for a diagnosis of axial spondyloarthritis: data from the SPondyloArthritis Caught Early (SPACE) cohort. Ann. Rheum. Dis. 2017. 76(6). 1086-1092. doi: 10.1136/annrheumdis-2016- 210119.
7. Diekhoff T., Hermann K.G., Greese J. et al. Comparison of MRI with radiography for detecting structural lesions of the sacroiliac joint using CT as standard of reference: results from the SIMACT study. Ann. Rheum. Dis. 2017. 76(9). 1502-1508. doi: 10.1136/annrheumdis-2016-210640.
8. Mandl P., Navarro-Compán V., Terslev L. et al. EULAR recommendations for the use of imaging in the diagnosis and management of spondyloarthritis in clinical practice. Ann. Rheum. Dis. 2015. 74(7). 1327-1339. doi: 10.1136/annrheumdis-2014-206971.
9. Sudoł-Szopińska I., Jurik A.G., Eshed I. et al. Recommendations of the ESSR Arthritis Subcommittee for the use of magnetic resonance imaging in musculoskeletal rheumatic diseases. Semin. Musculoskelet. Radiol. 2015. 19(4). 396-411. doi: 10.1055/s-0035-1564696.
10. Park J.W., Kim M.J., Lee J.S. et al. Impact of tumor necrosis factor inhibitor versus nonsteroidal antiinflammatory drug treatment on radiographic progression in early ankylosing spondylitis: its relationship to inflammation control during treatment. Arthritis Rheumatol. 2019. 71(1). 82-90. doi: 10.1002/art.40661.
11. Devauchelle-Pensec V., D'Agostino M.A., Marion J., Lapierre M. Computed tomography scanning facilitates the diagnosis of sacroiliitis in patients with suspected spondylarthritis. Arthritis Rheum. 2012. 64(5). 1412-1419. doi: 10.1002/art.33466.
12. Chahal B.S., Kwan A.L.C., Dhillon S.S. et al. Radiation exposure to the sacroiliac joint from low-dose CT compared with radiography. Am. J. Radiol. 2018. 211(5). 1058-1062. doi: 10.2214/AJR.18.19678.
13. Li S.G., Liu X., Zhou H., Zhang Q. Interrater reliability and radiation dosage of oblique coronal computed tomography. Br. J. Radiol. 2018. 91(1081). 20150700. doi: 10.1259/bjr.20150700.
14. de Koning A., de Bruin F., van den Berg R. et al. Low-dose CT detects more progression of bone formation in comparison to conventional radiography in patients with ankylosing spondylitis: results from the SIAS cohort. Ann. Rheum. Dis. 2018. 77(2). 293-299. doi: 10.1136/annrheumdis-2017-211989.
15. Ez-Zaitouni Z., Robert L., van Lunteren M. et al. Ima-ging of the sacroiliac joints is important for diagnosing early axial spondyloarthritis but not all-decisive. Rheumatology. 2018. 57(7). 1173-1179. https://doi.org/10.1093/rheumatology/key035
16. Greese J., Diekhoff T., Sieper J. et al. Detection of sacroiliitis by short-tau inversion recovery and T2-weighted turbo spin echo sequences: results from the SIMACT Study. J. Rheumatol. 2019. 46(4). 376-383. doi: 10.3899/jrheum.171425.
17. Weber U., Lambert R.G., Østergaard M., Hodler J., Pedersen S.J., Maksymowych W.P. The diagnostic utility of magnetic resonance imaging in spondylarthritis: an international multicenter evaluation of one hundred eightyseven subjects. Arthritis Rheum. 2010. 62(10). 3048-3058. doi: 10.1002/art.27571.
18. Rudwaleit M., van der Heijde D., Khan M., Braun J., Sieper J. How to diagnose axial spondyloarthritis early. Ann. Rheum. Dis. 2004. 63(5). 535-543. doi: 10.1136/ard.2003.011247.
19. de Hooge M., van den Berg R., Navarro-Compán V. et al. Magnetic resonance imaging of the sacroiliac joints in the early detection of spondyloarthritis: no added value of gadolinium compared with short tau inversion recovery sequence. Rheumatology. 2013. 52(7). 1220-1224. doi: 10.1093/rheumatology/ket012.
20. Maksymowych W.P., Wichuk S., Chiowchanwisawakit P., Lambert R.G., Pedersen S.J. Development and preliminary validation of the Spondyloarthritis Research Consortium of Canada magnetic resonance imaging sacroiliac joint structural score. J. Rheumatol. 2015. 42(1). 79-86. doi: 10.3899/jrheum.140519.
21. Maksymowych W.P., Lambert R.G., Østergaard M. et al.
MRI lesions in the sacroiliac joints of patients with spondyloarthritis: update of definitions and validation by the ASAS MRI working group. Ann. Rheum. Dis. 2019. 78(11). 1550-1558. doi: 10.1136/annrheumdis-2019-215589.
22. Rudwaleit M., Jurik A.G., Hermann K.G. et al. Defining active sacroiliitis on magnetic resonance imaging (MRI) for classification of axial spondyloarthritis: a consensual approach by the ASAS/OMERACT MRI group. Ann. Rheum. Dis. 2009. 68(10). 1520-1527. doi: 10.1136/ard.2009.110767.
23. van den Berg R., Lenczner G., Thévenin F. et al. Classification of axial SpA based on positive imaging (radiographs and/or MRI of the sacroiliac joints) by local rheumatologists or radiologists versus central trained readers in the DESIR cohort. Ann. Rheum. Dis. 2015. 74(11). 2016-2021. doi: 10.1136/annrheumdis-2014-205432.
24. Bakker P.A.C., Ramiro S., Ez-Zaitouni Z. et al. Is it useful to repeat magnetic resonance imaging of the sacroiliac joints after three months or one year in the diagnosis of patients with chronic back pain and suspected axial spondyloarthritis? Arthritis Rheumatol. 2019. 71(3). 382-391. doi: 10.1002/art.40718.
25. Weber U., Jurik A.G., Zejden A. et al. Frequency and anatomic distribution of magnetic resonance imaging features in the sacroiliac joints of young athletes: exploring “background noise” toward a data-driven definition of sacroiliitis in early spondyloarthritis. Arthritis Rheumatol. 2018. 70. 736-745. https://doi.org/10.1002/art.40429.
26. Weber U., Østergaard M., Lambert R.G. et al. Candidate lesion-based criteria for defining a positive sacroiliac joint MRI in two cohorts of patients with axial spondyloarthritis. Ann. Rheum. Dis. 2015. 74(11). 1976-1982. doi: 10.1136/annrheumdis-2014-205408.
27. Gong Y., Zheng N., Chen S.B. et al. Ten years’ experience with needle biopsy in the early diagnosis of sacroiliitis. Arthritis Rheum. 2012. 64. 1399-1406. https://doi.org/10.1002/art.33453.
28. de Winter J., de Hooge M., van de Sande M. et al. Magnetic resonance imaging of the sacroiliac joints indicating sacroiliitis according to the Assessment of SpondyloArthritis international Society definition in healthy individuals, runners, and women with postpartum back pain. Arthritis Rheumatol. 2018. 707. 1042-1048. doi: 10.1002/art.40475.
29. Varkas G., de Hooge M., Renson T. et al. Effect of mechanical stress on magnetic resonance imaging of the sacroiliac joints: assessment of military recruits by magnetic resonance imaging study. Rheumatology. 2018. 57(3). 508-513. doi: 10.1093/rheumatology/kex491.
30. Arnbak B., Grethe Jurik A., Hørslev-Petersen K. et al. Associations between spondyloarthritis features and magnetic resonance imaging findings: a cross-sectional analysis of 1,020 patients with persistent low back pain. Arthritis Rheumatol. 2016. 68(4). 892-900. doi: 10.1002/art.39551.
31. Eshed I., Miloh-Raz H., Dulitzki M. et al. Peripartum changes of the sacroiliac joints on MRI: increasing mechanical load correlating with signs of edema and inflammation kindling spondyloarthropathy in the genetically prone. Clin. Rheumatol. 2015. 34(8). 1419-1426. doi: 10.1007/s10067-015-2976-0.
32. Ling M.A., Gao Z., Zhong Y., Meng Q. Osteitis condensans ilii may demonstrate bone marrow edema on sacroiliac joint magnetic resonance imaging. Int. J. Rheum. Dis. 2018. 21(1). 299-307. doi: 10.1111/1756-185X.13125.
33. Weber U., Pedersen S.J., Zubler V. et al. Fat infiltration on magnetic resonance imaging of the sacroiliac joints has limited diagnostic utility in nonradiographic axial spondyloarthritis. J. Rheumatol. 2014. 41(1). 75-83. doi: 10.3899/jrheum.130568.
34. de Hooge M., van den Berg R., Navarro-Compán V. et al. Patients with chronic back pain of short duration from the SPACE cohort: which MRI structural lesions in the sacroiliac joints and inflammatory and structural lesions in the spine are most specific for axial spondyloarthritis? Ann. Rheum. Dis. 2016. 75(7). 1308-1314. doi: 10.1136/annrheumdis-2015-207823.
35. Maksymowych W.P., Wichuk S., Dougados M. et al. MRI evidence of structural changes in the sacroiliac joints of patients with nonradiographic axial spondyloarthritis even in the absence of MRI inflammation. Arthritis Res. Ther. 2017. 19(1). 126. doi: 10.1186/s13075-017-1342-9.
36. Maksymowych W.P., Wichuk S., Chiowchanwisawakit P., Lambert R.G., Pedersen S.J. Fat metaplasia and backfill are key intermediaries in the development of sacroiliac joint ankylosis in patients with ankylosing spondylitis. Arthritis Rheumatol. 2014. 66(11). 2958-2967. doi: 10.1002/art.38792.
37. Maksymowych W.P., Wichuk S., Dougados M. et al. Modification of structural lesions on magnetic resonance imaging of the sacroiliac joints by etanercept in the EMBARK trial: a 12-week randomised placebo-controlled trial in patients with non-radiographic axial spondyloarthritis. Ann. Rheum. Dis. 2018. 77. 78-84. http://dx.doi.org/10.1136/annrheumdis-2017-211605.
38. Laloo F., Herregods N., Varkas G. et al. MR signal in the sacroiliac joint space in spondyloarthritis: a new sign. Eur. Radiol. 2017. 27(5). 2024-2030. doi: 10.1007/s00330-016-4587-9.
39. Azmat O., Lambert R.G., Jibri Z., Maksymowych W.P. Subchondral bone sclerosis on computed tomography — does it have any value in the diagnosis of inflammatory sacroiliitis or is it a nonspecific finding? [abstract 684]. Arthritis Rheumatol. 2016. 68(10). 899-901.
40. Hermann K.G., Baraliakos X., van der Heijde D.M. et al. Descriptions of spinal MRI lesions and definition of a positive MRI of the spine in axial spondyloarthritis: a consensual approach by the ASAS/OMERACT MRI study group. Ann. Rheum. Dis. 2012. 71(8). 1278-1288. doi: 10.1136/ard.2011.150680.
41. Weber U., Zubler V., Zhao Z. et al. Does spinal MRI add incremental diagnostic value to MRI of the sacroiliac joints alone in patients with non-radiographic axial spondyloarthritis? Ann. Rheum. Dis. 2015. 74(6). 985-992. doi: 10.1136/annrheumdis-2013-203887.
42. Weber U., Zhao Z., Rufibach K. et al. Diagnostic utility of candidate definitions for a positive MRI of the spine in patients with axial spondyloarthritis. Arthritis Rheumatol. 2015. 67(4). 924-933. doi: 10.1002/art.39001.
43. Ez-Zaitouni Z., Bakker P.A., van Lunteren M. et al. The yield of a positive MRI of the spine as imaging criterion in the ASAS classification criteria for axial spondyloarthritis: results from the SPACE and DESIR cohorts. Ann. Rheum. Dis. 2017. 76(10). 1731-1736. doi: 10.1136/annrheumdis-2017-211486.
44. de Bruin F., Treyvaud M.O., Feydy A. et al. Prevalence of degenerative changes and overlap with spondyloarthritis-associated lesions in the spine of patients from the DESIR cohort. RMD Open. 2018. 4(1). e000657. doi: 10.1136/rmdopen-2018-000657.
45. Rennie W.J., Dhillon S.S., Conner-Spady B., Maksymowych W.P., Lambert R.G. Magnetic resonance imaging assessment of spinal inflammation in ankylosing spondylitis: standard clinical protocols may omit inflammatory lesions in thoracic vertebrae. Arthritis Rheum. 2009. 61(9). 1187-1193. doi: 10.1002/art.24561.
46. Blachier M., Coutanceau B., Dougados M. et al. Does the site of magnetic resonance imaging abnormalities match the site of recent-onset inflammatory backpain? The DESIR cohort. Ann. Rheum. Dis. 2013. 72(6). 979-985. doi: 10.1136/annrheumdis-2012-201427.
47. de Hooge M., de Bruin F., de Beer L. et al. Is the site of back pain related to the location of magnetic resonance ima-ging lesions in patients with chronic back pain? Results from the Spondyloarthritis Caught Early Cohort. Arthritis Care Res. 2017. 69(5). 717-723. doi: 10.1002/acr.22999.
48. Sepriano A., Rubio R., Ramiro S. et al. Performance of the ASAS classification criteria for axial and peripheral spondyloarthritis: a systematic literature review and meta-analysis. Ann. Rheum. Dis. 2017. 76(5). 886-890. doi: 10.1136/annrheumdis-2016-210747.
49. Sepriano A., Rubio R., Ramiro S., Landewé R., van der Heijde D. Predictive validity of the ASAS classification criteria for axial and peripheral spondyloarthritis after follow-up in the ASAS cohort: a final analysis. Ann. Rheum. Dis. 2016. 75. 1034-1042.
50. Ez-Zaitouni Z., van Lunteren M., Bakker P.A.C. et al. The influence of discrepant imaging judgements on the classification of axial spondyloarthritis is limited: a replication in the SpondyloArthritis Caught Early (SPACE) cohort. Ann. Rheum. Dis. 2018. 77(1). e1. doi: 10.1136/annrheumdis-2017-211553.
51. Bakker P.A., van den Berg R., Lenczner G. et al. Can we use structural lesions seen on MRI of the sacroiliac joints reliably for the classification of patients according to the ASAS axial spondyloarthritis criteria? Data from the DESIR cohort. Ann. Rheum. Dis. 2017. 76. 392-398. doi: 10.1136/annrheumdis-2016-209405.
52. Bakker P.A., van den Berg R., de Hooge M. et al. Impact of replacing radiographic sacroiliitis by magnetic resonance ima-
ging structural lesions on the classification of patients with axial spondyloarthritis. Rheumatology. 2018. 57(7). 1186-1193. https://doi.org/10.1093/rheumatology/kex532.
53. Molnar C., Scherer A., Baraliakos X. et al. TNF blockers inhibit spinal radiographic progression in ankylosing spondylitis by reducing disease activity: results from the Swiss Clinical Quality Management cohort. Ann. Rheum. Dis. 2018. 77(1). 63-69. doi: 10.1136/annrheumdis-2017-211544.
54. Ramiro S., Stolwijk C., van Tubergen A. et al. Evolution of radiographic damage in ankylosing spondylitis: a 12-year prospective follow-up of the OASIS study. Ann. Rheum. Dis. 2015. 74. 52-59. doi.org/10.1136/ annrheumdis-2013-204055.
55. Ramiro S., van der Heijde D., Sepriano A. et al. Spinal radiographic progression in early axial spondyloarthritis: five-year results from the DESIR cohort. Arthritis Care Res. 2019. 71(12). 1678-1684. doi: 10.1002/acr.23796.
56. Sieper J., van der Heijde D., Dougados M. et al. Efficacy and safety of adalimumab in patients with non-radiographic axi-
al spondyloarthritis: results of a randomised placebo-controlled trial (ABILITY-1). Ann. Rheum. Dis. 2013. 72(6). 815-822. doi: 10.1136/annrheumdis-2012-201766.
57. Sieper J., van der Heijde D., Dougados M. et al. A randomized, double-blind, placebo-controlled, sixteen-week study of subcutaneous golimumab in patients with active nonradiographic axial spondyloarthritis. Arthritis Rheumatol. 2015. 67(10). 2702-2712. doi: 10.1002/art.39257.
58. Molto A., Paternotte S., Claudepierre P., Breban M., Dougados M. Effectiveness of tumor necrosis factor α blockers in early axial spondyloarthritis: data from the DESIR cohort. Arthritis Rheumatol. 2014. 66(7). 1734-1744. doi: 10.1002/art.38613.
59. Baraliakos X., Sieper J., Chen S. et al. Non-radiogra-phic axial spondyloarthritis patients without initial evidence of inflammation may develop objective inflammation over time. Rheumatology. 2017. 56(7). 1162-1166. doi: 10.1093/rheumatology/kex081.
60. Sengupta R., Marzo-Ortega H., McGonagle D. et al. Short-term repeat magnetic resonance imaging scans in suspected early axial spondyloarthritis are clinically relevant only in HLA-B27-positive male subjects. J. Rheumatol. 2018. 45(2). 202-205. doi: 10.3899/jrheum.170171.
61. Poddubnyy D., Rudwaleit M., Haibel H. et al. Rates and predictors of radiographic sacroiliitis progression over 2 years in patients with axial spondyloarthritis. Ann. Rheum. Dis. 2011. 70(8). 1369-1374. doi: 10.1136/ard.2010.145995.
62. Sepriano A., Ramiro S., Landewé R., Dougados M., van der Heijde D., Rudwaleit M. Is active sacroiliitis on MRI associated with radiographic damage in axial spondyloarthritis? Real-life data from the ASAS and DESIR cohorts. Rheumatology. 2019. 58(5). 798-802. doi: 10.1093/rheumatology/key387.
63. Machado P.M., Baraliakos X., van der Heijde D., Braun J., Landewé R. MRI vertebral corner inflammation followed by fat deposition is the strongest contributor to the development of new bone at the same vertebral corner: a multilevel longitudinal analysis in patients with ankylosing spondylitis. Ann. Rheum. Dis. 2016. 75(8). 1486-1493. doi: 10.1136/annrheumdis-2015-208011.
64. Baraliakos X., Heldmann F., Callhoff J. et al. Which spinal lesions are associated with new bone formation in patients with ankylosing spondylitis treated with anti-TNF agents? A long-term observational study using MRI and conventional radiography. Ann. Rheum. Dis. 2014. 73(10). 1819-1825. doi: 10.1136/annrheumdis-2013-203425.
65. Maksymowych W.P., Wichuk S., Chiowchanwisawakit P., Lambert R.G., Pedersen S.J. Fat metaplasia on MRI of the sacroiliac joints increases the propensity for disease progression in the spine of patients with spondyloarthritis. RMD Open. 2017. 3(1). e000399. doi: 10.1136/rmdopen-2016-000399.

/116-2.jpg)
/116-1.jpg)
/119-1.jpg)
/120-1.jpg)