Журнал «Практическая онкология» Том 2, №4, 2019
Вернуться к номеру
Пептидрецепторна радіонуклідна терапія гастроентеропанкреатичних нейроендокринних пухлин: профіль ефективності та безпечності використання, критерії вибору методу
Авторы: Задоріжний Б.І., Ганченко Я.А.
Національний медичний університет ім. О.О. Богомольця, м. Київ, Україна
Рубрики: Онкология
Разделы: Справочник специалиста
Версия для печати
Незважаючи на значні успіхи у використанні методів діагностики та лікування, онкологічні захворювання посідають 2-ге місце в структурі смертності, після хвороб системи кровообігу. Хоча традиційні методи лікування злоякісних пухлин, такі як хірургічний, хіміотерапевтичний, променевий, досягли значного розвитку, існують принципові обмеження у ефективності їх ізольованого використання. Особливо це стосується лікування поширених форм онкологічних захворювань на пізніх стадіях. У даній статті проводиться огляд сучасних уявлень про нейроендокринні пухлини шлунково-кишкового тракту та перспективного методу пептидрецепторної радіонуклідної терапії, що базується на ключових даних клінічних досліджень, рекомендацій та інструкції National Comprehensive Cancer Network (NCCN), огляду літератури Lancet Journal, The New England Journal of Medicine, American Society of Clinical Oncology Journal, із використанням пошукового ресурсу PubMed.
Несмотря на значительные успехи использования методов диагностики и лечения, онкологические заболевания занимают 2-е место в структуре смертности, после болезней системы кровообращения. Хотя традиционные методы лечения злокачественных опухолей, такие как хирургический, химиотерапевтический, лучевой, достигли значительного развития, существуют принципиальные ограничения в эффективности их изолированного использования. Особенно это касается лечения онкологических заболеваний на поздних стадиях. В данной статье проводится обзор современных представлений о нейроэндокринных опухолях желудочно-кишечного тракта и перспективного метода пептидрецепторной радионуклидной терапии, основанный на ключевых данных клинических исследований, рекомендаций и инструкций National Comprehensive Cancer Network (NCCN), обзора литературы Lancet Journal, The New England Journal of Medicine, American Society of Clinical Oncology Journal, с использованием поискового ресурса PubMed.
Despite significant advances in methods of diagnosis and treatment, cancer is ranked second in mortality after diseases of the cardiovascular system. Although, traditional methods of treating malignant tumours, such as: surgical, chemotherapy, radiation therapy, have made significant progress, there are fundamental limitations to the effectiveness of their isolated use. In particular, this applies to the treatment of late-stage cancer. This article reviews current perceptions of gastrointestinal neuroendocrine tumours and a promising method of treatment — peptide receptor radionuclide therapy, based on key clinical research data, National Comprehensive Cancer Network (NCCN) guidelines, and New England Journal of Medicine, American Society of Clinical Oncology Journal, using the PubMed search resource.
гастроентеропанкреатичні нейроендокринні пухлини; пептидрецепторна радіонуклідна терапія; 90Y-Dotatoc; 177Lu-DOTATATE; радіоактивно мічені рецептори; NETTER-1
гастроэнтеропанкреатические нейроэндокринные опухоли; пептидрецепторная радионуклидная терапия; 90Y-Dotatoc; 177Lu-DOTATATE; радиоактивно меченные рецепторы; NETTER-1
gastroenteropancreatic neuroendocrine tumours; peptide receptor radionuclide therapy; 90Y-Dotatoc; 177Lu-DOTATATE; radiolabeled receptors; NETTER-1
Вступ
Був проведений огляд літератури, що стосується останніх досягнень у діагностиці та лікуванні гастроентеропанкреатичних нейроендокринних пухлин, та висвітлені сучасні підходи й останні дані щодо використання нових методів діагностики та лікування — пептидрецепторної радіонуклідної терапії (ПРРТ) як нової стратегії в терапії нерезектабельних місцево-поширених та/або метастатичних форм нейроендокринних пухлин (НЕП). Опрацьовані дані значної кількості проспективних і неконтрольованих досліджень, клінічних рекомендацій European Neuroendocrine Tumor Society (ENETS), інструкцій National Comprehensive Cancer Network (NCCN), літератури Lancet Journal, The New England Journal of Medicine, American Society of Clinical Oncology Journal, із використанням пошукового ресурсу PubMed.
Діагностика та вибір тактики лікування гастроентеропанкреатичних нейроендокринних пухлин
Нейроендокринні пухлини — гетерогенна група новоутворень, що складаються з так званих нейроендокринних клітин, які можуть бути розташовані по всьому тілу: від солідних ендокринних органів до ендокринних клітин в інших органах, таких як легені. Ней–роендокринні пухлини виявляють рідко, але останнім часом їх поширеність значною мірою збільшилась, в основному за рахунок новоутворень шлунково-кишкового тракту. За інформацією бази даних SEER (Surveillance, Epidemiology and End results), гастроентеропанкреатичні локалізації становлять близько 70 %. Частота виявлення НЕП, за даними Всесвітньої організації охорони здоров’я, становить 3,65 на 100 000 населення в рік. За останні десятиріччя досягнутий значний прогрес у розумінні патофізіологічних основ розвитку пухлин, їх класифікації, методів діагностики та лікування.
НЕП класифікують за ембріогенезом відповідно до відділів ембріональної кишкової трубки, з яких вони походять. Так, виділяють НЕП із передніх відділів: пухлини тимуса, легенів, бронхів, стравоходу, шлунка, дванадцятипалої кишки, підшлункової залози; із середніх відділів первинної кишки: пухлини тонкої кишки, апендикса, правої половини ободової кишки; із задньої частини ембріональної кишки: пухлини лівої половини ободової та прямої кишки [1].
Діагноз нейроендокринних пухлин шлунково-кишкового тракту (ШКТ) та підшлункової залози ґрунтується на даних огляду, результатах обстеження з використанням інструментальних методів і гістологічному висновку.
Первинне обстеження проводиться для визначення тактики лікування і включає в себе: огляд та збір анамнезу (огляд включає пальпацію лімфовузлів регіонарних зон, а також виявлення симптомів щодо віддалених метастазів або наявності карциноїдного синдрому).
Лабораторні дослідження:
— загальний аналіз крові з підрахунком лейкоцитарної формули і кількості тромбоцитів;
— біохімічний аналіз крові з визначенням показників функції печінки, нирок, рівня кальцію, глюкози;
— біохімічні маркери крові — хромогранін А, серотонін, панкреатичний поліпептид, гастрин, глюкагон, інсулін, вазоактивний інтестинальний пептид, соматостатин, кальцитонін, адренокортикотропний гормон, кортизол — за показанням; при карциноїдному синдромі 5-гідроксиіндооцтова кислота в сечі; щорічно — мозковий натрійуретичний пропептид (NTproBNP).
Інструментальні методи:
— ультразвукова діагностика органів черевної порожнини і малого таза, периферичних лімфовузлів;
— R-графія органів грудної клітки;
— електрокардіографія, ехокардіографія;
— комп’ютерна (КТ)/магнітно-резонансна томографія (МРТ) органів черевної порожнини і малого таза з в/в контрастуванням;
— позитронно-емісійна томографія (ПЕТ)/КТ — за показаннями (для G2, G3);
— ПЕТ/КТ із 68Ga — за показаннями (для G1, G2).
Гістологічне дослідження:
— біопсія первинна та за наявності метастатичних вогнищ пухлини з патоморфологічним дослідженням;
— імуногістохімічне дослідження зразку тканини з визначенням пухлинної експресії хромограніну А, синаптофазину, Ki-67, рецепторів соматостатину 2-го і 5-го типу.
За показаннями діагностика може бути розширена та доповнена: КТ органів грудної клітки, радіоізотопне дослідження скелета + R-графія, КТ/МРТ зон накопичення радіофармацевтичних препаратів (РФП), сцинтиграфія з 111In (октреоскан), КТ/МРТ головного мозку, консультація медичного генетика для хворих із синдромом множинної ендокринної неоплазії.
Алгоритм вибору лікування нейроендокринних пухлин ШКТ і підшлункової залози, що залежить від типу неоплазії та поширення процесу, орієнтований на рекомендації European Neuroendocrine Tumor Society (ENETS) 2016 року і класифікацію ВООЗ 2010 року для НЕП ШКТ (табл. 1) та 2017 року для НЕП підшлункової залози (табл. 2). Сьогодні виділяють дві групи неоплазій підшлункової залози: високодиференційовані і низькодиференційовані, останні позначаються як нейроендокринний рак. Новоутворення ШКТ за ступенем диференціювання поділяють на НЕП G1, G2, G3. До групи G1, G2 входять високодиференційовані НЕП, а в групу G3 — низькодиференційовані [2, 3].
Також тактика лікування залежить від типу НЕП, стадії за класифікацією TNM, ступеня диференціювання, функціональної активності пухлин, наявності чи відсутності метастазів, загального стану пацієнта та доступності терапевтичних методів. Визначення стадії здійснюється відповідно до класифікації TNM для органа, в якому виникла НЕП. Сьогодні актуальним є 8-ме видання класифікації TNM.
Методом вибору в лікуванні локалізованих форм НЕП I–III стадії є хірургічний за умови можливості його радикальності та циторедуктивності. У неоперабельних випадках чи за наявності низькопрогресуючих пухлин як лікування першої лінії призначають аналоги соматостатину. Актуальним та остаточно не вирішеним є питання стратегії лікування нерезектабельних місцево-поширених та/або метастатичних форм нейроендокринних пухлин шлунково-кишкового тракту, особливо в разі прогресування захворювання, незважаючи на проведення терапії інгібіторами кіназ та аналогами соматостатину.
Пептидрецепторна радіонуклідна терапія пацієнтів із гастроентеропанкреатичними НЕП — нова терапевтична стратегія
ПРРТ — варіант таргетної променевої терапії шляхом селективної доставки радіофармпрепарату у вигляді відкритого джерела випромінювання a- чи b-випромінювачем до клітин пухлини з метою цитотоксичного радіаційного протипухлинного ефекту.
Радіонуклідна терапія пептидними рецепторами розроблена протягом останніх двох десятиліть, заснована на використанні рецепторної мішені та становить собою одне з найбільш ефективних методів лікування високодиференційованих нерезектабельних та/або метастатичних НЕП шлунково-кишкового тракту. Для НЕП рецепторною мішенню є рецептори соматостатину, в основному 2-го та 5-го типу [4].
Метою методики є вибірковий вплив лише на ней–роендокринні пухлинні тканини, клітини яких відрізняються наявністю великої кількості соматостатинових рецепторів. Близько 80 % нейроендокринних пухлин експресують соматостатинові рецептори 2-го типу. Препарат зв’язується з рецептором, спричиняє інгібування гіперсекреції гормонів, біоактивних амідів та пептидів. Тим самим досягається антипроліферативний ефект. Також застосування ПРРТ сприяє запобіганню карциноїдних кризів при пептидсекретуючих високодиференційованих і низькодиференційованих нейроендокринних карциномах.
Здебільшого методика ПРРТ використовується для лікування прогресуючих первинних і метастатичних нейроендокринних пухлин. Пептидна рецепторна терапія застосовується як самостійно як паліативне лікування, так і в поєднанні з іншими сучасними методиками: хірургічним лікуванням, радіочастотною абляцією, лазеріндукованою термотерапією, транскатетерною селективною емболізацією та хіміоемболізацією артерій, селективною внутрішньовенною радіотерапією та іншими. Метод добре переноситься пацієнтами і не має більшості побічних ефектів, що часто виникають при застосуванні системної хіміотерапії: блювання, нудота, болі, алопеція, слабкість.
РФП для ПРРТ — це ліганд у вигляді пептиду, створюється шляхом маркування синтетичного та стабільного аналога соматостатину радіоізотопом, що випромінює b-промені. Аналог зв’язується зі специфічними мембранними рецепторами, які надмірно експресуються в НЕП та їх метастатичних вогнищах. Утворений комплекс хімічно стійкий і, проникаючи в клітину, спричиняє опромінення ядра. Особливістю нейроендокринних пухлинних клітин є наявність на їх поверхні рецепторів до соматостатину, з якими як ключ до замка зв’язується пептид ліганду при ПРРТ. Крім того, тривалий період напіввиведення аналога дозволяє отримати стійкий терапевтичний ефект. Механізм зв’язування між аналогом соматостатину та його рецепторами також застосовувався в діагностичних цілях при сцинтиграфічних дослідженнях із використанням пептидів 111In та 68Ga ПET [5].
Механізм та властивості терапевтичної ефективності ПРРТ:
— можливість локальної доставки декількох сотень грей без значного опромінення навколишніх тканин;
— блокування клітинного циклу шляхом пошкодження ДНК, викликаного радіаційним впливом, характерна більш значна загибель клітин при низьких показниках дози опромінення;
— локальне порушення мікроваскуляризації;
— місцеве переопромінення пухлинних тканин шляхом перехресного ефекту;
— активація антитілозалежної клітинної відповіді, як результат — значне підвищення цитотоксичності;
— навіть при досягненні низьких доз механізм загибелі клітин після опромінення значно підвищується шляхом апоптозу.
У середині 2000 років було синтезовано новий радіофармацевтичний препарат — 177Lu-DOTATATE. Структурно складається з трьох компонентів:
1. Аналог соматостатину — Octreotate (TATE) — пептид, що має високу хімічну спорідненість до рецепторів соматостатину.
2. Ізотоп 177Lu — джерело b-випромінювання, спричиняє терапевтичний цитотоксичний ефект та загибель клітин пухлини.
3. Хелатор — внутрішньокомплексна сполука, що ковалентно зв’язує 177Lu та Octreotate.
Значне проникнення в тканини лютецію 177 поєднується з тривалим періодом напіврозпаду радіонукліду (6,7 дня) та більш високою спорідненістю пептидного рецептора (приблизно в дев’ять разів вище, ніж 90Y-Dotatoc) для рецепторів соматостатину 2-го типу, що надмірно виражені в більшості НЕП. Крім того, лютецій 177 має значне g-випромінювання, що дозволяє отримати якісні зображення після обробки. Останнім часом ПРРТ із 177Lu-DOTATATE або з 90Y-Dotatoc продемонстрували, що метод є високоефективним для прогресуючих ГЕП-НЕП, рідко викликає токсичні прояви [6]. Результати отримано при порівнянні з конкурентними методами терапії, особливо з точки зору показника безрецидивної виживаності. До останнього часу важливим питанням у лікуванні ПРРТ було те, чи слід використовувати 177Lu-DOTATATE або 90Y-Dotatoc [7–9].
ПРРТ виявилася високоефективною у зменшенні специфічних симптомів карциноїдного синдрому: діареї, почервоніння обличчя та порушення діяльності серця через дисфункцію правого шлуночка, що є головним негативним прогностичним фактором у пацієнтів із НЕП. Метод також довів ефективність щодо зменшення болю, викликаного метастатичним ураженням кісток, що часто характерний при первинній локалізації пухлин у кишечнику та бронхах. ПРРТ, хоч і загалом добре переноситься, все ж викликає деякі побічні ефекти, які можна класифікувати на гострі та віддалені [10].
Гострі побічні ефекти, як правило, легкі — це нудота, головний біль, рідше — блювання; вони зустрічаються частіше в ранній постін’єкційній фазі і, як правило, швидко минущі. Також ПРРТ на початку лікування може посилити прояви нейроендокринного синдрому, що потребує симптоматичного лікування. Недавні дослідження показали, що такі первинні клінічні фактори ризику, як гіпертонія, діабет та порушення функції нирок або кісткового мозку, викликані попередньо проведеною хіміотерапією, підвищують токсичність ПРРТ. Тому були проведені дослідження для визначення мінімальної ефективної дози, що може зробити ПРРТ безпечною також для пацієнтів із високим ризиком ускладнень. Найважливішими віддаленими побічними ефектами є токсичне ураження нирок та кісткового мозку. Ниркової токсичності, як правило, можна уникнути за допомогою інфузії амінокислот аргініну чи лізину до та під час ПРРТ.
Ці амінокислоти, конкуруючи з рівнем канальцевої реабсорбції препарату, зменшують рециркуляцію та радіоактивність препарату в нирках, тим самим обме–жуючи їх вплив. Порівняльні дослідження показали, що конкурентна дія цих амінокислот здатна знизити токсичний вплив на 39 %, коли інфузія триває до 10 годин після призначення терапії, і на 65 %, коли вона триває протягом 2 днів [11, 12].
Дозиметричні дослідження підтвердили високу специфічність цих методів терапії та їх агресивний локальний вплив на пухлини, а також здатність не впливати на здорову тканину. У той же час дослідження показали, що разом із загальною активністю кількість циклів також відіграє важливу роль у проявах токсичності ПРРТ. Таким чином, дозиметричні наслідки, пов’язані з обсягом ураження та можливим токсичним ураженням нирок або кісткового мозку, безумовно, важливі, але не є єдиними критеріями безпечності, які слід враховувати.
Вивчення впливу 177Lu-DOTATATE проводилось у низці значних досліджень медичних центрів протягом останніх кількох років із визначенням ефективності та частоти розвитку токсичності. Нещодавні результати Baum та колег [13] підтвердили ефективність та безпеку використання 177Lu-DOTATATE у 56 пацієнтів із метастатичними та прогресуючими НЕП: 50 % — ШКТ, 26,8 % — підшлункової залози та 23,2 % — інших локалізацій первинної пухлини. Середнє дозування становило 7,0 гігабекереля (ГБк) з інтервалом 3 місяці, в основному протягом двох циклів. Оцінка ефективності проводилася за допомогою КТ та/або МРТ за критеріями RECIST 1.1, результати були стратифіковані відповідно до кількості проведених циклів та первинної локалізації пухлини. Загальна медіана коефіцієнта контролю захворювання (ККЗ) становила 93,8 % для пацієнтів, які отримували більше одного циклу, тоді як середній показник загальної та безрецидивної виживаності становив відповідно 17,4 та 34,2 місяці. Тривалість часу спостереження (середня ± стандартне відхилення) становить 16,1 ± 12,4 місяця. З урахуванням показника лише пацієнтів із ГЕП-НЕП, які отримали більше одного циклу, ККЗ підвищився до 100 %, тоді як показники безрецидивної виживаності були значно вищими для пацієнтів без ГЕП-НЕП (34,5 місяця проти 11,9 місяця відповідно). Більше того, серйозних побічних реакцій не спостерігалось. Повідомлялося про один випадок розвитку мієлотоксичності 3-го ступеня, проявів ниркової токсичності під час та після лікування не спостерігалось навіть у пацієнтів із наявною легкою нирковою недостатністю перед початком лікування.
Доказова база, обґрунтування для використання ПРРТ
До публікації результатів дослідження NETTER-1 (177Lu-DOTATATE порівняно з октреотидом) єдиною доведено ефективною терапією вибору було призначення аналогів соматостатину: октреотиду, сандостатину (октреотид LAR), ланреотиду. Спроби застосування таргетних інгібіторів кіназ, таких як сунітиніб та інгібітор m-TOR еверолімус, не продемонстрували значущої ефективності терапії, незважаючи на дуже високу вартість препаратів.
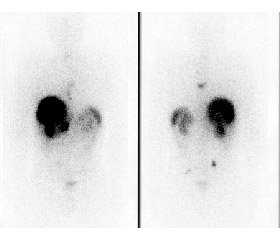
За результатами III фази дослідження NETTER-1 2018 р. [14] пептидрецепторна радіонуклідна терапія 177Lu-DOTATATE Luthatera довела свою ефективність і безпеку порівняно з традиційною терапією аналогами соматостатину (октреотид LAR (рис. 1)) та включена в рекомендації NCCN (Національна мережа онкологічних установ США) як терапія вибору нерезектабельних місцево-поширених та/або метастатичних нейроендокринних пухлин різної локалізації, що демонструють накопичення комплементарного РФП за результатами молекулярної візуалізації однофотон-емісійної або позитрон-емісійної КТ (ПЕТ-КТ) у разі прогресування захворювання на терапії аналогами соматостатину (табл. 3).
Небажані токсичні ускладнення 3–4-го ступеня при терапії 177Lu-DOTATATE виникають незначно частіше, ніж при терапії аналогами соматостатину (41 % проти 33 %), в основному за рахунок мієлотоксичності (тромбоцитопенія, лейкоцитопенія, лімфопенія) та проявів токсичності з боку шлунково-кишкового тракту (нудота, діарея, блювання).
Показання до терапії 177Lu-DOTATATE [15, 16]:
— прогресуючі форми, незважаючи на проведення специфічної терапії: нерезектабельні місцево-поширені та/або метастатичні нейроендокринні пухлини шлунково-кишкового тракту;
— гістологічно верифіковані нейроендокринні пухлини, позитивна експресія соматостатинових рецепторів, переважно 2-го типу, за даними імуногістохімічного дослідження;
— ступінь диференціювання пухлини за ВООЗ I–II (Ki-67 < 20 %);
— позитивна молекулярна візуалізація сомато–статинрецепторними радіофармпрепаратами за допомогою однофотон-емісійної або позитрон-емісійної КТ.
З часом використання ПРРТ, створеної спеціально для терапії та діагностики нейроендокринних пухлин, пошириться також і на інші типи підтверджених соматостатинрецепторно-позитивних пухлин. Таким чином, такі пухлини, як нейодпоглинаючий диференційований рак щитоподібної залози, рак молочної залози, лімфома, гліома, менінгіома та парагангліома, можна буде успішно лікувати методом ПРРТ у разі, коли зареєстровані першочергові методи терапії виявляться невдалими.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
1. Gustafsson B.I., Kidd M., Modlin I.M. Neuroendocrine tumors of the diffuse neuroendocrine system. Curr. Opin. Oncol. 2008. 20. Р. 1-12.
2. Rindi G. The ENRTS guidelines: the new TNM classification system. Tumori. 2010. 96(5). Р. 806-809.
3. Lüttges J. What’s new? The 2010 WHO classification for tumours of the pancreas. Pathologe. 2011. 32 (Suppl 2). Р. 332-336.
4. Reubi J.C., Schär J.C., Waser B. еt al. Affinity profiles for human somatostatin receptor subtypes SST1–SST5 of somatostatin radiotracers selected for scintigraphic and radiotherapeutic use. Eur. J. Nucl. Med. 2000. 27(3). Р. 273-282.
5. Seregni E., Chiti A., Bombardieri E. Radionuclide imaging of neuroendocrine tumours: biological basis and diagnostic results. Eur. J. Nucl. Med. 1998. 25. Р. 639-58.
6. Bushnell D.L. Jr, O’Dorisio T.M., O’Dorisio M.S. et al. 90Y-edotreotide for metastatic carcinoid refractory to octreotide. J. Clin. Oncol. 2010. 28(10). Р. 1652-1659.
7. Valkema R., De Jong M., Bakker W.H. et al. Phase I study of peptide receptor radionuclide therapy with [In-DTPA]octreotide: the Rotterdam experience. Semin. Nucl. Med. 2002. 32(2).
Р. 110-122.
8. Krebs S., Pandit-Taskar N., Reidy D., Beattie B.J., Lyashchenko S.K., Lewis J.S. et al. Biodistribution and radiation dose estimates for 68Ga-DOTA-JR11 in patients with metastatic neuroendocrine tumors. Eur. J. Nucl. Med. Mol. Imaging. 2019. 46.
Р. 677-85.
9. Comparison of 68Ga-DOTATOC PET and 111In-DTPAOC (Octreoscan) SPECT in patients with neuroendocrine tumours. Eur. J. Nucl. Med. Mol. Imaging. 2007. 34. Р. 1617-26.
10. Bodei L., Kidd M., Modlin I.M. et al. Measurement of circulating transcripts and gene cluster analysis predicts and defines therapeutic efficacy of peptide receptor radionuclide therapy (PRRT) in neuroendocrine tumors. Eur. J. Nucl. Med. Mol. Imaging. 2016. 43(5). Р. 839-851.
11. de Jong M., Krenning E. New advances in peptide receptor radionuclide therapy. J. Nucl. Med. 2002. 43(5). Р. 617-620.
12. Bernard B.F., Krenning E.P., Breeman W.A. et al. D-lysine reduction of indium-111 octreotide and yttrium-90 octreotide renal uptake. J. Nucl. Med. 1997. 38(12). Р. 1929-1933.
13. Baum R.P., Kluge A.W., Kulkarni H. et al. [(177)–Lu-DOTA](0)-D-Phe(1)-Tyr(3)-Octreotide ((177)Lu-DOTATOC)For peptide receptor radiotherapy in patients with advanced neuroendocrine tumours: a phase-II study. Theranostics. 2016. 6(4).
Р. 501-510.
14. Strosberg J., El-Haddad G., Wolin E. et al. Phase 3 trial of 177Lu-dotatate for midgut neuroendocrine tumors. N. Engl. J. Med. 2017. 376. Р. 125-35.
15. Zaknun J.J., Bodei L., Mueller-Brand J., Pavel M.E., Baum R.P., Hörsch D. et al. The joint IAEA, EANM, and SNMMI practical guidance on peptide receptor radionuclide therapy (PRRNT) in neuroendocrine tumours. Eur. J. Nucl. Med. Mol. Imaging. 2013. 40. Р. 800-16.
16. The NCCN Guidelines for Neuroendocrine and Adrenal Tumors: recommendations for the management of adult patients with neuroendocrine tumors (NETs) v1 2019 updates to the guidelines for locoregional advanced disease, and/or distant metastasis originating from gastrointestinal tract, bronchopulmonary, and thymus primary NETs.

/26-1.jpg )
/27-1.jpg )
/28-1.jpg )
/29-1.jpg )