Журнал «Травма» Том 20, №5, 2019
Вернуться к номеру
Маркер проліферації PCNA як прогностичний показник ефективності неоад’ювантної поліхіміотерапії у жінок з місцево-поширеним раком молочної залози
Авторы: Думанський Ю.В. (1), Бондар О.В. (2), Ткаченко О.І. (2), Столярчук Є.А. (2)
1 - Інститут експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького, м. Київ, Україна
2 - Одеський національний медичний університет, м. Одеса, Україна
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Актуальність. Рак молочної залози є найбільш поширеним онкологічним процесом серед жіночого населення розвинених країн та однією з причин смертності та втрати працездатності. Особливе місце в структурі даної патології посідають місцево-поширені форми. Це обумовлює актуальність пошуку нових методів діагностики та лікування таких пацієнток. Важливим завданням для сучасної мамології є визначення та прогнозування ефективності неоад’ювантної хіміотерапії для вибору правильної тактики лікування. Одним з таких параметрів є проліферативна активність пухлини. Мета роботи: оцінка ефективності неоад’ювантного лікування із застосуванням системного, ендолімфатичного та селективного внутрішньоартеріального шляхів уведення хіміопрепаратів у хворих на місцево-поширений рак молочної залози з використанням індексу проліферативної активності пухлини на основі маркера PCNA. Матеріали та методи. Проведено ретроспективний аналіз результатів комплексного лікування пацієнток з первинно неоперабельним місцево-поширеним раком молочної залози на основі селективних та системних шляхів уведення хіміопрепаратів. До дослідження включено 90 клінічних випадків, що відповідали умовам дослідження. Вибірка розподілена на 3 групи залежно від обраного виду неоад’ювантної поліхіміотерапії; сформовано 2 контрольні (на основі системної та ендолімфатичної терапії) на 1 досліджувану (з використанням селективного внутрішньоартеріального шляху доставки) групу. Паралельно з рутинними методами в усіх пацієнток додатково вивчалася динаміка проліферативної активності пухлини за ядерним антигеном PCNA. Результати. Статистичний аналіз проводився між групами порівняння; за критичне значення обраний медіанний рівень маркера 25 %. За ступенем регресії PCNA визначено, що селективна внутрішньоартеріальна поліхіміотерапія при раку молочної залози з низьким індексом проліферативної активності має статистичну перевагу за показниками загальної виживаності та середньої тривалості життя (p < 0,05) порівняно з групами контролю. Висновки. За допомогою показника PCNA можна надійно оцінювати проліферативну активність пухлини, таким чином прогнозувати ефект неоад’ювантної поліхіміотерапії та обирати оптимальну тактику комплексного лікування.
Актуальность. Рак молочной железы является наиболее распространенным онкологическим процессом среди женского населения развитых стран и одной из причин смертности и потери трудоспособности. Особое место в структуре данной патологии занимают местно-распространенные формы. Это обусловливает актуальность поиска новых методов диагностики и лечения таких пациенток. Важной задачей для современной маммологии является определение и прогнозирование эффективности неоадъювантной химиотерапии для выбора правильной тактики лечения. Одним из таких параметров является пролиферативная активность опухоли. Цель работы: оценка эффективности неоадъювантного лечения с применением системного, эндолимфатического и селективного внутриартериального путей введения химиопрепаратов у больных с местно-распространенным раком молочной железы с использованием индекса пролиферативной активности опухоли на основании маркера PCNA. Материалы и методы. Проведен ретроспективный анализ результатов комплексного лечения пациенток с первично неоперабельным местно-распространенным раком молочной железы на основе селективных и системных путей введения химиопрепаратов. В исследование включено 90 клинических случаев, соответствующих условиям исследования. Выборка разделена на 3 группы в зависимости от выбранного вида неоадъювантной полихимиотерапии; сформированы 2 контрольные (на основе системной и эндолимфатической терапии) на 1 исследуемую (с использованием селективного внутриартериального пути доставки) группу. Параллельно с рутинными методами у всех пациенток дополнительно изучалась динамика пролиферативной активности опухоли по ядерному антигену PCNA. Результаты. Статистический анализ выполнялся между группами сравнения; в качестве критического значения выбран медианный уровень маркера 25 %. По степени регрессии PCNA определено, что селективная внутриартериальная полихимиотерапия при раке молочной железы с низким индексом пролиферативной активности имеет статистическое преимущество по показателям общей выживаемости и средней продолжительности жизни (p < 0,05) по сравнению с группами контроля. Выводы. С помощью показателя PCNA можно надежно оценивать пролиферативную активность опухоли, таким образом прогнозировать эффект неоадъювантной полихимиотерапии и выбирать оптимальную тактику комплексного лечения.
Background. Breast cancer is the most common cancer process among the female population in developed countries and one of the causes of mortality and disability in this cohort. The locally advanced forms take pride of place in the structure of this pathology. This determines the relevance of the search for new methods of diagnosis and treatment in such patients. An important task for modern mammologists is the determination and prediction of the effectiveness of neoadjuvant chemotherapy to select adequate treatment tactics. One of these parameters is the tumor proliferative activity index. The purpose was the evaluation of the effectiveness of neoadjuvant treatment using systemic, endolymphatic and selective intra-arterial routes of chemotherapeutic agent administration in patients with locally advanced breast cancer using the tumor proliferative index based on the PCNA marker. Materials and methods. A retrospective analysis of the results of a comprehensive treatment of patients with initially inoperable locally advanced breast cancer based on selective and systemic routes of administration of chemotherapeutic agents was performed. The study included 90 clinical cases corresponding to the circumstances. The sample was divided into 3 groups depending on the selected type of neoadjuvant polychemotherapy; there were formed two control groups (based on systemic and endolymphatic therapy) and one study group (the selective intra-arterial delivery route was used). Along with routine methods, the dynamics of proliferative activity of the tumor by the PCNA nuclear antigen was additionally studied in all patients. Results. Statistical analysis was performed between comparison groups; the median marker level of 25 % was selected as the critical value. According to the degree of PCNA regression, it was determined that selective intra-arterial chemotherapy for the breast cancer with a low proliferative activity index has a statistical advantage in overall survival and average life expectancy (p < 0.05) compared with the control groups. Conclusions. Using the PCNA indicator, one can reliably evaluate the proliferative activity of the tumor, thus predicting the effect of neoadjuvant chemotherapy and choosing the optimal tactics of the complex treatment.
індекс проліферативної активності; маркер PCNA; селективна внутрішньоартеріальна поліхіміотерапія; ендолімфальна поліхіміотерапія; системна поліхіміотерапія; місцево-поширений рак молочної залози
индекс пролиферативной активности; маркер PCNA; селективная внутриартериальная полихимиотерапия; эндолимфатическая полихимиотерапия; системная полихимиотерапия; местно-распространенный рак молочной железы
proliferative activity index; PCNA marker; selective intra-arterial polychemotherapy; endolymphatic polychemotherapy; systemic polychemotherapy; locally advanced breast cancer
Вступ
Рак молочної залози в останні роки займає перше місце у структурі онкологічної захворюваності у жінок, що й обумовлює надзвичайний інтерес вчених-онкологів до успіхів у лікуванні даної категорії пацієнток [1]. Незважаючи на те, що рак молочної залози належить до «зовнішніх» локалізацій пухлин, кількість хворих з місцево-поширеними формами захворювання з року в рік продовжує збільшуватись. Поширені форми раку молочної залози вважаються прогностично несприятливими, і лише впровадження сучасних схем хіміогормонотерапії з урахуванням індивідуальних особливостей рецепторного статусу пухлини дозволило дещо покращити результати лікування хворих [2]. Однак виживання і якість життя у цій групі, як і раніше, залишаються одними з найнижчих, що й визначає необхідність подальшої оптимізації методів лікування.
Питанню комплексного лікування місцево-поширеного раку молочної залози (МПРМЗ) приділено досить мало уваги. Існуючі одиничні літературні посилання з цієї теми відображають прагнення одних авторів спростити хірургічний підхід у лікуванні цих форм захворювання до циторедуктивних оперативних втручань (у поєднанні з брахітерапією або без неї), а інших — модифікувати відомі схеми системної хіміотерапії на користь того чи іншого хіміотерапевтичного засобу [3].
У зв’язку з вищевикладеним особливої актуальності набуває розробка нових персоналізованих методів лікування хворих із первинно неоперабельними формами раку молочної залози, що нададуть змогу суттєво збільшити тривалість та покращити якість життя пацієнток.
Актуальність пошуку нових методик у комплексному лікуванні МПРМЗ, особливо при несприятливому біологічному підтипі, диктується невтішними результатами лікування даної категорії хворих навіть у рамках найбільших міжнародних міжцентрових досліджень та неухильно зростаючими цифрами захворюваності.
Хірургія раку молочної залози має широкий спектр втручань. Об’єднуючим принципом залишається прагнення хірургів до виконання радикальних операцій. Дискутабельним питанням у спеціальній науковій літературі є шляхи підведення хіміотерапії до пухлинного вогнища з метою переведення пухлини з неоперабельного стану до стану, при якому маємо можливість виконати радикальний обсяг хірургічного втручання [4].
Обґрунтованими залишаються думки вчених про значну небезпеку розвитку великої кількості ускладнень у хворих на МПРМЗ [5]. Така думка пов’язана з вираженим зниженням імунних реакцій і високим ступенем інтоксикації у хворих на МПРМЗ.
Місцево-поширені форми раку молочної залози вважаються прогностично несприятливими, і лише впровадження нових схем хіміогормонотерапії дозволило дещо покращити результати лікування хворих [6]. Тривалість і якість життя у цій групі залишаються низькими, що і потребує подальшого пошуку методів лікування. Цьому питанню до цього часу приділено недостатньо уваги.
Прогрес у терапії раку молочної залози пов’язують з комбінованим і комплексним лікуванням, що включає, окрім хірургічних, променеву, хіміотерапію і гормонотерапію у різних модифікаціях [7].
Поліхіміотерапія (ПХТ) у комплексному лікуванні хворих на МПРМЗ спрямована на зменшення біологічної активності пухлинних клітин в основному вогнищі [8].
Білок PCNA (ядерний антиген проліферуючих клітин) уперше був описаний наприкінці 1970-х років як антиген у сироватці хворих на системний червоний вовчак. PCNA є негістоновим білком ДНК-клемпу масою 90 кДа, який діє як фактор процесивності для дельта-ДНК-полімерази в клітині і відіграє важливу роль в реплікації ДНК, репарації ДНК, ремоделюванні хроматину, епігенетичних процесах і когезії сестринських хроматид.
Гомотривимірна молекула PCNA, будучи амбівалентною основою топологічного зв’язку ДНК-полімерази, запобігає її дисоціації від матриці ДНК та збільшує швидкість роботи до 1000 разів порівняно з непроцесованим ферментом. Кодується однойменним геном. Експресія PCNA знаходиться під контролем E2F-вмісних транскрипційних факторів.
Структурно PCNA є мультимерним комплексом з трьох однакових мономерів, що мають торичну внутрішню форму та шестигранну зовнішню з локусами зв’язку з ДНК-полімеразою та іншими білками для виконання різних метаболічних процесів ДНК на вершинах. У процесі роботи субодиниці білка звиваються у вигляді симетричної асоціації навколо подвійної нитки ДНК в ділянці вилки реплікації і «ковзають» по ній разом з полімеразою. «Ковзання» полегшується наявністю шару молекул води в центральній порі клемпу; цей шар розділяє поверхню білка і ДНК. Збірка і утилізація молекули проводяться регуляторним реплікаційним фактором С.
PCNA має найвищу експресію під час G1- і S-фаз, і його експресія зменшується в G2- і M-фазах. Цей маркер також присутній на ранній фазі G0 через його довге половинне життя — 8–20 годин. Референтні значення PCNA корелюють зі ступенем активності проліферації клітин або їх неопластичної трансформації.
Раніше, коли прототипове антитіло PCNA можна було використовувати тільки на заморожених ділянках, відкриття PCNA, яке можна було виявити в парафінових зрізах, викликало великий ентузіазм. Той факт, що експресія клітин PCNA значно підвищується під час фаз S і G2 клітинного циклу, але є дуже низькою в неактивних клітинах, робить цей білок хорошим маркером проліферації клітин. Відтоді імуногістохімічне забарвлення PCNA широко використовується для діагностики та прогнозу раку молочної залози. При використанні разом з іншими маркерами раку молочної залози PCNA є корисним для оцінки проліферації клітин та прогнозування їх поведінки. Збільшення експресії PCNA також корелює з більш коротким періодом без захворювання і загальною виживаністю у пацієнтів з раком молочної залози [9].
Дослідження з використанням двовимірного електрофорезу в поліакриламідному гелі (2D PAGE) показало, що PCNA може бути корисним маркером у діагностиці раку молочної залози. У цьому дослідженні в клітинах раку молочної залози були виявлені дві ізоформи білка PCNA, тоді як тільки одна ізоформа спостерігалася в незлоякісних клітинах молочної залози. Ізоформа, що зустрічається тільки в первинних і іморталізованих клітинах, була позначена як «основна» форма, тоді як інша ізоформа, що спостерігається в клітинних лініях раку молочної залози, була відзначена як «кисла» форма, при цьому обидві ізоформи відрізняються тільки їх ізоелектричною точкою. Було визначено, що ця різниця в pН обумовлена посттрансляційною модифікацією. На підставі цих знахідок були розроблені поліклональні антитіла до канцер-асоційованих PCNA, які можна використовувати як відмінний діагностичний маркер раку молочної залози [10]. Індекс проліферативної активності має різні референтні значення для різних сценаріїв онкологічної патології. На підставі імуногістохімічного діагностичного тесту на БК виділяють такі типи: низькоагресивна пухлина — PCNA менше за 25 %, агресивна — більше від 25 %.
У перспективі дослідження різноманітної панелі специфічних біомаркерів РМЗ та їх компіляція дозволять комплексно розраховувати індекс проліферативної активності пухлини, що надасть можливість більш точно оцінювати поточний статус новоутворення та прогнозувати ефективність запланованого лікування [11, 12].
Мета дослідження: визначення ролі імуногістохімічного маркера PCNA при оцінці якості неоад’ювантної поліхіміотерапії з використанням регіонарних і системних шляхів доставки фармакологічних препаратів у пацієнток з місцево-поширеним раком молочної залози. Визначення індексу проліферативної активності (ІПА) на основі даного показника для прогнозування ефективності лікування, а також розробки адекватної тактики комплексного передопераційного протипухлинного лікування.
Матеріали та методи
Дане дослідження проведене на основі ретроспективного аналізу 90 історій хвороби стаціонарних хворих, що містили дані про пацієнток з місцево-поширеним раком молочної залози класу Т4А-DN0-2М0, які отримували спеціалізоване комплексне неоад’ювантне лікування на базі хірургічного відділення Університетської клініки Одеського національного медичного університету у період 2012–2016 рр. Перед включенням пацієнток до протоколу дослідження були отримані особисті письмові добровільні згоди на участь у дослідженні відповідно до Гельсінської декларації Всесвітньої медичної асоціації (протокол № 117A засідання комісії з біоетики Одеського національного медичного університету від 12.05.2017).
Загальна вибірка сформована та стандартизована за віковими та клінічними показниками. Віковий діапазон становив 37–76 років. Середній вік хворих — 47,0 ± 6,5 року. Усі пацієнтки були всебічно дообстежені по органах і системах у повному обсязі, за необхідності консультовані суміжними спеціалістами, адекватно компенсовані за супутніми захворюваннями для проведення багатоетапного процесу спеціалізованого лікування. Індивідуальна програма лікування формувалася консиліумом за участі лікарів хірургів-онкологів, фахівців з хіміотерапевтичного та радіотерапевтичного лікування та базувалася на даних спіральної комп’ютерної томографії, магнітної резонансної томографії, цифрової мамографії, ультра–звукового дослідження молочних залоз, результатах мікроморфологічного та імуногістохімічного дослідження біопсійного матеріалу.
У всіх пацієнток імуногістохімічне дослідження PCNA у зразках пухлин проводилося паралельно з рутинними лабораторними та інструментальними аналізами, як і морфологічні дослідження біопсійних зразків. Проліферативну активність визначали шляхом імуногістохімічного дослідження за допомогою антитіл до PCNA (Thermo Fisher Scientific, США). Як мінімальну кількість проліферуючих клітин для оцінки було обрано фракцію 1000 пухлинних клітин — мінімальне число для отримання репрезентативних результатів. Значення PCNA було виражене як відсоткова частина клітин з позитивним забарвленням. Більшість пацієнтів в усіх групах (60 %) мали значення PCNA в діапазоні 20–30 %, з медіаною 25 %.
Відповідно до методу доставки хіміопрепаратів до пухлинного вогнища під час неоад’ювантної поліхіміотерапії всі пацієнтки були розподілені на 3 групи. Першу контрольну групу становили 22 пацієнтки (24 %) з МПРМЗ, для яких як передопераційний курс ПХТ була обрана внутрішньовенна системна поліхіміотерапія (СПХТ): 3–4 курси за схемами CAF, CMF або CAMF у дозуванні, відповідному до протоколів BSA. До другої контрольної групи увійшли 27 (30 %) пацієнток, яким з метою зменшення пухлини до розмірів, при яких можливе радикальне хірургічне лікування, проведена ендолімфатична поліхіміотерапія (ЕЛПХТ): 3–4 курси за схемами CAF, CMF або CAMF у дозуванні, відповідному протоколам BSA (з внутрішньовенним призначенням доксорубіцину). У групі дослідження 41 (46 %) пацієнтка отримала відповідну кількість курсів регіонарної поліхіміотерапії шляхом селективної внутрішньоартеріальної поліхіміотерапії (СВАПХТ): 3–4 курси за схемами CAF, CMF або CAMF у дозуванні, відповідному протоколам BSA (з внутрішньовенним призначенням доксорубіцину).
Для статистичного аналізу даних використовувалася статистика динамічних рядів. Для оцінки значущості цих змін застосовано параметричний тест Манна — Уїтні.
Результати та обговорення
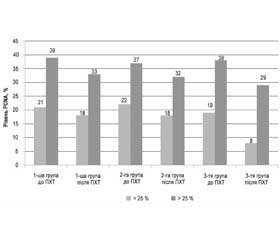
На першому етапі проведений однофакторний статистичний аналіз результатів регресії рівня біомаркера у групах порівняння залежно від використаного методу передопераційного менеджменту (рис. 1).
У першій контрольній групі до проведення поліхіміотерапії референтні значення PCNA становили: < 25 % у 9 (41 %) пацієнток з М ± m = 20,6 ± 1,5; > 25 % у 13 (59 %) пацієнток з М ± m = 39,3 ± 5,8. У результаті проведення неоад’ювантної СПХТ частка пацієнток з низьким рівнем PCNA збільшилася на 33 % (з 9 до 12 осіб) при загальному зниженні показника до 18,2 ± 1,6 (р > 0,05). Середнє значення у 10 пацієнток, у яких рівень PCNA залишився вищим за критичний, становило 33,4 ± 4,8 (р > 0,05).
У другій контрольній групі перед проведенням поліхіміотерапії рівень PCNA у гістологічних зразках мав такі значення: < 25 % у 13 пацієнток (59 %) з М ± m = 21,7 ± 2,0; > 25 % у 14 (41 %) пацієнток з М ± m = 37,4 ± 5,2. Після проведення запланованого курсу неоад’ювантної ЕЛПХТ число пацієнток даної групи з високим рівнем PCNA зменшилося з 14 до 12 з середнім рівнем PCNA 32,0 ± 3,2 (р > 0,05). Середнє значення досліджуваного маркера проліферації становило 18,5 ± 2,0 (р > 0,05) у 15 осіб підгрупи з підпороговим рівнем PCNA.
У досліджуваній групі до проведення поліхіміотерапії контрольні значення PCNA у зразках біопсійного матеріалу були: < 25 % у 22 (63 %) пацієнток з М ± m = 19,4 ± 2,0; > 25 % у 19 (37 %) пацієнток з М ± m = 37,5 ± 5,7. У результаті проведення неоад’ювантної СВАПХТ загальна кількість пацієнток з низьким рівнем PCNA збільшилася на 8 (36 %) осіб зі зниженням індексу проліферативної активності за PCNA до 8,6 ± 1,2 (р < 0,05). Середній рівень PCNA в 11 пацієнток з високим рівнем контрольованого показника становив 28,6 ± 1,9 (р > 0,05).
За U-критерієм Манна — Уїтні (рис. 2) є статистично значуща перевага в результатах лікування у пацієнток досліджуваної групи за динамікою зниження значення PCNA у підгрупах з низьким рівнем — порівняно з першою контрольною (p < 0,01) та другою контрольною групами (p < 0,01).
Для пацієнток у першій контрольній групі середня тривалість життя з моменту встановлення діагнозу становила 2,61 ± 0,90 року, при цьому загальна трирічна виживаність — 54,5 % (12 пацієнток); у другій конт-рольній групі середня тривалість життя з моменту встановлення діагнозу становила 2,9 ± 0,5 року, а загальна трирічна виживаність — 55,6 % (15 пацієнток); у пацієнток досліджуваної групи середня тривалість життя з моменту встановлення діагнозу становила 3,8 ± 0,7 року, при цьому загальна трирічна виживаність — 73,2 % (30 пацієнток).
За фактом досягнення резектабельного статусу пухлини з’ясовані такі співвідношення: 1-ша контрольна група — 12 пацієнток з низьким проліферативним індексом за PCNA; 2-га контрольна група — 15 пацієнток з PCNA менше 25 %; досліджувана група — 31 пацієнтка з підпороговим ІПА.
Для підгрупи з низьким рівнем PCNA < 25 % середня тривалість життя з моменту встановлення діагнозу становила у першій групі 3,43 ± 0,40 року (трирічна виживаність — 54,5 %); у другій групі — 3,32 ± 0,20 року (трирічна виживаність — 55,6 %); у третій групі — 4,24 ± 0,40 року (трирічна виживаність — 73,2 %). У підгрупі з високим рівнем PCNA 25 % середня тривалість життя з моменту встановлення діагнозу у першій групі становила 1,67 ± 0,20 року (трирічна виживаність — 0 %); у другій групі — 2,38 ± 0,20 року (трирічна виживаність — 0 %); у третій групі — 2,61 ± 0,30 року (трирічна виживаність — 0 %) (рис. 3).
За оцінкою динаміки PCNA метод СВАПХТ є більш ефективним у неоад’ювантному лікуванні хворих з первинними неоперабельними формами РМЗ і має кращі результати з точки зору інгібування та реверсії прогресії пухлини порівняно з системним підходом. Спираючись на проведені дослідження, автори пропонують проводити аналіз регресії проліферативної активності пухлини на підставі змін рівня PCNA для визначення ефективності проведеного лікування. Даний спосіб може бути ефективно використаний для оцінки біологічних властивостей пухлини, прогнозування перебігу захворювання (сприятливого або несприятливого) і вибору оптимальної тактики неоад’ювантної ПХТ (регіонарної або системної) в рамках комплексної протипухлинної терапії.
Висновки
1. PCNA є перспективним маркером для оцінки проліферативної активності пухлини при розробці спеціалізованих онкологічних програм з урахуванням індивідуальних особливостей організму пацієнтки та біохімічного профілю пухлини, щоб уникнути неефективних уніфікованих методів лікування на основі емпіричного підходу.
2. При референтних значеннях рівня білка PCNA < 25 % метод СВАПХТ є більш ефективним у неоад’ювантному лікуванні пацієнток з місцево-поширеним раком молочної залози і має кращі результати інгібування і реверсії прогресування росту пухлини.
Внесок авторів в підготовку статті: Ю.В. Думанський — концепція та дизайн дослідження; О.В. Бондар — збирання та оброблення матеріалів; О.І. Ткаченко — аналіз отриманих результатів; Є.А. Столярчук — написання тексту.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
1. Sueishi M., Takagi M., Yoneda Y. The forkhead-associated domain of PCNA antigen interacts with the novel kinesin-like protein Hklp2. The Journal of Biological Chemistry. 2000. 275. 28888-28892. https://doi.org/10.1074/jbc.M003879200
2. Viale G., Regan M.M., Mastropasqua M.G. et al. Predictive value of tumor PCNA expression in two randomized trials of adjuvant chemoendocrine therapy for node-negative breast cancer. Journal of the National Cancer Institute. 2009. 100 (3). 207-212. https://doi.org/10.1093/jnci/djm289
3. Strzalka W., Ziemienowicz A. Proliferating cell nuclear antigen (PCNA): a key factor in DNA replication and cell cycle regulation. Annals of Botany. 2010. 107 (7). 1127-1140. https://doi.org/10.1093/aob/mcq243.
4. Hoege C., Pfander B., Moldovan G.L., Pyrowolakis G., Jentsch S. RAD6-dependent DNA repair is linked to modification of PCNA by ubiquitin and SUMO. Nature. 2002. 419 (6903). 135-141. https://doi.org/10.1038/nature00991.
5. Strzalka W., Ziemienowicz А. Proliferating cell nuclear antigen (PCNA): a key factor in DNA replication and cell cycle regulation. Annals of Botany. 2011. 107. 1127-1140. doi:10.1093/aob/mcq243
6. Stukenberg P.T., Studwell-Vaughan P.S., O’Donnell M. Mechanism of the sliding beta-clamp of DNA polymerase III holoenzyme. The Journal of Biological Chemistry. 1991. 266: 11328-11334.
7. Soria G., Gottifredi V. PCNA-coupled p21 degradation after DNA damage: the exception that confirms the rule? DNA Repair. 2010. 9. 358-364.
8. Strzalka W., Oyama T., Tori K., Morikawa K. Crystal structures of the Arabidopsis thaliana proliferating cell nuclear antigen 1 and 2 proteins complexed with the human p21 C-terminal segment. Protein Science. 2009. 18. 1072-1080.
9. Gulbis J.M., Kelman Z., Hurwitz J., O’Donnell M., Kuriyan J. Structure of the C-terminal region of p21 (WAF1/CIP1) complexed with human PCNA. Cell. 1996. 87. 297-306.
10. Krishna T.S., Kong X.P., Gary S., Burgers P.M., Kuriyan J. Crystalstructure of the eukaryotic DNA polymerase processivity factor PCNA. Cell. 1994. 79. 1233-1243.
11. McNally R., Bowman G.D., Goedken E.R., O’Donnell M., Kuriyan J. Analysis of the role of PCNA-DNA contacts during clamp loading. BMC Structural Biology. 2010. 10. 3. doi:10.1186/1472-6807-10-3.
12. Moldovan G.-L., Pfander B., Jentsch S. PCNA, the maestro of replication fork. Cell. 2007. 129. 665-679.

/81-1.jpg)
/81-2.jpg)
/82-1.jpg)