Международный эндокринологический журнал Том 15, №2, 2019
Вернуться к номеру
Особливості перебігу та частота клінічних проявів полігландулярного синдрому IIIА типу у хворих, які проживають у йододефіцитному Тернопільському регіоні
Авторы: Пасєчко Н.В., Рожко І.В., Наумова Л.В., Мігенько Л.М., Крицький Т.І.
Тернопільський державний медичний університет імені І.Я. Горбачевського, м. Тернопіль, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. Актуальною на сьогодні залишається проблема ранньої діагностики поєднаних ендокринопатій, таких як цукровий діабет (ЦД) 1-го типу, автоімунне ураження щитоподібної залози, надниркових залоз на тлі інших автоімунних патологій. Одним із проявів такого поєднання нозологій є автоімунний полігландулярний синдром (АПС), що характеризується послідовним або одночасним дефіцитом функцій декількох ендокринних залоз і включає широкий спектр автоімунних порушень не тільки ендокринної системи. Ризик розвитку АПС у пацієнтів, які мешкають на йододефіцитних територіях, зростає у декілька разів, що потребує більш ретельного обстеження та уваги. Мета. Вивчення особливостей перебігу та частоти клінічних проявів АПС ІІІА типу у жителів йододефіцитного Тернопільського регіону. Матеріали та методи. Обстежені 184 жінки із АПС ІІІА типу, які проживають на йододефіцитних територіях Тернопільщини. Вік обстежених становив від 19 до 74 років. Результати. В обстежених у Тернопільській університетській лікарні 73,14 % пацієнтів маніфестація АПС ІІІА типу починалася із ЦД 1-го типу. Патологію щитоподібної залози було діагностовано через 5–8 років після виявлення ЦД. Функціональні розлади патології щитоподібної залози проявлялися гіпотиреозом у 31,77 %, еутиреозом — у 48,96 % та гіпертиреозом — у 19,27 %. Компенсація ЦД досягалася важче у хворих із патологією щитоподібної залози з її функціональною недостатністю. Середні титри антитіл до тиреоїдної пероксидази (ТПО) становили 382,46 МО/мл. Максимальний показник антитіл до ТПО дорівнював 873,12 МО/мл. Встановлено, що у хворих із вищим показником антитіл до ТПО складніше було досягнути компенсації ЦД. Висновки. Всіх пацієнтів із ЦД 1-го типу в йододефіцитному регіоні доцільно обстежувати на наявність ознак ураження щитоподібної залози і АПС ІІІА типу.
Актуальность. Актуальной на сегодняшний день остается проблема ранней диагностики сочетанных эндокринопатий, таких как сахарный диабет (СД) 1-го типа, аутоиммунное поражение щитовидной железы, надпочечников на фоне других аутоиммунных патологий. Одним из проявлений такого сочетания нозологий является аутоиммунный полигландулярный синдром (АПС), который характеризуется последовательным или одновременным дефицитом функций нескольких эндокринных желез и включает широкий спектр аутоиммунных нарушений не только эндокринной системы. Риск развития АПС у пациентов, проживающих на йододефицитных территориях, возрастает в несколько раз, что требует более тщательного обследования и внимания. Цель. Изучение особенностей течения и частоты клинических проявлений АПС ІІІА типа у жителей йододефицитного Тернопольского региона. Материалы и методы. Обследованы 184 женщины с АПС ІІІА типа, проживающие на йододефицитных территориях Тернопольщины. Возраст обследованных составил от 19 до 74 лет. Результаты. У обследованных в Тернопольской университетской больнице 73,14 % пациентов манифестация АПС ІІІа типа начиналась с СД 1-го типа. Патология щитовидной железы была диагностирована через 5–8 лет после выявления СД. Функциональные расстройства патологии щитовидной железы проявлялись гипотиреозом у 31,77 %, эутиреозом — у 48,96 % и гипертиреозом — у 19,27 %. Компенсация СД достигалась труднее у больных с патологией щитовидной железы с ее функциональной недостаточностью. Средние титры антител к тиреоидной пероксидазе (ТПО) составляли 382,46 МЕ/мл. Максимальный показатель антител к ТПО достигал 873,12 МЕ/мл. Установлено, что у больных с более высоким показателем антител к ТПО труднее было достичь компенсации СД. Выводы. Всех пациентов с СД 1-го типа в йододефицитном регионе целесообразно обследовать на наличие признаков поражения щитовидной железы и АПС ІІІА типа.
Background. The problem of early diagnosis of endocrinopathies, such as type 1 diabetes mellitus, autoimmune thyroid disease, adrenal gland disorders on the background of other autoimmune pathologies, remains relevant. One of the manifestations of such combination of nosologies is autoimmune polyglandular syndrome, which is characterized by the sequential or simultaneous deficiency of several endocrine glands and includes a wide range of autoimmune disorders, within not only the endocrine system. The risk of developing polyglandular syndrome in patients with iodine deficiency is increasing several times, and this requires more careful examination and attention. The purpose of the study — to investigate the features of the course and frequency of clinical manifestations of polyglandular syndrome type IIIA in the residents of iodine deficient Ternopil region. Materials and methods. One hundred eighty-four women with polyglandular syndrome type ІІІА living in the iodine deficient territories of Ternopil region were examined. Their age ranged from 19 to 74 years. Results. In 73.14 % of the patients with polyglandular syndrome type IIIA who were examined at the Ternopil University Hospital, its manifestation began with diabetes mellitus type 1. Thyroid disease was diagnosed 5–8 years after the diagnosis of diabetes. Functional disorders of thyroid gland manifested in hypothyroidism in 31.77 % of cases, euthyroidism — in 48.96 % and hyperthyroidism — in 19.27 %. It was more difficult to achieve diabetes compensation in patients with thyroid pathology with its functional deficiency. The average level of thyroid peroxidase antibodies was 382.46 IU/ml. The highest index of thyroid peroxidase antibodies accounted for 873.12 IU/ml. It was found that in patients with higher level of thyroid peroxidase antibodies, it was more difficult to achieve the compensation of diabetes mellitus. Conclusions. Therefore, it is advisable to examine all patients with type 1 diabetes mellitus in the iodine deficient region in order to detect the symptoms of thyroid disorders and autoimmune polyglandular syndrome type IIIA.
автоімунний полігландулярний синдром; йодний дефіцит; цукровий діабет 1-го типу; гіпотиреоз
аутоиммунный полигландулярный синдром; йодный дефицит; сахарный диабет 1-го типа; гипотиреоз
autoimmune polyglandular syndrome; iodine deficiency; type 1 diabetes mellitus; hypothyroidism
Вступ
За умов стрімкого розвитку медицини, лікувально–діагностичних можливостей проблема коморбідності, полінозологічності, перехресного (overlap) синдрому набуває актуальності і часто не тільки ускладнює точність діагностики, вибірку хворих для скринінгу, але й потребує більшої уваги щодо контролю перебігу захворювань, призначення відповідних схем лікування. Останніми роками в ендокринологічній практиці часто спостерігається поєднання цукрового діабету (ЦД) та первинного гіпотиреозу; на тлі цих захворювань відзначаються і хвороби надниркових залоз, зокрема гіпокортицизм. Трапляється полісистемне ураження автоімунного генезу, наприклад ревматоїдний артит, при якому діагностується автоімунне ураження щитоподібної залози (ЩЗ), надниркових залоз і ЦД 1–го типу. Таке поєднання нозологій може бути в одного пацієнта і в літературі описане як автоімунний полігландулярний синдром (АПС).
АПС — це автоімунний стан, що характеризується послідовним або одночасним дефіцитом функцій декількох ендокринних залоз [1]. АПС містить широкий спектр автоімунних порушень не тільки ендокринної системи. Розрізняють дуже рідкісний полігландулярний синдром, що розвивається у неповнолітніх, — АПС I, у дорослого населення — АПС II, а також у дорослого населення без недостатності надниркових залоз — АПС III [1]. 1980 року була запропонована перша класифікація полігландулярної недостатності: АПС тип I і АПС тип II. Згодом була описана нова група АПС — тип III [2, 3].
На сьогодні розрізняють три типи полігландулярного синдрому:
— АПС тип І — зазвичай проявляється в дитинстві, у 3–5 років, або в ранньому підлітковому віці. Його також називають «ювенільна автоімунна полі–ендокринопатія» [4, 5]. Співвідношення жінок до чоловіків перебуває в межах від 0,8 : 1 до 2,4 : 1 [1]. АПС I — рідкісна патологія, однак генетичний скринінг родин першого ступеня уражених суб’єктів може розкрити більш високу поширеність, ніж очікувалося, через виявлення клінічно більш м’яких або атипових випадків [1]. Характеризується поєднанням двох і більше хвороб (хронічний кандидоз, гіпопаратиреоз, недостатність надниркових залоз, або хвороба Аддісона).
— АПС типу ІІ (синдром Шмідта) проявляється первинним гіпокортицизмом, автоімунним ураженням ЩЗ, ЦД 1–го типу. Спостерігається в осіб віком від 20 до 60 років, поширеність становить 1 : 20 000 [4–6], співвідношення хворих чоловіків і жінок дорівнює 1 : 3 [7]. Всі розлади, що призводять до деструкції тканин, мають тривалу фазу — клітинної втрати, яка передує відкритому автоімунному захворюванню [1], тобто клінічній маніфестації.
— АПС типу ІІІ — зазвичай відзначається у людей віком 30–50 років [8] і характеризується автоімунним ураженням ендокринних залоз за винятком надниркових залоз. Він проявляється автоімунним тиреоїдитом (АІТ), ЦД 1–го типу, злоякісною анемією, вітиліго, алопецією чи іншою органоспецифічною автоімунною патологією. АПС III можна поділити на три підкатегорії: АПС IIIA — АІТ із ЦД 1–го типу; АПС IIIB — АІТ із злоякісною анемією; АПС IIIC — АІТ із вітиліго чи алопецією, чи іншим органоспецифічним автоімунним захворюванням [9].
Розрізняють такі фактори ризику розвитку автоімунної агресії:
— генетичні фактори (сімейні та популяційні дослідження показали, що АПС ІІІА має яскраво виражений генетичний фон. Кілька генних варіацій, наявних як при АІТ, так і при ЦД. Найбільш важливими генами сприятливості є людський лейкоцитарний антиген (хромосома 6), цитотоксичний Т–лімфоцит–асоційований антиген–4 (хромосома 2), інтерлейкін–2–рецептор альфа/CD25 генної ділянки (хромосома 10)) [10–12];
— екологічні тригери (неправильне харчування, шкідливі звички, забруднене довкілля, постійні стреси стали для багатьох людей пусковим механізмом розвитку цієї патології).
Важливе значення у розвитку полігландулярного синдрому має дефіцит йоду, який можна розглядати як тригер при генетичній схильності, так і модифікуючий чинник, що ускладнює медикаментозний контроль захворювання. Найбільш негативний вплив недостатності йоду виявляється у вагітних жінок і дітей. Йод — невід’ємний компонент гормонів ЩЗ, необхідний для нормального розвитку нервової системи. Наслідки дефіциту йоду містять спектр розладів, серед яких зоб, гіпотиреоз, затримка фізичного та психічного розвитку дітей [14]. Крім того, дефіцит йоду є однією з головних причин психічних розладів у дитинстві [15]. Ступінь дефіциту йоду у популяції класифікується за середньою концентрацією йоду у сечі (легкий — 50–99 мкг/л; помірний — 20–49 мкг/л; тяжкий — < 20 мкг/л) [14]. Попри те, що шкідливі наслідки тяжкого дефіциту йоду добре відомі, несприятливі результати легкого та середнього ступеня йодного дефіциту менш явні, проте не менш небезпечні [16].
У літературі не описано випадків дослідження впливу йодного дефіциту на виникнення АПС; наведено клінічний випадок, в якому використання йодної добавки для лікування фіброзно–кістозного захворювання молочної залози підтвердило позитивний вплив йоду на перебіг ЦД 1–го типу та контроль глікемії. Автори припускають, що йод відіграє певну роль в активності рецепторів гормонів, і роблять висновки, що йод шляхом приєднання до рецепторів інсуліну покращує метаболізм глюкози. За умов йодного дефіциту в організмі людини спостерігається протилежний ефект, відповідно, при недостатності йоду складніше досягнути компенсації ЦД [9].
Дефіцит йоду залишається однією із глобальних проблем, оскільки в світі налічується близько двох мільярдів людей, які проживають в йододефіцитних районах [13]. Для України залишається актуальним вирішення проблеми йодного дефіциту, оскільки не існує територій, на яких населення не зазнавало б ризику розвитку йододефіцитних захворювань [14]. Серйозна значущість проблеми полягає в тому, що нестача йоду під час вагітності призводить до ускладнень процесу гестації і тому значною мірою визначає загальний потенціал здоров’я. За відсутності національної програми боротьби з йодним дефіцитом у багатьох областях України здійснюються певні профілактичні заходи, однак вони не мають постійного характеру, не охоплюють все населення регіону, а засоби профілактики іноді не відповідають міжнародним стандартам [14].
Метою роботи є вивчення особливостей перебігу та частоти клінічних проявів АПС ІІІА типу у жителів йододефіцитного Тернопільського регіону.
Матеріали та методи
Обстежені 184 жінки із АПС ІІІА типу, які проживають на йододефіцитних територіях Тернопільщини. Вік обстежених становив від 19 до 74 років. Хворих жінок розподілено за віковими групами: 19–29 років — 38 осіб, що становить 19,79 %; 30–59 років — 125 осіб, тобто 65,11 %; 60–74 років — 29 осіб, що дорівнює 15,10 %. Статистичну обробку результатів проведено за допомогою програми Microsoft Office Excel 2010.
Результати
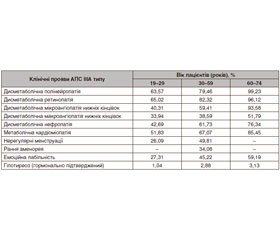
У хворих на АПС ІІІА типу, які лікувалися в Тернопільській університетській лікарні, переважали такі клінічні симптоми: дисметаболічна полінейропатія, дисметаболічна ретинопатія, дисметаболічна мікроангіопатія, дисметаболічна макроангіопатія нижніх кінцівок, нефропатія; метаболічна кардіоміопатія, порушення менструального циклу, рання аменорея (до 45 років), емоційна лабільність, гіпотиреоз (табл. 1).
У 73,14 % хворих первинною була маніфестація ЦД, другою — АІТ (26,86 %) як складових АПС. За тривалістю ЦД хворих розподілили так: до 5 років — 22,45 %; 5–10 років — 35,82 %; 10–20 років — 27,64 %; понад 30 років — 14,09 %.
В обстежених пацієнтів були виявлені такі лабораторні зміни: глікемія натще — 9,18 ± 1,74 ммоль/л; постпрандіальна глікемія — 13,27 ± 1,19 ммоль/л; глікований гемоглобін — 9,47 ± 2,08 %; загальний холестерин — 5,94 ± 1,36 ммоль/л; тригліцериди — 2,81 ммоль/л; холестерин ліпопротеїнів низької щільності — 4,23 ± 2,71 ммоль/л; холестерин ліпопротеїнів високої щільності — 1,44 ± 1,12 ммоль/л.
Серед пацієнтів, які отримували інсулінотерапію аналогами людського інсуліну, компенсації досягнуто у 24,31 %; стан субкомпенсації — у 54,23 %; стан декомпенсації залишався у 21,46 %. Серед пацієнтів, які отримували генно–інженерні інсуліни, стан компенсації вдалося досягнути у 13,46 % хворих, субкомпенсації — у 50,89 %, стан декомпенсації підтверджено у 35,65 %. Отже, стан компенсації ЦД у складі АПС на аналогах людського інсуліну був кращим.
Ураження ЩЗ у складі АПС виявлялися зазвичай через 5–8 років після маніфестації ЦД:
— гіпертиреозом (АІТ із гіперфункцією ЩЗ) — 37 осіб (19,27 %). Рівень тиреотропного гормону (ТТГ) — 0,02 ± 0,36 мМО/л (норма 0,47–4,15 мМО/л);
— еутиреозом — 94 жінки (48,96 %). Рівень ТТГ, вільного тироксину, вільного трийодтироніну — у межах референсних значень;
— гіпотиреозом (АІТ із гіпофункцією ЩЗ) — 61 жінка (31,77 %). Рівень ТТГ — 6,25 ± 0,86 мМО/л.
Середні титри антитіл до тиреоїдної перо–ксидази (ТПО) становили 382,46 МО/мл. Максимальний показник антитіл до ТПО дорівнював 873,12 МО/мл. Встановлено, що у хворих із вищим показником антитіл до ТПО складніше було досягнути компенсації ЦД. Середні дози замісної гормонотерапії левотироксином натрію при гіпотиреозі становили 75,00 ± 1,28 мг/добу.
За даними ультразвукової діагностики (УЗД) у пацієнтів першої вікової групи (19–29 років) було виявлено гіпертрофічну форму АІТ з підвищеною ехогенністю ЩЗ; другої вікової групи (30–59 років) — неоднорідну ехогенність, нечіткі контури, ділянки гіперваскуляризації ЩЗ; третьої вікової групи (60–74 роки) — гіпо–, атрофічну форму АІТ.
У 16,93 % хворих, які перебували на лікуванні в ендокринологічному відділенні Тернопільської університетської лікарні, вперше виявлено АІТ із гіпофункцією ЩЗ. Серед них компенсований гіпотиреоз спостерігали у 6,18 %, субкомпенсований — у 47,89 %, декомпенсований — у 45,93 %. За даними УЗД ЩЗ, у хворих на АІТ збільшена залоза першого ступеня була виявлена у 43,26 %; другого ступеня — 15,42 %, нормальних розмірів — у 41,33 %.
Обговорення
У всьому світі останніми роками зростає частота автоімунної патології. Крім загальновідомих поліендокринних синдромів, зокрема АПС, значно частішими є ураження двох ендокринних залоз (поєднання автоімунних тиреопатій із ЦД 1–го типу), що стало основою для виділення нового АПС ІІІ типу. В Україні, за даними різних авторів [16], частота поєднання ЦД із тиреопатіями зросла до 32 % від усієї патології ЩЗ. Однак лікувальна тактика і лікування таких хворих на сьогодні остаточно не розроблені. Окремі роботи з цього приводу [3, 5, 8] не створюють загальновизнаної думки, отже, ця актуальна проблема потребує подальшого вивчення.
Клінічна симптоматика АПС ІІІА типу залежить від функціональної активності ЩЗ, рівня глікемії, глюкозурії, давності захворювання на ЦД 1–го типу і незначною мірою від розмірів ЩЗ. Особливості перебігу АПС ІІІА типу полягають у тому, що виникненню цього захворювання передували психічний стрес, часті гострі вірусні інфекції, проведена імунізація.
2010 року у світі зареєстровано 12,1 % хворих на АПС. Станом на липень 2017 року, відсоток пацієнтів із цією патологією зріс до 27,5 %, серед них 10,84 % хворих на АПС ІІІА типу [3].
За даними Всесвітньої організації охорони здоров’я, приблизно 2 млрд осіб у світі проживає на ендемічних йододефіцитних територіях, із ризиком йодного дефіциту щорічно народжується 38 млн дітей. У структурі загальної захворюваності на ендокринопатії перше місце посідає патологія ЩЗ — 43,2 % [15]. До того ж серед усіх хворих із патологією ЩЗ майже 87,5 % становлять жінки [16]. У 10,3 % підлітків (серед них 72,5 % дівчат) зареєстрована патологія ЩЗ [15]. У людей, які проживають на ендемічних територіях, імовірність виникнення АПС ІІІА типу зростає у 10 разів [7].
Висновки
1. Всіх пацієнтів із цукровим діабетом 1–го типу в йододефіцитному регіоні доцільно обстежувати на наявність ознак ураження щитоподібної залози і АПС ІІІА типу.
2. Серед обстежених пацієнтів першим у складі АПС ІІІА типу був виявлений цукровий діабет 1–го типу (у 73,14 %). Прогресування та виникнення ускладнень ЦД залежали від тривалості та ступеня його компенсації, однак компенсація досягалася важче у хворих із ураженням щитоподібної залози, особливо з її функціональною недостатністю.
3. Ураження щитоподібної залози в обстежених хворих спостерігали, зазвичай, через 5–8 років після маніфестації цукрового діабету, що проявлявся гіпотиреозом у 31,77 %, еутиреозом — у 48,96 % та гіпертиреозом — у 19,27 %.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.

/113-1.jpg)