Вступ
Остеоартроз — хронічне захворювання суглоба, що полягає в дистрофічних змінах хрящових поверхонь синовіальних суглобів і субхондральної кістки. Захворювання має різну етіологію, активно досліджується й дискутується в працях, що містять клінічні й експериментальні дані щодо вивчення особливостей розвитку остеоартрозу. Перетин передньої хрестової зв’язки є універсальним способом моделювання остеоартрозу в лабораторних тварин, що призводить до пошкодження хрящів і субхондральної резорбції кістки (Hayami Т., 2006). При цій патології можливі компенсаторна активація ангіогенезу (Chunyi Wen, 2014) та ішемічні зміни тканин хряща (хряща й кістки) (Zhang C., 2012). Судинний чинник відіграє не останню роль у патогенезі остеоартрозу. Порушення кровотоку в судинах кістки й синовіальної оболонки призводить до некрозу судин і оточуючого хряща. Ці результати дозволили припустити, що життєздатність епіфізарного хряща суглоба залежить від адекватного кровопостачання оточуючих судин і сильно впливає на стан кровопостачання в патогенезі остеохондрозу, остеоартрозу (Carlson C.S., 1991). Показано спонтанні ураження й некроз епіфізарного хряща стегнової кістки, що були пов’язані з некротичними кровоносними судинами (Lykissas M.G., 2012). Структурно-функціональні порушення ендотелію збільшують тромбоз і підвищують ризик тромбозу, призводять до ішемічного ураження м’яких тканин, капсули суглоба й некрозу кісткової тканини. Ендотеліальна дисфункція в пацієнтів із деформуючим остеоартрозом супроводжується порушенням тонусу вен нижніх кінцівок, що проявляється збільшенням діаметра вен, їх дилатацією і сприяє розвитку тромботичних ускладнень після ендопротезування великих суглобів (Тлеубаева Н.В., 2009). Разом з тим судинний чинник є самостійним фактором мінералізації суглобового хряща. Саме тому дослідження ролі судинних порушень у колінному суглобі при нормі й патології є актуальним завданням у вирішенні проблеми лікування остеоартрозу.
Мета: дослідити в експерименті зміни судин капсули колінного суглоба на моделі остеоартрозу.
Матеріали та методи
Дослідження проведено на кролях вагою 3–4 кг. Остеоартроз моделювався шляхом механічного пошкодження суглобової поверхні великогомілкової кістки. Для цього тварин наркотизували тіопенталом натрію в дозі 60 мг/кг (внутрішньоочеревинно). Тварин у стані наркотичного сну фіксували в положенні на спині. Ділянку шкіри навколо колінного суглоба голили й зрошували бетадином (Egis, Угорщина).
Скальпелем здійснювали доступ до колінного суглоба через медіальну поверхню, перетинали великогомілкову зв’язку. Шляхом циркулярних обертів модифікованою спицею Ілізарова з напайкою, пошкоджувальній частині якої надавався рух низькообертовим приводом, завдавали пошкодження в центральній ділянці суглобової поверхні. Епіфізарну поверхню стегнової кістки залишали інтактною. Суглобову сумку зашивали шовним матеріалом 3/0. По поверхні суглобової сумки здійснювали термічну коагуляцію з метою створення регіонарного ішемічного пошкодження. Шкіру на рівні доступу також зашивали матеріалом 3/0 і зрошували бетадином.
Через 1,5 місяця після моделювання артрозу тварин виводили з експерименту шляхом швидкої декапітації. Здійснювали доступ до колінного суглоба. Анатомічні утворення суглоба (капсулу, меніск, епіфіз великогомілкової кістки) фіксували протягом 3 днів у 10% розчині нейтрального формаліну. Після фіксації зразки промивали в проточній воді, щоб позбутися формаліну. Капсулу суглоба й меніски зневоднювали й вміщували в парапласт (Leica Surgipath Paraplast Regular). Протокол дегідратації: етанол (від 70% до 100% розчину етанолу), діоксан, ксилол, ксилол/парапласт (1 : 1; 37 ºС), парапласт (56 °С).
Парафінові зрізи органів товщиною 8–10 мкм виготовляли на мікротомі Thermo Microm HM 360. Зрізи депарафінували, регідратували й забарвлювали гематоксиліном та еозином за стандартною методикою. Окремо виділяли епіфіз великогомілкової кістки. Зразки промивали й проводили їх декальцинацію у розчині OsteoFast 2 (BioGnost Ltd., Хорватія) упродовж 4–5 тижнів (3 зміни декальцинуючого розчину). Після завершення декальцифікації проби промивали водою. Зі зразків отримували кріозрізи товщиною 20–25 мкм. Зрізи забарвлювали толуїдиновим синім за методикою Шморля. Гістологічні зрізи вміщували під покривне скельце в синтетичний бальзам. Гістологічні препарати досліджували на мікроскопі Olympus BX 51.
Результати та обговорення
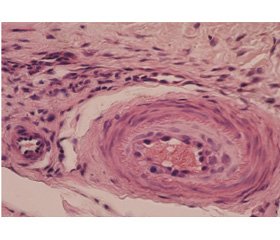
В експерименті досліджено структурні утворення пошкодженого й інтактного колінного суглоба. При макроскопічному дослідженні встановлено збільшення обсягу параартикулярних тканин суглобової капсули. Цілісність суглобової сумки (капсули) не порушена, а товщина стінки збільшена, має ділянки розшарування. При мікроскопічному дослідженні виявлено структурно-функціональні зони (шари) капсули — зовнішню фіброзну й внутрішню синовіальну (рис. 1). Фіброзна оболонка являє собою щільну волокнисту сполучну тканину, охоплює суглоб по всьому зовнішньому контуру й переходить у періост. Структурні зміни фіброзного шару капсули полягають у розшаруванні колагенових пучків, появі лакун з інтерстиційною желатиноподібною масою й зміні кровоносних судин. В окремих артеріях встановлено зменшення просвіту за рахунок збільшення товщини інтими, появи фібробластів у субендотеліальній зоні судини. На противагу цьому вени й оточуюча сполучна тканина містили значну кількість лейкоцитів (нейтрофілів, еозинофілів і моноцитів), що вказує на їх інфільтрацію в стінку капсули і є морфологічною ознакою запалення.
/74-1.jpg)
Внутрішній шар капсули — синовіальна оболонка — вистилає синовіальну порожнину за винятком меніска й суглобових поверхонь. У контролі й дослідній групи синовіальна мембрана (оболонка) формує ворсинки (відростки). У дослідній групі у стінці й ворсинках мікросудини різко кровонаповнені й стазовані (рис. 2), а в деяких зразках ворсинки мають загиблі клітини (синовіоцити), фрагментарно позбавлені клітин. Ці зміни є проявом дистрофічних процесів у синовіальній оболонці капсули суглоба.
/74-2.jpg)
Меніски були виявлені в усіх досліджених суглобах через 1,5 місяця після моделювання остеоартрозу. Верхня, нижня й латеральна поверхня менісків були визначені, а їх контур структурно збережений. Винятком була медіальна поверхня: відмічено фрагментарне пошкодження після моделювання патології. Гістологічна будова меніска відносно однорідна, межі між верхньою, середньою й нижньою поверхнями нечіткі. Меніск представлений хрящовою тканиною, хондромукоїдом і хондроцитами. Останні розташовані здебільшого хаотично. За морфологією структура меніска подібна до гіалінового хряща, як і суглобові поверхні, лише в латеральній поверхні хондроцити формують веретеноподібні структури, між якими відмічено пучки колагену. Характерною ранньою морфологічною ознакою пошкодження меніска при моделюванні остеоартрозу є набряк клітинних лакун, а пізньою — загибель хондроцитів і редукція щільності ізогенних груп у об’ємі хондромукоїду, поява пустих лакун (рис. 3).
/75-1.jpg)
Вірогідним критерієм остеоартрозу є дефект суглобової поверхні. На рис. 4 показано дефект хряща й кістки у ділянці перетину хрестоподібної зв’язки і пошкодження великогомілкової кістки. Зміни хряща полягають у зменшенні товщини, загибелі хондроцитів, появі порожніх лакун ізогенних груп. Субхондральна кісткова тканина також має вільні лакуни, що є ознакою деструктивних змін, хоча в деяких ділянках виявлено зміну контуру кісткової тканини у бік епіфізарної поверхні за рахунок проникнення судин у глибокі шари хряща й осифікації.
Отже, на основі результатів експериментального дослідження зроблено висновок про участь судинного чинника в розвитку остеоартрозу колінного суглоба. Запропонована модель остеоартрозу дозволила отримати патологію, що максимально наближена до патогенезу захворювання. Встановлено деформаційні й дистрофічні зміни суглобової поверхні, зміни субхондральної епіфізарної кістки й порушення стінки синовіальної оболонки. Якщо структурні основи пошкодження суглобової поверхні описано в багатьох публікаціях, то окремий інтерес становлять результати дослідження суглобової капсули. Схожі структурні порушення хряща описано при введенні колагенази VII (Seung’Ah, 2007), натрієвої солі монойодоцтової кислоти (Baragi), дексаметазону (Вишневский, 2004), вітаміну А (Патент 79206, Україна), створенні механічного дефекту й перетинанні хрестоподібної зв’язки (Smith, 2005; Ozkan, 2009; Batiste, 2002; Tiraloche, 2005; Jean, 2009). Але увага зосереджена головним чином на суглобовій поверхні, а змінам капсули і, головне, судинам не приділяється достатньо уваги. Як відомо, кісткова тканина характеризується високою васкуляризацією, особливо епіфізи кісток. Тому судинна патологія на рівні кісток позначається на метаболізмі епіфізарного хряща, адже суглобова поверхня позбавлена власних судин. Такою є нормальна гістофізіологія хрящової тканини, і її трофіка реалізується з субепіфізарної кістки й суглобової сумки, синовіальної рідини (Arnoldi et al., 1994). Тому порушення перфузії судин капсули позначається на метаболізмі всього суглоба. Це пояснюють тим, що зменшена перфузія спричинює застійні явища в судинах капсули, що супроводжується збільшенням проникності стінки судин, виходу плазми й розвитку інтерстиційного набряку. Це, у свою чергу, збільшує внутрішньотканинний і суглобовий тиск, що погіршує метаболізм хрящової тканини суглоба. Ознаки таких змін виявлено у власних дослідженнях: збільшення інтерстиційної рідини, розшарування капсули, стаз судин капсули і загибель синовіоцитів, що формують ворсинки синовіальної мембрани. Ці зміни оцінено як наслідок ішемічного пошкодження. Ішемія призводить до втрати життєздатності клітин суглобової стінки, хондроцитів менісків і суглобових поверхонь, субхондральної кістки. Деформаційне пошкодженні поверхні великогомілкової кістки спричинило деструктивні зміни й на рівні кістки, які полягали у формуванні порожніх лакун, позбавлених кісткового мозку. Це є ознакою резорбції кістки, на що вказують і інші автори (Noble B.S., 2003; Cardoso L., 2009). Очевидно, що зміни на рівні капсули, меніска й кістки є стадійними й прямо залежать від ступеня втрати перфузії регіонарних судин. Відповідно до цього зниження перфузії й прогресуюча ішемія визначають характер перебігу дистрофічних змін хряща суглоба.
Висновки
Результати власних досліджень дозволили зробити висновок про те, що життєздатність епіфізарного хряща суглоба залежить від адекватного кровопостачання оточуючих судин і судинний чинник впливає на патогенез остеоартрозу.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Hayami T., Pickarski M., Zhuo Y., Wesolowski G.A., Rodan G.A., Duong le T. Characterization of articular cartilage and subchondral bone changes in the rat anterior cruciate ligament transection and meniscectomized models of osteoarthritis // Bone. — 2006. — 38. — 234-43.
2. Chunyi Wen, Weijia William Lu, Kwong Yuen Chiu. Importance of subchondral bone in the pathogenesis and management of osteoarthritis from bench to bed // Journal of Orthopaedic Translation. — 2014. — Vol. 2, Issue 1. — P. 16-25.
3. Zhang C., Li Y., Cornelia R., Swisher S., Kim H. Re-gulation of VEGF expression by HIF-1α in the femoral head cartilage following ischemia osteonecrosis // Scientific Reports. — 2012. — 2. — 650. — http://doi.org/10.1038/srep00650.
4. Carlson C.S., Meuten D.J., Richardson D.C. Ischemic necrosis of cartilage in spontaneous and experimental lesions of osteochondrosis // J. Orthop. Res. — 1991 May. — 9(3). — 317-29.
5. Lykissas M.G., Gelalis I.D., Kostas-Agnantis I.P., Vozo-nelos G., Korompilias A.V. The role of hypercoagulability in the development of osteonecrosis of the femoral head // Orthopedic Reviews. — 2012. — 4(2). — e17. — http://doi.org/10.4081/or.2012.e17
6. Тлеубаева Н.В. Патогенетические аспекты послеоперационных тромбических осложнений при деформирующем остеоартрозе: Дис... канд. мед. наук: 14.00.16 / Тлеубаева Надежда Викторовна; [Место защиты: ГОУВПО «Кемеровская государственная медицинская академія»]. — Кемерово, 2009. — 113 с.
7. Seung’Ah Y., Bo’Hyoung P., Hyung’Ju Y. et al. Calcineurin Modulates the Catabolic and Anabolic Activity of Chondrocytes and Participates in the Progression of Experimental Osteoarthritis // Arth. Rheum. — 2007. — Vol. 56, № 7. — P. 2299-2311.
8. Baragi V.M., Becher G., Bendele A. M. et al. A newclass of potent matrix metalloproteinase 13 inhibitors for potential treatment of osteoarthritis: Evidence of histologic and clinical efficacy without musculoskeletal toxicity in rat mo–dels // Arth. Rheum. — 2009. — Vol. 60, № 7. — P. 2008-2018.
9. Вишневский В.А., Малышкина С.В. Моделирование артроза путем введения дексаметазона в коленный сустав крысы // Ортоп. травмат. протезир. — 2004. — № 4. — С. 76-80.
10. Пат. 79206, Україна, МПК8 G 09 В 23/28. Спосіб моделювання остеоартрозу з синовіїтом / Коваленко В.М., Вікторов О.П., Корж М.О., Дедух Н.В., Лисенко І.В., заявник і патентовласник Інститут кардіології ім. акад. М.Д. Стражеска АМН України. — № 200510418; Заявл. 4.11.2005; Опубл. 25.05.2007; Бюл. № 7.
11. Smith G. Jr, Myers S.L., Brandt K.D. et al. Effect of intraarticular hyaluronan injection on vertical ground reaction force and progression of osteoarthritis after anterior cruciate ligament transaction // J. Rheumatol. — 2005. — Vol. 32, № 2. — P. 325-334.
12. Ozkan F.U., Ozkan K., Ramadan S., Guven Z. Chondroprotective effect of N-acetylglucosamine and hyaluronate in early stages ofosteoarthritis — an experimental study in rabbits // Bull. NYU Hosp. Jt. Dis. — 2009. — Vol. 67, № 4. — P. 352-357.
13. Batiste D.L., Kirkley A., Laverty S. et al. Exvivo characterization of articular cartilage and bone lesions in a rabbit ACL transection model of osteoarthritis using MRI and micro-CT // Osteoarth. Cartil. — 2002. — Vol. 10, № 2. — P. 145-155.
14. Tiraloche G., Girard C., Chouinard L. et al. Effect of oral glucosamine on cartilage degradation in a rabbit model of osteoarthritis // Arth. Rheum. — 2005. — Vol. 52, № 4. — P. 1118-1128.
15. Jean Y.H., Wen Z.H., Chang Y.C. et al. Intraarticular injection of the cyclooxygenase-2 inhibitor pareco-xib attenuates osteoarthritis progression in anterior cruciate ligamenttransected knee in rats: role of excitatory amino acids // Osteoarth. Cartil. — 2007. — Vol. 15, № 6. — P. 638-645.
16. Arnoldi C.C. Vascular aspects of degenerative joint disorders. A synthesis // Acta Orthop. Scand. Suppl. — 1994. — 261. — 1-82.
17. Noble B.S., Peet N., Stevens H.Y., Brabbs A., Mosley J.R., Reilly G.C., Reeve J., Skerry T.M., Lanyon L.E. Mechanical loading: biphasic osteocyte survival and targeting of osteoclasts for bone destruction in rat cortical bone // Am. J. Physiol. Cell Physiol. — 2003. — 284. — C934-43.
18. Cardoso L., Herman B.C., Verborgt O., Laudier D., Majeska R.J., Schaffler M.B. Osteocyte apoptosis controls activation of intracortical resorption in response to bone fatigue // J. Bone Miner. Res. — 2009. — 24. — 597-605.

/74-1.jpg)
/74-2.jpg)
/75-1.jpg)