Журнал «Травма» Том 19, №5, 2018
Вернуться к номеру
Експериментальне моделювання туберкульозного спондиліту
Авторы: Голка Г.Г.(1), Веснін В.В.(1), Фадєєв О.Г.(1), Олійник А.О.(1), Данищук З.Н.(2), Новохатська М.Ф.(3)
1 - Харківський національний медичний університет, м. Харків, Україна
2 - ДУ «Інститут патології хребта та суглобів ім. проф. М.І. Ситенка НАМНУ», м. Харків, Україна
3 - КЗОЗ «Обласний протитуберкульозний диспансер № 1», м. Харків, Україна
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
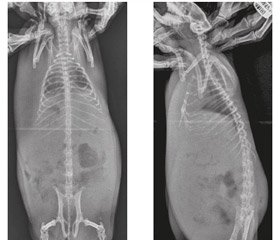
Актуальність. Туберкульозний спондиліт (ТС) в структурі кістково-суглобового туберкульозу у дорослих займає провідне місце і досягає 40–61,5 %. Метою даної публікації є висвітлення процесу моделювання туберкульозного спондиліту і його особливостей у морських свинок для подальшого використання результатів експерименту у лікувальній та науковій практиці. Матеріали та методи. Експеримент ставився на 40 статевозрілих морських свинках. Моделювання туберкульозного спондиліту проводилось на основі розробленого нами способу (патент № 112423 (UА) Україна). Усі тварини були розподілені на чотири рівні групи: 1-ша — 3-тя групи (основні) — виконувалась ін’єкція 0,5 мл суспензії М.tuberculosis (0,1 мг сухої маси в 1 мл) в тіло хребця згідно з методикою; 4-та група — контрольна. Тваринам робилась ін’єкція стерильного фізіологічного розчину (0,9% — 0,5 мл) в тіло хребця. Група 1 (10 свинок) — лікування специфічними антибактеріальними препаратами (АБП) першого ряду (ізоніазид, стрептоміцин, рифампіцин). Група 2 (10 свинок) — лікування специфічними антибактеріальними препаратами другого ряду (амікацин, рифабутин, офлоксацин). Група 3 (10 свинок) — не проводилося лікування. За всіма тваринами проводилося динамічне спостереження з клінічними, рентгенологічними, патоморфологічними і лабораторними дослідженнями. Виведення експериментальних тварин з досліду проходило за раніше розробленим графіком — при виявленні ознак досліджуваних стадій туберкульозного процесу. Всім виведеним з експерименту тваринам проводилося патоморфологічне дослідження. При цьому основна увага приділялася вивченню патоморфології уражених специфічним процесом хребців. Результати. У результаті морфологічного дослідження встановлено наявність активного туберкульозного процесу в тілах хребців і паравертебральних тканинах у тварин із модельованим туберкульозом і лікуванням специфічним АБП першого ряду, а також у тварин, які не приймали специфічного лікування. Важливо зазначити, що ступінь вираженості деструктивних змін у вражених хребцях у тварин нелікованих і тих, які приймали АБП першого ряду, практично однаковий. У тварин, яким моделювали туберкульоз і лікували специфічним АБП другого ряду, виявлено пригнічення патологічного процесу з утворенням молодої кісткової та сполучної тканини різного ступеня зрілості та наявністю зони, що відмежовує вогнище запалення від здорової тканини в ранні терміни захворювання (один місяць). В результаті виконаної роботи вдалося простежити стадійність розвитку туберкульозного спондиліту у морської свинки та сучасні особливості клінічного, рентгенологічного та патоморфологічного перебігу. Виявлена ідентичність моделі основних клінічних форм туберкульозного спондиліту у морської свинки та людини. Висновки. Дане дослідження показало, що проведення сучасної інтенсивної специфічної антибактеріальної терапії в умовах експерименту дозволяє досягти відмежування деструктивного процесу в порівняно ранні терміни розвитку захворювання (4–5 тижнів). Отримані нові знання про патоморфологічні особливості перебігу туберкульозного спондиліту дозволяють проводити радикальні оперативні втручання на хребті без ризику генералізації туберкульозного процесу в більш ранні терміни.
Актуальность. Туберкулезный спондилит (ТС) в структуре костно-суставного туберкулеза у взрослых занимает ведущее место и достигает 40–61,5 %. Целью данной публикации является освещение процесса моделирования туберкулезного спондилита и его особенностей у морских свинок для дальнейшего использования результатов эксперимента в лечебной и научной практике. Материалы и методы. Эксперимент ставился на 40 половозрелых морских свинках. Моделирование туберкулезного спондилита проводилось на основе разработанного нами способа (патент № 112423 (UА) Украина). Все животные были разделены на четыре равные группы: 1–3-я группы (основные) — проводилась инъекция 0,5 мл суспензии М.tuberculosis (0,1 мг сухой массы в 1 мл) в тело позвонка согласно методике; 4-я группа — контрольная. Животным выполнялась инъекция стерильного физиологического раствора (0,9% — 0,5 мл) в тело позвонка. Группа 1 (10 свинок) — лечение специфическими антибактериальными препаратами (АБП) первого ряда (изониазид, стрептомицин, рифампицин). Группа 2 (10 свинок) — лечение специфическими антибактериальными препаратами второго ряда (амикацин, рифабутин, офлоксацин). Группа 3 (10 свинок) — не проводилось лечение. За всеми животными проводили динамическое наблюдение с клиническими, рентгенологическими, патоморфологическими и лабораторными исследованиями. Выведение экспериментальных животных из опыта проходило по ранее разработанному графику — при выявлении признаков исследуемых стадий туберкулезного процесса. Всем выведенным из эксперимента животным проводилось патоморфологическое исследование. При этом основное внимание уделялось изучению патоморфологии пораженных специфическим процессом позвонков. Результаты. В результате морфологического исследования установлено наличие активного туберкулезного процесса в телах позвонков и паравертебральных тканях у животных с моделируемым туберкулезом и лечением специфическим АБП первого ряда, а также у животных, которые не принимали специфического лечения. Важно отметить, что степень выраженности деструктивных изменений в пораженных позвонках у нелеченных животных и принимавших АБП первого ряда, практически одинакова. У животных, которым моделировали туберкулез и лечили специфическим АБП второго ряда, выявлено угнетение патологического процесса с образованием молодой костной и соединительной ткани различной степени зрелости и наличием зоны, отделяющей очаг воспаления от здоровой ткани в ранние сроки заболевания (один месяц). В результате проделанной работы удалось проследить стадийность развития туберкулезного спондилита у морской свинки и современные особенности клинического, рентгенологического и патоморфологического течения. Обнаружена идентичность модели основных клинических форм туберкулезного спондилита у морской свинки и человека. Выводы. Данное исследование показало, что проведение современной интенсивной специфической антибактериальной терапии в условиях эксперимента позволяет достичь отграничения деструктивного процесса в сравнительно ранние сроки развития заболевания (4–5 недель). Полученные новые знания о патоморфологических особенностях течения туберкулезного спондилита позволяют проводить радикальные оперативные вмешательства на позвоночнике без риска генерализации туберкулезного процесса в более ранние сроки.
Background. Tuberculous spondylitis (TS) in the structure of bone and articular tuberculosis in adults is in a leading position and reaches 40–61.5 %. The purpose of this publication is to consider the process of tuberculous spondylitis modeling and its features in guinea pigs for further use of experiment results in medical and scientific practice. Materials and methods. The experiment was conducted on 40 mature guinea pigs. Modeling of tuberculous spondylitis was conducted on the basis of the method developed by us (Patent No. 112423 (UA) Ukraine). All animals were divided into 4 groups. In groups 1, 2, 3 (main ones), M.tuberculosis suspension at a dose of 0.5 ml (0.1 mg of dry weight in 1 ml) was injected into the vertebral body according to the procedure. Group 4 is control one. Animals were injected with a sterile physiological solution (0.9% — 0.5 ml) into the vertebral body. In group 1 (10 pigs), the treatment was carried out with first-line specific antibacterial drugs (ABD) (isoniazid, streptomycin, rifampicin), in group 2 (10 pigs) — using second-line specific ABD (amikacin, rifabutin, ofloxacin), in group 3 (10 pigs), no treatment was performed. A dynamic observation with clinical, X-ray, pathomorphological and laboratory tests was conducted in all animals. Sacrificing experimental animals was carried out according to the previously developed schedule — when identifying the signs of studied stages of the tuberculous process. A pathomorphological examination was conducted in all sacrificed animals. The main attention was paid to the pathomorphological study of vertebrae affected by a specific process. Results. The morphological study showed the presence of an active tuberculous process in vertebral bodies and paravertebral tissues in animals with simulated tuberculosis and treatment with a specific first-line ABD as well as in animals without a specific treatment. It is important to note that the degree of destructive changes severity in the affected vertebrae in untreated animals and those who received first-line ABDs are nearly the same. In animals that had modeled tuberculosis and were treated with a specific second-line ABD, the inhibition of the pathological process with the formation of young bone and connective tissue of varying degrees of maturity and the presence of a zone separating the inflammatory focus from healthy tissue at the early stages of the disease (one month) were revealed. As a result of the performed work it was possible to trace the stages of tuberculous spondylitis in guinea pigs and the modern features of clinical, radiological and pathomorphological course. The identity of the model of the main clinical forms of tuberculous spondylitis in guinea pig and human is revealed. Conclusions. This study showed that modern intensive specific antibiotic therapy in experiment allows achieving a delimitation of the destructive process in relatively early stages of the disease (4–5 weeks). The newly received knowledge about the pathomorphological features of tuberculous spondylitis course allows performing radical surgical intervention on the spine without the risk of tuberculous process generalization at earlier stages.
експериментальне моделювання; туберкульозний спондиліт; лікування
экспериментальное моделирование; туберкулезный спондилит; лечение
experimental modeling; tuberculous spondylitis; treatment

/67-1.jpg)
/67-2.jpg)
/67-3.jpg)
/68-1.jpg)
/68-2.jpg)