Украинский журнал хирургии 1 (36) 2018
Вибір трансплантату правої частки печінки від живого родинного донора
Авторы: Котенко О.Г., Мініч А.А., Гриненко О.В., Попов О.О., Гусєв А.В., Григорян М.С., Федоров Д.О., Єднак В.І.
Національний інститут хірургії та трансплантології ім. О.О. Шалімова НАМН України, м. Київ, Україна
Рубрики: Хирургия
Разделы: Клинические исследования
Резюме
Мета. Визначення ключових критеріїв при виборі трансплантату правої частки печінки адекватної функціональної маси. Матеріали та методи. На підставі розробленого нами алгоритму, що включав аналіз варіаційної анатомії печінкових вен донора з визначенням типу домінуючої вени, здійснено підбір трансплантатів для 75 реципієнтів: 37 пацієнтам (1-ша група) було трансплантовано праву частку печінки з серединною веною і 38 пацієнтам (2-га група) — праву частку без серединної вени. Для порівняльного аналізу використовували дані біохімічних показників крові обох груп протягом першого тижня та на 10, 14, 21, 30-ту добу після трансплантації. Результати. Використовуючи описаний алгоритм вибору трансплантату, ми отримали такі результати: пікові значення аланінамінотрансферази, аспартатамінотранферази і рівня загального білірубіну були дещо вищими в 2-й групі (384,43; 399,77 і 206,70 відповідно) в порівнянні з 1-ю групою (212,64; 285,57; 203,18 відповідно). Не було виявлено ніякої суттєвої різниці між рівнями гаммаглютамілтранспептидази, лужної фосфатази, протромбінового часу, міжнародного нормалізованого співвідношення. Висновки. При домінуючому типі серединної печінкової вени в трансплантатах правої частки необхідно проводити забір правої частки печінки з серединною веною. У разі, якщо домінуючою є права вена — правої частки печінки без включення до неї серединної вени. Адекватний венозний відтік при достатньому об’ємі трансплантату правої частки печінки визначає функціональну масу трансплантату.
Цель. Определение ключевых критериев при выборе трансплантата правой доли печени адекватной функциональной массы. Материалы и методы. На основе разработанного нами алгоритма, включавшего анализ вариационной анатомии печеночных вен донора с определением типа доминирующей вены, сделан отбор трансплантатов для 75 реципиентов: 37 пациентам (1-я группа) была трансплантирована правая доля печени с срединной веной и 38 пациентам (2-я группа) — правая доля без срединной вены. Для сравнительного анализа использовали данные биохимических показателей крови обеих групп в течение первой недели и на 10, 14, 21, 30-е сутки после трансплантации. Результаты. Используя описанный алгоритм выбора трансплантата, мы получили следующие результаты: пиковые значения аланинаминотрансферазы, аспартатаминотрансферазы и уровня общего билирубина были более высокими во 2-й группе (384,43; 399,77 и 206,70 соответственно) в сравнении с 1-й группой (212,64; 285,57; 203,18 соответственно). Не было выявлено никакой существенной разницы между уровнями гаммаглутамилтранспептидазы, щелочной фосфатазы, протромбинового времени, международного нормализованного соотношения. Выводы. При доминирующем типе срединной печеночной вены в трансплантатах правой доли необходимо проводить забор правой доли печени с срединной веной. В случае если доминирующей является правая вена — правой доли печени без включения в нее срединной вены. Адекватный венозный отток при достаточном объеме трансплантата правой доли печени определяет функциональную массу трансплантата.
Background. Objective: to determine the key criteria for selecting the right lobe liver graft of an adequate functional mass. Materials and methods. Based on the algorithm developed by us, which included the analysis of the variation anatomy of the donor liver veins with determination of the dominant vein type, transplants were selected for 75 recipients: 37 patients (group 1) received the right liver lobe with median vein, and 38 persons (group 2) — the right lobe without median vein. For comparative analysis, data of biochemical blood parameters from both groups were used during the first week and on 10, 14, 21, 30 days after transplantation. Results. Using the described algorithm for graft selection, we obtained the following results: peak values of alanine aminotransferase, aspartate aminotransferase and total bilirubin levels were slightly higher in group 2 (384.43; 399.77 and 206.70, respectively), compared with group 1 (212.64; 285.57; 203.18, respectively). There was no significant difference between the level of gamma-glutamyltransferase, alkaline phosphatase, prothrombin time and international normalized ratio. Conclusions. With the dominant type of the median hepatic vein in the right lobe grafts, it is necessary to take the right hepatic lobe with median vein. In case when the right vein is the dominant one — of the right hepatic lobe without median vein. An adequate venous outflow, with sufficient volume of the right hepatic graft, determines the functional mass of the graft.
Ключевые слова
печінка; трансплантат; венозний відтік; функціональна маса
печень; трансплантат; венозный отток; функциональная масса
liver; graft; venous outflow; functional mass
Вступ
Хронічні захворювання печінки і цироз є важливими причинами захворюваності та смертності в усьому світі [1]. Трансплантація печінки — єдиний спосіб лікування термінальних стадій захворювання печінки [2]. В умовах обмеженої кількості трупних трансплантатів значного поширення набула трансплантація частини печінки від живого донора [3]. Для дорослих реципієнтів трансплантат правої частки забезпечує метаболічні потреби і запобігає розвитку синдрому малого печінкового трансплантату в післяопераційному періоді [4]. Існує декілька варіантів реконструкції венозного відтоку в таких типах трансплантатів. Більшість світових трансплантаційних центрів віддають перевагу забору правої частки без серединної печінкової вени, розраховуючи на венозний відтік від передньої секції печінки через домінуючу праву печінкову вену. Лише одиничні центри, такі як Kyoto University Hospital (K. Tanaka) і University of Hong Kong Medical Centre (S.T. Fan) [5], як графт використовують трансплантат правої частки, і трансплантація таких типів графтів є технічно складнішою і більш дорогою, що вимагає багатого досвіду і кваліфікації персоналу, проте забезпечує оптимальний венозний дренаж шляхом анастомозування правої і серединної вен трансплантату з нативними печінковими венами реципієнта. Деякі центри (Asan Medical Center) [6] реконструюють венозний відтік від правої частки шляхом формування серединної печінкової вени за допомогою аутовенозної вставки або кріотрансплантату, але даний підхід пов’язаний з частим тромбуванням вставок у ранньому післяопераційному періоді.
Хоча всі ці варіанти реконструкції успішно використовуються в практиці, вибір оптимальної тактики в кожному окремому випадку індивідуальний і залежить від маси тіла донора/реципієнта, об’єму трансплантату/печінкового залишку, а також особливостей судинної анатомії. В даному дослідженні ми ставимо на меті проаналізувати результати трансплантації графтів із різними варіантами венозної реконструкції і визначити оптимальний алгоритм підбору трансплантату.
Матеріали та методи
Ми проаналізували результати 75 трансплантацій правої частки печінки від живого родинного донора в період 2003–2016 рр. (Національний інститут хірургії і трансплантології ім. О.О. Шалімова). В 37 випадках трансплантатом була права частка печінки з серединною печінковою веною (1-ша група), в 38 — права частка без серединної вени (2-га група). Донорство залежно від родинних зв’язків показано у таблиці 1. Показаннями до трансплантації були етіологічні чинники, що деталізовані в таблиці 2.
/6-1.jpg)
/7-1.jpg)
Обстеження донора. За законодавством України, взяття гомотрансплантату у живого донора допускається у випадках, коли донор і реципієнт перебувають у шлюбі або є близькими родичами (батько, мати, син, дочка, дід, баба, онук, онука, брат, сестра, дядько, тітка, племінник, племінниця). Потенційними донорами вважались ті, що мали ідентичну або сумісну групу крові, та родинні зв’язки яких було підтверджено документально. Лише після цього вони обстежувались згідно зі стандартним протоколом, що включав оцінку антропометричних параметрів (маса тіла, зріст, індекс маси тіла), лабораторну діагностику (загальноклінічні, біохімічні аналізи), вірусологічний скринінг, аналіз на TORCH-інфекцію, аналізи на імунологічну сумісність (HLA-типування і cross-match-тест), допплерографічну ультрасонографію (для оцінки якості паренхіми печінки і прохідності магістральних судин), спіральну комп’ютерну томографію з венозним підсиленням (для оцінки судинної анатомії) і магнітно-резонансну холангіопанкреатографію (для визначення біліарної анатомії). Волюметрія майбутнього трансплантату (правої частки печінки) і залишкового об’єму була оцінена на основі зрізів спіральної комп’ютерної томографії (СКТ). Донорам, в яких, за результатами томографії, були підозри на стеатоз або іншу патологію паренхіми, здійснювали біопсію печінки. Ступінь стеатозу визначався як відсоток мікро- і макровезикулярної жирової інфільтрації за даними біопсії. Всім донорам правої частки печінки інтраопераційно двічі проводилась холангіографія: до і після пересічення жовчовивідних шляхів.
Підбір трансплантату правої частки. Існуючий алгоритм передбачав аналіз співвідношення маси тіла донора і реципієнта (mдонора/mреципієнта) і доопераційну оцінку об’єму майбутнього трансплантату — правої частки печінки на основі КТ волюметрії, який було розділено на стандартний об’єм печінки реципієнта (standard liver volume — SLV) [7], підрахований за формулою Urata [8]. Цей підхід, широко описаний в літературі, зображено на рисунку 2 [9]. Наша тактика у виборі трансплантату правої частки базується на оцінці судинної анатомії печінкових вен (тип домінуючої вени) і особливостях серединної печінкової вени (розмір і кількість сегментарних притоків). Це унікальний підхід, тому що ключовим критерієм при виборі є адекватність венозного відтоку від графту як основного чинника, що визначає функціональну активність майбутнього трансплантату. Рішення щодо забору правої частки з сере–динною веною або без неї приймалось на підставі розробленого нами алгоритму, який зображений на рисунку 3.
/8-2.jpg)
/8-1.jpg)
Рішення приймалось з урахуванням анатомії печінкових вен потенційного трансплантату. Якщо притоки від сегментів 5 і 8 були менше 5 мм, а права печінкова вена була домінуючою, в такому випадку надавали перевагу забору правої частки без серединної вени. Проте, якщо права печінкова вена була не вираженою, а притоки до серединної вени від передньої секції печінки були в діаметрі понад 5 мм, при «домінуючому типі» МHV — правій частці з сере–динною веною. У разі якщо венозний відтік від правої частки відбувався рівномірно через серединну і праву печінкову вени, ми віддавали перевагу забору трансплантату правої частки з включенням MHV.
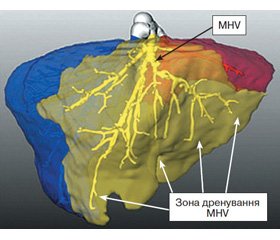
Тип домінуючої вени визначався на підставі даних СКТ із контрастним венозним підсиленням. Трансплантатами з домінуючою серединною печінковою веною вважались ті, в яких MHV дренувала понад 50 % об’єму правої частки (рис. 4). У разі, якщо права печінкова вена забезпечувала понад 50 % венозного відтоку від правої частки — трансплантатами з домінуючою правою веною (рис. 5).
Результати
Використовуючи вищеописаний алгоритм підбору трансплантату, 37 пацієнтам була виконана трансплантація печінки з серединною веною –(1-ша група) і 38 — без серединної вени (2-га група). В процесі дослідження ми порівняли інтраопераційні та постопераційні параметри в обох групах: функціональна активність трансплантатів оцінювалась на основі біохімічних аналізів крові (рівня сироваткового білірубіну, аланінамінотрансферази — АЛТ, аспартатамінотранферази — АЛТ, гаммаглютамілтранспептидази — ГГТП, лужної фосфатази — ЛФ, протромбінового часу — ПЧ, міжнародного нормалізованого співвідношення — МНС) протягом першого тижня і в періоді спостереження на 10, 14, 21 і 30-ту післяопераційну добу.
Рівень білірубіну. В обох групах спостерігалось поступове підвищення рівня сироваткового білірубіну на 1-шу добу після трансплантації з піковими значеннями 199,74 мкмоль/л і 201,39 мкмоль/л у 1-й і 2-й групах відповідно. З 2-ї по 5-ту добу рівень білірубіну більш суттєво знижувався в групі трансплантатів із серединною веною — до 125,63 мкмоль/л у порівнянні з 2-ю групою, де його середні значення були на рівні 177,93 мкмоль/л. На 5–6-ту добу в обох групах рівень сироваткового білірубіну досягав своїх максимальних значень — 203,18 мкмоль/л (1-ша група); 206,7 мкмоль/л (2-га група). В подальшому періоді спостереження рівень даного показника рівномірно знижувався в обох групах (рис. 6).
/9.jpg)
Рівень печінкових ферментів. Рівень транс–аміназ у період між 1-ю і 3-ю ПОД різко зростав в обох групах, досягаючи максимальних середніх значень: АЛТ — 212,64 ммоль/л і 384,43 ммоль/л; АСТ — 265,57 ммоль/л і 399,77 ммоль/л у 1-й і 2-й групах відповідно. Починаючи з 3–4-ї доби після трансплантації рівень даних показників поступово знижувався протягом усього періоду спостереження (рис. 7 і 8). Динаміка холестатичних ферментів суттєво не відрізнялась в обох групах, що зображено на рисунках 9 і 10.
Коагуляційна функція. Як показано на рисунку 11, значення ПЧ зростало на 2-гу і 6–7-му добу та було найнижчим на 4-ту добу після трансплантації в обох групах. У порівнянні з доопераційними даними значення МНС змінювалось не суттєво протягом усього періоду спостереження (рис. 12).
У післяопераційному періоді всі реципієнти без порушення коагуляційної функції отримували антикоагулянти згідно з протоколом. У жодного з них не розвинувся тромбоз серединної вени протягом періоду спостереження.
Обговорення
Трансплантація правої частки від живого донора з включенням серединної вени була запропонована як трансплантат адекватної функціональної маси, особливо у випадках, коли маса донора менша за масу реципієнта [10]. Незважаючи на те, що доцільність трансплантації таких типів доведена багатьма дослідженнями, деякі центри віддають перевагу забору трансплантатів правої частки без серединної вени, пояснюючи це більшою тривалістю й інтраопераційною крововтратою у донорів [11]. Проте після трансплантації таких типів графтів, унаслідок порушення венозного відтоку і конгестії передньої секції печінки, можуть спостерігатись різноманітні ускладнення, особливо у віддаленому післяопераційному періоді [12]. –Запропоновані методики реконструкції вен відтоку передньої секції печінки з використанням аутовенозних вставок здавалось би логічним рішенням [13]. Але реконструкція відтоку в такий спосіб значно подовжує час оперативного втручання. Окрім того, відносно довга протяжність аутовенозного графту в системі кровотоку з низьким тиском (системі НПВ) може стати причиною тромбозу, особливо в довготривалій перспективі [14]. Якщо зважати на важливість венозного дренажу передньої секції печінки, то реконструкція відтоку з використанням трансплантатів правої частки з серединною веною є більш простим рішенням, яке, якщо і не повністю виключає, то точно зменшує ризик тромбування [9]. З іншого боку, якщо функціональна маса трансплантату є достатньою без серединної вени, то деякий ступінь конгестії може бути не критичним у ранньому післяопераційному періоді, допоки графт не регенерує і не відбудеться перебудова його венозного відтоку [15]. Деякі дослідження демонструють, що облітеровані притоки до серединної вени з часом реканалізуються і венозний відтік від передньої печінкової секції відбувається через праву печінкову вену [16]. У нашому дослідженні у ряді хворих 2-ї групи розвивалась конгестія правої передньої секції печінки, що минала за 2–3 тижні, коли маса трансплантату збільшилась і розвинулись венозні колатералі. Отже, більш високе співвідношення об’єму трансплантату донора до стандартного розрахункового об’єму реципієнта для графтів без серединної вени забезпечує краще адекватне функціонування і відновлення трансплантату.
Якщо об’єм трансплантату є достатнім з середин–ною веною або без неї, наше рішення в підборі трансплантату базується на анатомічних особливостях печінкових вен донора, тому що варіаційна анатомія досить різноманітна. На нашу думку, реконструкції потребують венозні притоки сегментів 5 і 8, діаметр яких понад 5 мм, у такому випадку найкращим варіантом буде забір трансплантату правої частки з серединною печінковою веною. Реконструкція шляхом формування серединної вени аутологічною венозною вставкою оправдана лише у випадках, коли трансплантат очікувано буде малого об’єму (менше 30 % від стандартного розрахункового об’єму).
Найпростішими методиками в розрахунку адекватності трансплантату є розрахунок співвідношення маси донора та реципієнта, тому що об’єм печінки пропорційний масі тіла.
Алгоритм, запропонований нами, може бути корисним при виборі трансплантату печінки адекватної функціональної маси для будь-якого реципієнта. Рекомендований мінімум співвідношення маси трансплантату до стандартного розрахункового об’єму печінки реципієнта повинен бути на рівні 40 %.
Відновлення печінкової функції було задовільним в обох групах. При адекватному виборі трансплантату кількість і ступінь ускладнень в обох групах не відрізняється. Проте рівень сироваткового білірубіну і трансаміназ був вищим у 2-й групі в порівнянні з 1-ю групою, хоча ця різниця і не була суттєвою. Ймовірно, це пов’язано з меншим об’ємом трансплантату і перебудовою венозного відтоку в трансплантатах без серединної вени.
На заключення ми вважаємо, що вибір трансплантату правої частки повинен базуватись на критеріях адекватної функціональної маси для реципієнта при мінімальних ризиках з боку донора. Описаний у даній статті алгоритм має бути корисним при передопераційному виборі трансплантату печінки і забезпеченні виконання вищеописаних умов.
Висновки
1. При домінуючому типі серединної печінкової вени в трансплантатах правої частки необхідно виконувати забір правої частки печінки з серединною веною.
2. При домінуючому типі правої печінкової вени в трансплантатах правої частки необхідно виконувати забір правої частки печінки без включення до неї серединної вени. В даному випадку крупні венозні притоки від сегментів 5 і 8 необхідно реконструювати для забезпечення адекватного венозного відтоку від правої передньої секції печінки.
3. При рівномірному венозному відтоку від правої частки через серединну і праву печінкові вени варто виконувати забір правої частки з включенням до неї серединної вени.
4. Адекватний венозний відтік при достатньому об’ємі трансплантату правої частки печінки визначає функціональну масу трансплантату.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Living donor liver transplantation in Europe / Nadalin S., Capobianco I., Panaro F., Di Francesco F., Troisi R., Sainz-Barriga M., Muiesan P., Konigsrainer A., Testa G. // Hepatobiliary Surg. Nutr. — 2016. — Vol. 5. — P. 159-175.
2. Organ donation and transplantation in the UK-the last decade: a report from the UK national transplant registry / Johnson R.J., Bradbury L.L., Martin K., Neuberger J., Registry U.K. Transplant // Transplantation. — 2014. — Vol. 97. Suppl. 1. — P. S1-S27.
3. Living-donor liver transplantation: donor selection criteria and postoperative outcomes. A single-center experience with a 10-year follow-up / Lauterio A., Poli C., Cusumano C., Di Sandro S., Tripepi M., Mangoni I., Mihaylov P., Concone G., Giacomoni A., De Carlis L.G. // Transplant. Proc. — 2013. — Vol. 45. — P. 2680-2683.
4. Management of the middle hepatic vein in right lobe living donor liver transplantation: A meta-analysis / Yi P.S., Zhang M., Xu M.Q. // J. Huazhong Univ. Sci Technolog. Med. Sci. — 2015. — Vol. 35. — P. 600-605.
5. Adult-to-adult live-donor liver transplantation: the current status / Liu C.L., Fan S.T. // J. Hepatobiliary Pancreat. Surg. — 2006. — Vol. 13. — P. 110-116.
6. Adult-to-adult living donor liver transplantation at the Asan Medical Center, Korea / Lee S.G., Park K.M., Hwang S., Lee Y.J., Kim K.H., Ahn C.S., Choi D.L., Joo S.H., Jeon J.Y., Chu C.W., Moon D.B., Min P.C., Koh K.S., Han S.H., Park S.H., Choi G.T., Hwang K.S., Lee E.J., Chung Y.H., Lee Y.S., Lee H.J., Kim M.H., Lee S.K., Suh D.J., Kim J.J., Sung K.B. //Asian. J. Surg. — 2002. — Vol. 25. — P. 277-284.
7. Calculation of standard liver volume in Korean adults with analysis of confounding variables / Um E.H., Hwang S., Song G.W., Jung D.H., Ahn C.S., Kim K.H., Moon D.B., Park G.C., Lee S.G. // Korean J. Hepatobiliary Pancreat. Surg. — 2015. — Vol. 19. — P. 133-138.
8. Calculation of child and adult standard liver volume for liver transplantation / Urata K., Kawasaki S., Matsunami H., Hashikura Y., Ikegami T., Ishizone S., Momose Y., Komiyama A., Makuuchi M. // Hepatology. — 1995. — Vol. 21. — P. 1317-1321.
9. Use of middle hepatic vein in right lobe living donor liver transplantation / Dayangac M., Taner C.B., Balci D., Memi I., Yaprak O., Akin B., Duran C., Killi R., Ayanoglu O., Yuzer Y., Tokat Y. // Transpl. Int. — 2010. — Vol. 23. — P. 285-291.
10. Right lobe living-donor liver transplantation with or without middle hepatic vein: a meta-analysis / Zhang S., Dong Z., Zhang M., Xia Q., Liu D., Zhang J.J. // Transplant. Proc. — 2011. — Vol. 43. — P. 3773-3779.
11. Living-donor right hepatectomy with or without inclusion of middle hepatic vein: comparison of morbidity and outcome in 56 patients / Cattral M.S., Molinari M., Vollmer C.M., Jr., McGilvray I., Wei A., Walsh M., Adcock L., Marks N., Lilly L., Girgrah N., Levy G., Greig P.D., Grant D.R. // Am. J. Transplant. — 2004. — Vol. 4. — P. 751-757.
12. Background and clinical impact of tissue congestion in right-lobe living-donor liver grafts: a magnetic resonance imaging study / Yamamoto H., Maetani Y., Kiuchi T., Ito T., Kaihara S., Egawa H., Itoh K., Kamiyama Y., Tanaka K. // Transplantation. — 2003. — Vol. 76. — P. 164-169.
13. Hepatic venous reconstruction using the superficial femoral vein in a right-lobe living donor liver transplant patient with interrupted inferior vena cava / Sato K., Sekiguchi S., Kawagishi N., Akamatsu Y., Miyagi S., Yamaya H., Takeda I., Fukushima D., Sato A., Ohuchi N., Satomi S. // Pediatr. Transplant. — 2014. — Vol. 18. — P. E13-17.
14. One-step reconstruction of the right inferior hepatic veins using auto-venous grafts in living-donor liver transplantation / Ikegami T., Shirabe K., Yoshiya S., Soejima Y., Yoshizumi T., Uchiyama H., Toshima T., Motomura T., Maehara Y. // Surg. Today. — 2013. — Vol. 43. —
P. 769-776.
15. Outcome of patients undergoing right lobe living donor liver transplantation with small-for-size grafts / Chen P.X., Yan L.N., Wang W.T. // World J. Gastroenterol. — 2014. — Vol. 20. — P. 282-289.
16. Liver lobe graft side and outcomes in living-donor liver transplant with small-for-size grafts / Julka K.D., Chen C.L., Vasavada B. // Exp. Clin. Transplant. — 2014. — Vol. 12. — P. 343-350.

/6-1.jpg)
/7-1.jpg)
/8-2.jpg)
/8-1.jpg)
/9.jpg)
/10-1.jpg)
/10-2.jpg)