Журнал "Гастроэнтерология" Том 51, №3, 2017
Вернуться к номеру
Неінвазивна діагностика фіброзу печінки у хворих із неалкогольною жировою хворобою печінки
Авторы: Степанов Ю.М., Недзвецька Н.В., Ягмур В.Б., Кленіна І.А., Ошмянська Н.Ю.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
Актуальність. Неалкогольна жирова хвороба печінки (НАЖХП) — хронічна дифузна патологія печінки, що пов’язана з інсулінорезистентністю та метаболічними порушеннями, серед яких ожиріння, цукровий діабет 2 типу та дисліпідемія. НАЖХП охоплює простий стеатоз, який має доброякісний перебіг, неалкогольний стеатогепатит, що може прогресувати до цирозу та гепатоцелюлярної карциноми. Морфологічне дослідження печінки залишається золотим стандартом для оцінки ступеня стеатозу, печінкового запалення і фіброзу, однак все більший інтерес останнім часом викликають неінвазивні методи, серед яких оцінка різних індексів, заснованих на сироваткових маркерах. Мета. Оцінка показників діагностичної точності сироваткових маркерів та неінвазивних лабораторних індексів у визначенні морфологічних змін печінки у хворих на НАЖХП. Матеріали та методи. У дослідження включені 60 пацієнтів із НАЖХП, які проходили обстеження й лікування у відділенні захворювань печінки та підшлункової залози ДУ «Інститут гастроентерології НАМН України». Серед досліджених 26 (42,3 %) чоловіків та 34 (56,7 %) жінки, середнім віком (37,1 ± 12,4) та (44,3 ± 7,3) року відповідно. Усім пацієнтам була проведена черезшкірна пункційна трепан-біопсія печінки з подальшим морфологічним дослідженням пунктату; виконано визначення вмісту гіалуронової кислоти, α2-макроглобуліну, аполіпопротеїну А1, фібронектину, гаптоглобіну в сироватці крові, був проведений розрахунок неінвазивних маркерів фіброзу печінки: AAR, APRI, FIB-4. Результати. У хворих на НАЖХП встановлено високу діагностичну точність сироваткових маркерів фіброзу як при розмежуванні різних стадій фіброзу, так і при виключенні саме наявності фіброзу. Висновки. Визначення сироваткових маркерів має значення для вирішення питання про необхідність медикаментозного лікування та його тактику, а відповідність неінвазивних маркерів золотому стандарту — морфологічному дослідженню дозволяє уникати біопсії печінки як методу з потенційно можливими ускладненнями внаслідок своєї інвазивності.
Актуальность. Неалкогольная жировая болезнь печени (НАЖБП) включает в себя спектр заболеваний, связанных с инсулинорезистентностью и метаболическими нарушениями, таких как ожирение, сахарный диабет 2 типа и дислипидемия. НАЖБП охватывает простой стеатоз, который имеет доброкачественное течение, неалкогольный стеатогепатит, который может прогрессировать до цирроза и гепатоцеллюлярной карциномы. Биопсия печени остается золотым стандартом для оценки степени стеатоза, печеночного воспаления и фиброза; однако все больший интерес в последнее время вызывают неинвазивные методы исследования, среди которых оценка различных индексов, основанных на сывороточных маркерах. Цель. Оценка сывороточных маркеров и неинвазивных лабораторных индексов в определении морфологических изменений печени у больных с неалкогольной жировой болезнью печени. Материалы и методы. В исследование включены пациенты с НАЖБП, которые проходили обследование и лечение в отделении заболеваний печени и поджелудочной железы ГУ «Институт гастроэнтерологии НАМН Украины». Обследовано 60 больных с НАЖБП, среди которых 26 (42,3 %) мужчин и 34 (56,7 %) женщины, средний возраст обследованных составил (37,1 ±
± 12,4) и (44,3 ± 7,25) года соответственно. Всем пациентам были выполнены исследование в сыворотке крови гиалуроновой кислоты, α2-макроглобулина, аполипопротеина А1, фибронектина, гаптоглобина, расчет неинвазивных маркеров фиброза печени AAR, APRI, FIB-4, проведена чрескожная пункционная трепан-биопсия печени с последующим морфологическим исследованием ее тканей. Результаты. У больных НАЖБП установлена высокая диагностическая точность сывороточных маркеров фиброза как при разграничении различных стадий фиброза, так и при исключении именно наличия фиброза. Выводы. Определение сывороточных маркеров имеет значение для решения вопроса о необходимости медикаментозного лечения и его тактики, а соответствие неинвазивных маркеров золотому стандарту — морфологическому исследованию позволяет избегать биопсии печени как метода с потенциально возможными осложнениями вследствие своей инвазивности.
Background. Nonalcoholic fatty liver disease (NAFLD) includes a spectrum of diseases associated with insulin resistance and metabolic disorders, such as obesity, type 2 diabetes mellitus and dyslipidemia. NAFLD includes simple steatosis, which has a benign course, nonalcoholic steatohepatitis, which can progress to cirrhosis and hepatocellular carcinoma. Liver biopsy is the gold standard for assessing the degree of steatosis, liver inflammation and fibrosis; however, a growing interest in recent years is caused by noninvasive methods, including evaluation of various indices based on serum markers. The purpose of the study was the evaluation of serum markers and noninvasive laboratory indices in identifying morphological changes in the liver of patients with nonalcoholic fatty liver disease. Materials and methods. The study included patients with NAFLD, who underwent examination and treatment in the SI “Institute of Gastroenterology of the National Academy of Medical Sciences of Ukraine”. The study involved 60 patients with NAFLD, including 26 (43 %) men and 34 (57 %) women, average age of the patients was (37.1 ± 12.4) and (44.30 ± 7.25) years, respectively. All patients had completed the study of serum hyaluronic acid, α2-macroglobulin, apolipoprotein A1, fibronectin, haptoglobin, calculation of noninvasive indices of liver fibrosis: AAR, APRI, FIB-4, percutaneous core needle liver biopsy with subsequent morphological study of tissues. Results. In patients with NAFLD, we have established a high diagnostic accuracy of serum markers of fibrosis, both in differentiation of various stages of fibrosis and the exclusion of fibrosis presence. Conclusions. Determination of serum markers is important in the choice of treatment, and the correspondence of non-invasive markers to the gold standard — morphological study allows to avoid liver biopsy as a method with potential complications due to its invasiveness.
неалкогольна жирова хвороба печінки; фіброз печінки; біопсія печінки; неінвазивні методи діагностики
неалкогольная жировая болезнь печени; фиброз печени; биопсия печени; неинвазивные методы диагностики
nonalcoholic fatty liver disease; liver fibrosis; liver biopsy; noninvasive diagnostic methods
Вступ
Матеріали та методи
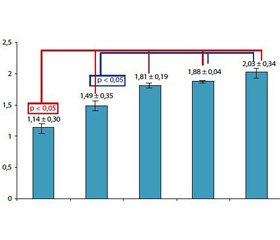
Результати
Обговорення
Висновки
- Bellentani S, Saccoccio G, Masutti F, et al. Prevalence of and risk factors for hepatic steatosis in Northern Italy. Ann Intern Med. 2000 Jan 18;132(2):112-7. PMID: 10644271.
- Powell EE, Jonsson JR, Clouston AD. Dangerous liaisons: the metabolic syndrome and nonalcoholic fatty liver disease. Ann Intern Med. 2005 Nov 15;143(10):753-4. PMID: 16287799.
- Vernon G, Baranova A, Younossi ZM. Systematic review: the epidemiology and natural history of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in adults. Aliment Pharmacol Ther. 2011 Aug;34(3):274-85. doi: 10.1111/j.1365-2036.2011.04724.x.
- Turola E, Petta S, Vanni E, et al. Ovarian senescence increases liver fibrosis in humans and zebrafish with steatosis. Dis Model Mech. 2015 Sep 1;8(9):1037-46. doi: 10.1242/dmm.019950.
- Younossi ZM, Koenig AB, Abdelatif D, Fazel Y, Henry L, WymerM. Global epidemiology of nonalcoholic fatty liver disease. Meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology. 2016 Jul;64(1):73-84. doi: 10.1002/hep.28431.
- Marchesini G, Mazzotti A. NAFLD incidence and remission: only a matter of weight gain and weight loss? J Hepatol. 2015 Jan;62(1):15-7. doi: 10.1016/j.jhep.2014.10.023.
- Bruno S, Maisonneuve P, Castellana P, et al. Incidence and risk factors for non-alcoholic steatohepatitis: prospective study of 5408 women enrolled in Italian tamoxifen chemoprevention trial. BMJ. 2005 Apr 23;330(7497):932. doi: 10.1136/bmj.38391.663287.E0.
- Lonardo A, Trande P. Are there any sex differences in fattyliver? A study of glucose metabolism and body fat distribution. J Gastroenterol Hepatol. 2000 Jul;15(7):775-82. PMID: 10937684.
- Carter-Kent C, Zein NN, Feldstein AE. Cytokines in the pathogenesis of fatty liver and disease progression to steatohepatitis: implications for treatment. Am J Gastroenterol. 2008 Apr;103(4):1036-42. doi: 10.1111/j.1572-0241.2007.01709.x.
- Marchesini G, Brizi M, Morselli-Labate AM, et al. Association of nonalcoholic fatty liver disease with insulin resistance. Am J Med. 1999 Nov;107(5):450-5. PMID: 10569299.
- Younossi ZM. Review article: current management of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis. Aliment Pharmacol Ther. 2008 Jul;28(1):2-12. doi: 10.1111/j.1365-2036.2008.03710.x.
- Tarantino G. Should nonalcoholic fatty liver disease be regarded as a hepatic illness only? World J Gastroenterol. 2007 Sep 21;13(35): 4669-72. doi: 10.3748/wjg.v13.i35.4669.
- Sanyal AJ. AGA technical review on nonalcoholic fatty liver disease. Gastroenterology. 2002 Nov;123(5):1705-25. PMID: 12404245.
- Edmison J, McCullough AJ. Pathogenesis of non-alcoholic steatohepatitis: human data. Clin Liver Dis. 2007 Feb;11(1):75-104, ix. doi: 10.1016/j.cld.2007.02.011.
- Tilg H, Diehl AM. Cytokines in alcoholic and nonalcoholic steatohepatitis. N Engl J Med. 2000 Nov 16;343(20):1467-76. doi: 10.1056/NEJM200011163432007.
- Abenavoli L, Peta V. Role of adipokines and cytokines in non-alcoholic fatty liver disease. Rev Recent Clin Trials. 2014;9(3):134-40. PMID: 25514909.
- Sanyal AJ, American Gastroenterological Association. AGA technical review on nonalcoholic fatty liver disease. Gastroenterology. 2002 Nov;123(5):1705-25. PMID: 12404245.
- Ryan CK, Johnson LA, Germin BI, Marcos A. One hundred consecutive hepatic biopsies in the workup of living donors for right lobe liver transplantation. Liver Transpl. 2002 Dec;8(12):1114-22. doi: 10.1053/jlts.2002.36740.
- Rifai K, Cornberg J, Mederacke I, et al. Clinical feasibility of liver elastography by acoustic radiation force impulse imaging (ARFI). Dig Liver Dis. 2011 Jun;43(6):491-7. doi: 10.1016/j.dld.2011.02.011.
- Lewis JR, Mohanty SR. Nonalcoholic fatty liver disease: a review and update. Dig Dis Sci. 2010 Mar;55(3):560-78. doi: 10.1007/s10620-009-1081-0.
- Bril F, Barb D, Portillo-Sanchez P, et al. Metabolic and histological implications of intrahepatic triglyceride content in nonalcoholic fatty liver disease. Hepatology. 2017 Apr;65(4):1132-44. doi: 10.1002/hep.28985.
- Di Martino M, Pacifico L, Bezzi M, et al. Comparison of magnetic resonance spectroscopy, proton density fat fraction and histological analysis in the quantification of liver steatosis in children and adolescents. World J Gastroenterol. 2016 Oct 21;22(39):8812-9. doi: 10.3748/wjg.v22.i39.8812.
- Shukla A, Kapileswar S, Gogtay N, et al. Simple biochemical parameters and a novel score correlate with absence of fibrosis in patients with nonalcoholic fatty liver disease. Indian J Gastroenterol. 2015 Jul;34(4):281-5. doi: 10.1007/s12664-015-0580-5.
- Rossi E, Adams LA, Ching HL, Bulsara M, MacQuillan GC, Jeffrey GP. High biological variation of serum hyaluronic acid and Hepascore, a biochemical marker model for the prediction of liver fibrosis. Clin Chem Lab Med. 2013 May;51(5):1107-14. doi: 10.1515/cclm-2012-0584.
- European Association for the Study of the Liver (EASL), European Association for the Study of Diabetes (EASD), European Association for the Study of Obesity (EASO). EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol. 2016 Jun;64(6):1388-402. doi: 10.1016/j.jhep.2015.11.004.
- Oh MK, Winn J, Poordad F. Review article: diagnosis and treatment of non-alcoholic fatty liver disease. Aliment Pharmacol Ther. 2008 Sep 1;28(5):503-22. doi: 10.1111/j.1365-2036.2008.03752.x.
- Adams LA, Angulo P. Role of liver biopsy and serum markers of liver fibrosis in non-alcoholic fatty liver disease. Clin Liver Dis. 2007 Feb;11(1):25-35, viii. doi: 10.1016/j.cld.2007.02.004.
- Fracanzani AL, Valenti L, Bugianesi E, et al. Risk of severe liver disease in nonalcoholic fatty liver disease with normal aminotransferase levels: a role for insulin resistance and diabetes. Hepatology. 2008 Sep;48(3):792-8. doi: 10.1002/hep.22429.
- Chalasani N, Younossi Z, Lavine JE, et al. The diagnosis and management of non-alcoholic fatty liver disease: Practice guideline by the American association for the study of liver diseases, American college of gastroenterology, and the American gastroenterological association. Hepatology. 2012 Jun;55(6):2005-23. doi: 10.1002/hep.25762.
- Tiniakos DG, Vos MB, Brunt EM. Nonalcoholic fatty liver disease: pathology and pathogenesis. Annu Rev Pathol. 2010;5:145-71. doi: 10.1146/annurev-pathol-121808-102132.
- Brunt EM. Pathology of nonalcoholic fatty liver disease. Nat Rev Gastroenterol Hepatol. 2010 Apr;7(4):195-203. doi: 10.1038/nrgastro.2010.21.
- Younossi ZM, Stepanova M, Rafiq N, et al. Pathologic criteria for nonalcoholic steatohepatitis: inter protocol agreement and ability to predict liver-related mortality. Hepatology. 2011 Jun;53(6):1874-82. doi: 10.1002/hep.24268.
- Brunt EM, Janney CG, Di Bisceglie AM, Neuschwander-Tetri BA, Bacon BR. Nonalcoholic steatohepatitis: a proposal for grading and staging the histological lesions. Am J Gastroenterol. 1999 Sep;94(9):2467-74. doi: 10.1111/j.1572-0241.1999.01377.x.
- Kruger FC, Daniels CR, Kidd M, et al. APRI: a simple bedside marker for advanced fibrosis that can avoid liver biopsy in patients with NAFLD/NASH. S Afr Med J. 2011 Jun 27;101(7):477-80. PMID: 21920102.
- Li Q, Lu C, Li W, Huang Y, Chen L. The gamma-glutamyl transpeptidase to platelet ratio for non-invasive assessment of liver fibrosis in patients with chronic hepatitis B and non-alcoholic fatty liver disease. Oncotarget. 2017 Apr 25;8(17):28641-9. doi: 10.18632/oncotarget.16162.
- Shukla A, Kapileswar S, Gogtay N, et al. Simple biochemical parameters and a novel score correlate with absence of fibrosis in patients with nonalcoholic fatty liver disease. Indian J Gastroenterol. 2015 Jul;34(4):281-5. doi: 10.1007/s12664-015-0580-5.
- Sakugawa H, Nakayoshi T, Kobashigawa K, et al. Clinical usefulness of biochemical markers of liver fibrosis in patients with nonalcoholic fatty liver disease. World J Gastroenterol. 2005 Jan 14; 11(2): 255-9. doi: 10.3748/wjg.v11.i2.255.
- Kaneda H, Hashimoto E, Yatsuji S, Tokushige K, Shiratori K. Hyaluronic acid levels can predict severe fibrosis and platelet counts can predict cirrhosis in patients with nonalcoholic fatty liver disease. J Gastroenterol Hepatol. 2006 Sep;21(9):1459-65. doi: 10.1111/j.1440-1746.2006.04447.x.

/34-1.jpg )
/35-1.jpg )
/35-2.jpg )
/36-1.jpg )
/36-2.jpg )
/37-1.jpg )