Статтю опубліковано на с. 55-59
Остеоартроз (ОА) — гетерогенна група захворювань різної етіології зі схожими біологічними, морфологічними, клінічними проявами й наслідками, в основі яких лежить ураження всіх компонентів суглоба, перш за все хряща, а також субхондральної кістки, синовіальної оболонки, зв’язок, капсули, оточуючих суглоб м’язів [1]. ОА — найчастіша форма ураження суглобів. У США поширеність захворювання становить 12 % (близько 30 млн населення). Для порівняння: гіпертонічна хвороба — приблизно 20 млн осіб, цукровий діабет — близько 5 млн населення. В Європі та країнах із високим рівнем доходів поширеність ОА серед осіб віком 45–59 років посідає 2-ге місце після ішемічної хвороби серця та цереброваскулярних захворювань. Дані літератури свідчать, що у світі за віком поширеність ОА колінних суглобів становить 3,8 %, кульшових суглобів — 0,85 %, ці показники не зазнали змін упродовж 1990–2010 рр. ОА посідає 11-те місце у світі серед захворювань, що призводять до непрацездатності пацієнтів [9]. На сьогодні ОА — найчастіше діагностоване захворювання в загальній практиці, у майбутньому очікується зростання кількості випадків за рахунок збільшення тривалості життя пацієнтів [20]. За наявності ОА погіршується якість життя, нерідко ускладнення цього захворювання призводить до інвалідизації пацієнта.
За результатами Фремінгемського дослідження [14], ОА суглобів кисті діагностовано в 36,8 % дорослого населення, серед них симптоми відзначають лише в 26 % жінок та 13 % чоловіків. Таким чином, клінічні симптоми ОА проявляються не в усіх пацієнтів із рентгенологічними ознаками захворювання. Чинники ризику структурних змін та проявів симптоматики захворювання можуть відрізнятися, що вказує на можливу профілактику ОА у безсимптомних пацієнтів.
Незважаючи на суттєву релевантність ОА, патогенез захворювання не до кінця зрозумілий, та його продовжують вивчати. ОА — багатофакторна нозологія, до її предикторів належать вік, стать, спадкова схильність, надмірна маса тіла. Деякі науковці розглядають ОА як незалежний фактор ризику розвитку атеросклерозу та ставлять питання про можливість віднесення ОА до однієї зі складових метаболічного синдрому [7].
Клінічні прояви ОА характеризуються больовим синдромом (вираженість якого збільшується після фізичного навантаження), нетривалою ранковою скутістю. Рентгенологічні ознаки включають звуження суглобової щілини, остеофітоз, субхондральний склероз та утворення кіст.
ОА — це насамперед хвороба суглобового хряща, однак патологічний процес уражає також субхондральну кістку, зв’язки, капсулу, синовіальну мембрану та періартикулярні м’язи. Важливу роль у патогенезі відіграють запальні цитокіни, хемокіни, адипокіни, епігенетичні фактори. У спрощеному вигляді інтерлейкін-1 (ІЛ-1) та фактор некрозу пухлини (ФНП) стимулюють синтез і секрецію багатьох протеаз та металопротеїназ (ММР). ІЛ-1 синтезується мононуклеарними клітинами в запаленому суглобі, підтримується аутокринною секрецією хондроцитів [10]. До ММР, які надмірно продукуються в разі ОА, належать колагенази (ММР-1, -8, -13), агреканази (ADAM- TS4 та -TS5), стромелізин-1 (ММР-3) і желатинази (ММР-2, -9). Запальні цитокіни гальмують синтез компонентів матриксу (агрекан та колаген ІІ типу) [13]. Процес деградації хряща має непостійний характер, тобто організм намагається відновити хрящ навіть на останніх етапах захворювання. Протеолітичні процеси за наявності ОА викликають синтез хондроцитами таких факторів росту, як кістковий морфогенний протеїн-2, кістковий морфогенний протеїн-7, інсуліноподібний фактор росту 1-го типу, трансформуючий фактор росту Р (TGF) тощо, які стимулюють синтез макромолекул матриксу й пригнічують продукцію катаболічних ферментів [1]. Саме внаслідок деградації компонентів суглоба можна визначати біомаркери ОА. Однак недоліки цих маркерів, до яких належать варіабельність, перехресність із компонентами сполучної тканини інших локалізацій, слабка кореляція між маркерами крові, синовіальної рідини та сечі [15], не завжди дозволяють простежити асоціацію між концентрацією білків/продуктів їх деградації та деструкцією суглоба.
Сучасне лікування ОА спрямоване на зменшення вираженості больового синдрому та функціональних порушень. Лікарські засоби, що застосовують для лікування пацієнтів із ОА, поділяються на симптом-модифікуючі препарати (анальгетики та нестероїдні протизапальні препарати — НПЗП) та структурно-модифікуючі препарати, які здатні модифікувати структуру хряща. Останні називають також SYSADOA (symptomatic slow acting drugs for osteoarthritis). Вони не лише уповільнюють прогресування захворювання, але й активно впливають на основні прояви — запалення та больовий синдром, покращують функціональний стан, тобто мають і симптом-модифікуючий ефект. До цієї групи належить препарат Піаскледин® 300 (ASU — avocado-soybean unsaponifiables) (Laboratories Expanscience, Франція), який має доведену клінічну ефективність і потенціальні хондропротекторні властивості.
Дослідження та розробка препарату були розпочаті в 50-х роках ХХ ст. професором Henri Thiers, який продемонстрував важливу роль неомилюваних олій у медицині. Експериментально було доведене успішне лікування захворювань шкіри та хряща. Олії авокадо та сої визначені як речовини, що активують епідерміс, мукозний та колагеновий шари шкіри та кістки. Окрім цього, показані анальгезивні властивості у хворих на коксартроз та гонартроз, можливе сповільнення захворювання [12].
Дані свідчать, що поєднане застосування неомилюваних сполук олій авокадо та сої (НСАС) викликає виражене інгібування утворення цитокінів порівняно з ізольованим їх застосуванням, а ступінь інгібування залежить від співвідношення цих інгредієнтів. Інкубація препаратів із різним співвідношенням компонентів — 1 : 2 (A1S2), 2 : 1 (A2S1) та 2 : 2 (A2S2) з культурою людських хондроцитів протягом 72 год за наявності чи відсутності ІЛ-1β показала, що НСАС у пропорціях 1 : 2 та 2 : 2 викликали вірогідне зниження активності стромелізину в культурі клітин (р < 0,5) із зниженням експресії ІЛ-6 та ІЛ-8. Таким чином, НСАС частково анулюють ефект ІЛ-1 на хондроцити та руйнівну дію ІЛ-1β на хрящ [11].
Піаскледин® 300 (ASU) — оригінальний французький препарат класу SYSADOA, до складу якого входять фітостероли та жирні кислоти, які отримують унаслідок гідролізу олій авокадо та соєвих бобів методом молекулярної дистиляції у пропорції 1 : 2. Піаскледин® 300 як інгібітор ІЛ-1 проявляє опосередкований колагенолітичний ефект на хондроцити та синовіоцити. Препарат сприяє зниженню синтезу колагенази, стромелізину, ІЛ-6 та ІЛ-8, а також простагландину Е2, тобто тих біологічних речовин, що беруть активну участь у розвитку запалення при ОА.
Крім того, Піаскледин® 300 підвищує експресію TGF-β1 і -β2, а також інгібітору активатора плазміногену 1 (PAI-1). TGF синтезуються багатьма клітинами організму, включаючи хондроцити та остеобласти. Вони мають анаболічний ефект, є стимуляторами синтезу макромолекул міжклітинної речовини суглобового хряща та блокаторами їх деградації. Дія PAI-1 направлена на пригнічення продукції активатора плазміногену, який є активатором плазмінового каскаду та бере участь у пошкодженні хряща внаслідок прямого впливу — шляхом деградації протеогліканів, а також опосередковано — через стимуляцію ММР [6].
Результати багатьох досліджень in vivo підтвердили дані досліджень in vitro та показали, що НСАС підвищують рівень стимуляторів тканинної продукції й можуть мати хондропротекторний ефект у разі індукованого ОА. В експерименті на тваринах продемонстровано, що НСАС характеризуються превентивним впливом на розвиток посттравматичного ОА у кроликів. L. Altinen та співавтори [2] виявили, що концентрації TGF-β1 і -β2 у синовіальній рідині колінних суглобів собак вірогідно підвищувалися у групах незалежно від дозування НСАС. TGF-β1 досягав максимальних рівнів у кінці 2-го місяця та знижувався після 3-го місяця, у той час як концентрація TGF-β2 залишалася значно підвищеною в кінці 3-го місяця (рис. 1). В іншому дослідженні in vivo, проведеному на собаках з індукованим ОА колінного суглоба, собаки 1-ї групи отримували протягом 8 тиж. перорально НСАС у дозі 10 мг/кг маси тіла, 2-ї — плацебо. Результати дослідження свідчать, що лікування НСАС може зменшити розвиток ранніх пошкоджень хряща та кістки при ОА. Ефект, імовірно, проявляється шляхом зменшення синтезу індуцибельної синтази оксиду азоту (iNOS) та MMP-13, які є ключовими медіаторами структурних змін за наявності ОА. Гістологічне дослідження також підтвердило, що тяжкість ушкодження хрящової тканини в собак, які отримували НСАС, була вірогідно нижчою [5].
/57.jpg)
Доказова база ефективності та безпеки застосування Піаскледину® 300 базується на результатах плацебо-контрольованих рандомізованих клінічних досліджень (РКД) та метааналізу (2008), тобто має рівень доказовості 1А. Так, у 1997 р. F. Blotman та співавтори опублікували результати подвійного сліпого плацебо-контрольованого РКД. У дослідження були включені 164 пацієнти з коксартрозом та гонартрозом, з наявністю хронічного болю протягом 3 міс. до початку дослідження, рівнем болю за візуально-аналоговою шкалою (ВАШ) ≥ 25 мм, функціональним індексом Лекена ≥ 4. Прийом знеболювальних препаратів, а також усіх інших повільнодіючих засобів для лікування пацієнтів із ОА був заборонений протягом усього дослідження (за винятком деяких попередньо визначених випадків). Основним критерієм оцінки ефективності лікування була необхідність прийому НПЗП: в інтервалі між 60-м та 90-м днями терапії вона була вірогідно нижчою у групі Піаскледину® 300 (43,4 проти 69,7 % у групі плацебо; р < 0,001). Крім того, вірогідно нижчою у групі Піаскледину® 300 була кумулятивна доза НПЗП (р < 0,01) [4].
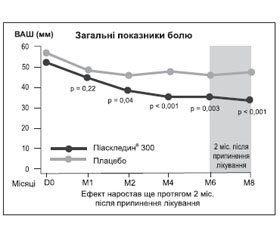
Через рік Е. Maheu та співавтори [17] опублікували результати іншого РКД тривалістю 8 міс. (6 міс. активної терапії, 2 міс. — оцінка післядії препарату). За всіма основними показниками ефективність препарату Піаскледин® 300 була вищою, ніж плацебо. Ефект відзначено з 2-го місяця прийому Піаскледину® 300. Середня вираженість болю до кінця лікування в основній групі знизилася з 56,1 ± 1,6 до 35,3 ± 2,3 мм за ВАШ; р = 0,003, а в групі порівняння — з 56,1 ± 1,8 до 45,7 ± 2,6 мм (рис. 2). Відзначено також вірогідне покращання функціонального стану суглобів і зниження індексу Лекена (–2,1 ± 0,5; р < 0,001) порівняно з групою плацебо. Потреба в НПЗП у період лікування була нижчою в основній групі та становила 48 % проти 63 % у групі плацебо (р = 0,054). На особливу увагу заслуговує проведена в цьому дослідженні оцінка потреби в НПЗП через 2 міс. після припинення застосування препарату Піаскледин® 300 і плацебо — 40,5 і 56,4 % відповідно (р < 0,05). Це дослідження підтвердило клінічно значущу перевагу Піаскледину® 300 над плацебо протягом усього періоду терапії. Таким чином, препарат зумовлює стійкий ефект навіть після закінчення курсу лікування (ще як мінімум протягом 2 міс.). Піаскледин® 300 продемонстрував симптоматичну ефективність щодо болю, функціональних індексів під час лікування ОА колінних та кульшових суглобів.
/58.jpg)
У 3-місячному багатоцентровому РКД, проведеному T. Appelboom та співавторами [3], оцінювали ефективність і безпеку застосування препарату Піаскледин® 300 у різних дозах (300 і 600 мг/добу) у 260 пацієнтів із гонартрозом. Результати дослідження свідчать, що ефективність Піаскледину® 300 в дозах 300 і 600 мг/до-бу була значно вищою, ніж плацебо, у всіх контрольних точках; різниці щодо ефективності між двома дозуваннями не спостерігалося. Крім того, у 71 % хворих, які приймали препарат Піаскледин® 300, була можливість знизити дозу НПЗП у більше ніж 2 рази, тоді як у групі плацебо такий ефект був досягнутий лише у 36 % пацієнтів.
Структурно-модифікуючий ефект препарату Піаскледин® 300 продемонстровано в роботі М. Lequesne та співавторів [16]. У цьому дворічному РКД оцінювали вплив Піаскледину® 300 на прогресування звуження суглобової щілини у 163 пацієнтів із клінічно і рентгенологічно вираженим коксартрозом. У кінці дослідження зменшення розмірів суглобової щілини визначалося в обох групах. Post hoc аналіз встановив, що застосування Піаскледину® 300 вірогідно сповільнювало прогресування звуження суглобової щілини порівняно з плацебо у підгрупі пацієнтів із вираженим звуженням суглобової щілини (рис. 3). Продемонстровано, що звуження суглобової щілини в найбільш тяжких хворих на коксартроз (початкова ширина < 2,45 мм) через 2 роки лікування було вірогідно меншим в основній групі порівняно з цим показником у групі плацебо (–0,43 і –0,86 мм відповідно; р < 0,01), що підтверджує наявність структурно-модифікуючого ефекту препарату Піаскледин® 300.
У великому дослідженні тривалістю 6 міс., у яке було включено 364 хворих на ОА колінних суглобів [21], порівнювали ефективність і безпеку препарату Піаскледин® 300 у дозі 300 мг/добу та хондроїтину сульфату у дозі 400 мг 3 рази на добу. Не виявлено статистично вірогідної різниці в ефективності між групами лікування. У понад 80 % учасників обох груп загальна ефективність препаратів оцінювалась пацієнтами на «відмінно» та «добре». Обидва лікарські засоби були безпечними та мали хорошу переносимість. Препарати показали подібні результати щодо впливу на біль та функціональний стан уражених суглобів. У середині та в кінці дослідження у хворих обох груп функціональні індекси WOMAC і Лекена знизилися приблизно на 50 %, а протягом наступних 2 міс. спостереження ці показники продовжували знижуватися, підтверджуючи наявність ефекту післядії. Зазначимо, що однократний прийом Піаскледину® 300 виявився більш зручним для всіх хворих і значно підвищував комплайєнтність терапії.
У 2013 р. Е. Maheu та співавтори [18] навели результати дослідження ERADIAS, яке ще раз продемонструвало структурно-модифікуючу дію препарату Піаскледин® 300 у 345 хворих на коксартроз. У дослідження були включені пацієнти із симптоматичним коксартрозом (болісність протягом 1 року, за індексом Lequesne — від 3 до 10 балів) та мінімальним розміром суглобової щілини 1–4 мм на рентгенограмі кульшового суглоба. Пацієнти були стратифіковані за тяжкістю коксартрозу (ширина суглобової щілини < 2,5 або > 2,5 мм) і рандомізовані на 2 групи, одна з яких (166 хворих) отримувала 300 мг Піаскледину® 300, а інша (179 хворих) — плацебо протягом 3 років. Рентгенографію уражених суглобів (пряма та коса проекції) проводили щорічно. Незважаючи на те що розміри суглобової щілини між групами вірогідно не відрізнялись (–0,638 та –0,672 мм, p = 0,72, у групах застосування препарату Піаскледин® 300 і плацебо відповідно), при лікуванні Піаскледином® 300 відзначали статистично вірогідне зменшення прогресування ОА на 20 % порівняно з групою плацебо.
Метааналіз 4 РКД НСАС охоплював 664 пацієнтів (із коксартрозом 41,4 % і гонартрозом 58,6 %), з яких 336 хворих отримували препарат Піаскледин® 300 у дозі 300 мг/добу і 328 учасників — плацебо. Середня тривалість застосування препарату становила 6 міс. Піаскледин® 300 порівняно з плацебо зумовлював більш виражений вплив на больовий синдром (середнє зменшення вираженості болю за ВАШ становило при гон-артрозі 10,7 % і при коксартрозі — 11,3 %; р = 0,04) і на функціональний індекс Лекена (р = 0,0003) (рис. 4). Кількість побічних ефектів при прийомі препарату Піаскледин® 300 у всіх дослідженнях була подібна з такою у групі плацебо [8].
/58_2.jpg)
Високу безпеку застосування Піаскледину відзначено в усіх клінічних дослідженнях, у яких не було зареєстровано будь-яких значущих побічних ефектів або випадків передозування препарату під час його тривалого прийому. Важливим аспектом безпеки є відсутність значимих лікарських взаємодій Піаскледину® 300 з відомими лікарськими засобами; особливо це важливо для застосування препарату у хворих на ОА літнього віку, які мають кілька коморбідних захворювань та отримують супутню терапію.
Піаскледин® 300 (ASU) — європейський оригінальний препарат, що має у складі унікальні інгредієнти — комплекс неомилюваних фітостеролів і жирних кислот, які діють на основні ланки порушень метаболізму хряща за наявності ОА. Піаскледин® 300 має доведену ефективність щодо зменшення вираженості симптомів ОА, сповільнює прогресування цього захворювання. Препарат застосовують понад 20 років у багатьох європейських країнах. Зокрема, у Франції він лідирує серед призначень усіх препаратів класу SYSADOA та підлягає реімбурсації з боку держави. Цей препарат внесено до рекомендацій Європейської антиревматичної ліги (EULAR) щодо лікування ОА з 2003 р., а до рекомендацій Всесвітньої організації з дослідження остеоартрозу (OARSI — OsteoArthritis Research Society International) — з 2010 р., він наявний в останніх рекомендаціях 2014 р. [19].
Особливий механізм дії Піаскледину® 300, вірогідно висока ефективність, багаторічний досвід застосування, відсутність аналогів в Україні та Європі, а також зручність прийому (1 капсула на добу) і хороша переносимість дозволяють рекомендувати цей препарат для лікування пацієнтів з ОА як ефективний засіб, що має симптом-модифікуючі та структурно-модифікуючі властивості. Для отримання максимального ефекту препарат Піаскледин® 300 застосовують протягом 3–6 міс. по 1 капсулі на добу під час прийому їжі.
Уперше опубліковано в «Українському ревматологічному журналі», 2014, № 4(58)
/58_2.jpg)

/57.jpg)
/58.jpg)