Статтю опубліковано на с. 8-10
Вступ
Гостра церебральна недостатність (ГЦН) — інтеграційний прояв критичних станів — зустрічається в усіх без винятку пацієнтів палат інтенсивної терапії і реанімації. Вона може бути зумовлена різними причинами [5].
У медичній практиці виділяють первинні (травма, інсульт, крововилив, інфекція, пухлина) та вторинні причини ГЦН. Вторинне ураження нервової системи відбувається на фоні моно- або полісистемного впливу, що призводить до гіпоксії-ішемії, токсико-метаболічної та мультифакторної енцефалопатії [2, 4, 7].
Більшість шкал, що призначені для оцінки тяжкості стану хворих із ГЦН, не враховують патогенез і наслідки вторинних ішемічних і реперфузійних ушкоджень головного мозку, відображаючи лише зміни параметрів органів і систем, що виникають при пошкодженні мозку, в основному первинному [3, 4]. Таким чином, стає очевидною необхідність підвищення об’єктивності і специфічності функціональної оцінки стану головного мозку.
Так, за даними літератури, зміни концентрації нейрон-специфічної енолази (НСЕ) і протеїну S100β в сироватці крові є прогностично значущими тільки при первинному ушкодженні головного мозку [2, 4]. Прогностичними ознаками несприятливого результату вважаються дворазове збільшення концентрацій НСЕ і протеїну S100β в сироватці крові в перші 24 години після дії причинного фактора і відсутність їх нормалізації протягом наступних 3 діб [2, 3].
Так, підвищення концентрації білка НСЕ > 12,0 мкг/л і протеїну S100β > 150 нг/мл збільшує ризик смерті за APACHE II на 26,6 і 34,2 % відповідно [3, 4].
За останні роки розроблено ряд концепцій та напрямків інтенсивної терапії ГЦН. До них можна віднести: концепцію ролі структурно-функціональних рівнів судинної системи мозку в патології; розкриття молекулярно-біологічних і патофізіологічних основ первинного захворювання, в тому числі концепцію напівтіні, феномени «розкішної» та «убогої» перфузії, феномени цитопротекторного та реперфузійного вікна [1, 5–7]. Незважаючи на розширення арсеналу нейропротекторів за рахунок нових препаратів, що здатні впливати на різні етапи розвитку ішемічного каскаду, сьогодні ще немає достатнього клінічного досвіду щодо їх ефективності.
Мета роботи: оцінити інформативність нейрон-специфічної енолази в діагностиці й лікуванні гострої церебральної недостатності.
Матеріали і методи дослідження
Проведено проспективне дослідження 35 хворих із гострою церебральною недостатністю. Хворі були рандомізовані за тяжкістю стану, віком і супутньою патологією. Контрольна група (I, n = 13) — це хворі на ішемічний інсульт, які отримували лікування згідно з клінічним протоколом МОЗ України № 602 від 03.08.2012 року. Основна група була розділена на дві підгрупи. У першу підгрупу (IIa, n = 12) увійшли хворі, яким із найгострішого періоду ішемічного інсульту інтенсивну терапію доповнювали внутрішньовенним введенням фосфатної форми холіну альфосцерату (Гліатилін) у дозі 2 г/добу. Другу підгрупу (IIb, n = 10) становили пацієнти з постгіпоксичною енцефалопатією, яким із першої доби інтенсивну терапію також доповнювали внутрішньовенним введенням фосфатної форми холіну альфосцерату (Гліатилін) у дозі 2 г/добу.
Методи дослідження: визначення нейрон-специфічної енолази, коагулограма, біохімічний аналіз крові. Оцінка стану пацієнтів проводилася за алгоритмом ABCDE і шкалою коми Глазго. Ступінь тяжкості мозкового інсульту оцінювали за шкалою тяжкості інсульту Національних інститутів здоров’я США (NIHSS). Інструментальні методи дослідження включали комп’ютерну томографію головного мозку, допплерографічне ультразвукове дослідження екстра- та інтракраніальних судин.
Критеріями церебропротекторної дії при ГЦН було обрано:
— рівень нейрон-специфічної енолази (при госпіталізації, на 3-тю і 5-ту добу);
— неврологічний стан хворих.
Статистичну обробку проводили за допомогою статистичної програми StatSoft Statistica 6.0. Для об’єктивної оцінки реальності та ступеня вірогідності результатів вимірювань різних показників у хворих програмний комплекс застосовував обчислення критерію χ2 Пірсона. Вірогідність різниць середніх показників оцінювали при 95% довірчому інтервалі (95% ДІ).
Результати та їх обговорення
Нейрон-специфічна енолаза — негліколітичний фермент, що міститься у цитоплазмі та дендритах нейронів і нейроендокринних клітин. Значне проникнення його у кров через уражені плазматичні мембрани клітин головного мозку внаслідок по-шкодження центральної нервової системи може свідчити про значні структурно-функціональні та деструктивні порушення цитомембран головного мозку [2, 4, 7].
У проведеному дослідженні було встановлено, що у хворих контрольної й основної групи вихідний рівень НСЕ був вірогідно (χ2 = 17,08; Р < 0,01) вищим порівняно з нормою, що свідчило про нейродеструктивні процеси в ішемізованому головному мозку і збігалося із тяжким станом хворих за шкалою NIHSS (тяжкість стану — 16,3 ± 2,2 бала).
У подальшому було встановлено, що в основній групі хворих (IIa) нормалізація рівня НСЕ відбувалась вірогідно (χ2 = 7,93; Р < 0,05) швидше (3-тя — 5-та доба) порівняно з хворими контрольної групи (10–12-та доба). Слід зазначити, що нормалізація рівня НСЕ збігалася з регресом неврологічного дефіциту і покращенням неврологічного статусу хворих. Час перебування хворих основної групи у відділенні інтенсивної терапії був меншим (3,8 ± 0,9 доби) порівняно з контрольною групою (5,9 ± 0,9 доби).
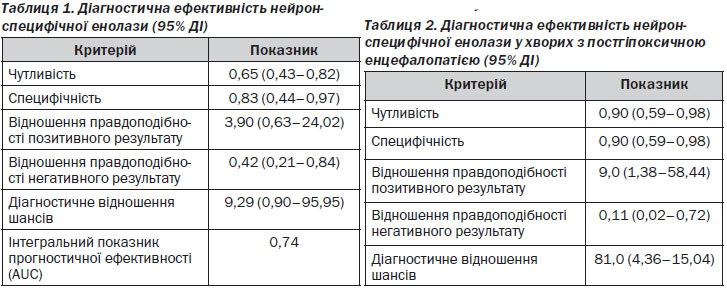
За даними табл. 1, чутливість і специфічність НСЕ як маркера пошкодження мозкової тканини у хворих на ішемічний інсульт становила відповідно 65 і 83 %.
Відношення правдоподібності позитивного результату свідчить, що ймовірність підтвердження ішемічного інсульту при наявності підвищення рівня НСЕ в 4 рази більша, ніж у пацієнтів, яким проводили комп’ютерну томографію головного мозку в першу добу.
Інтегральний показник прогностичної ефективності (AUC = 0,74) свідчить про те, що ефективність запропонованого алгоритму діагностики і лікування хворих на ішемічний інсульт була доброю. Це можна пояснити тим, що для виявлення ішемічного пошко-дження головного мозку використовували визначення рівня НСЕ, а для його лікування — холіну альфосцерат (Гліатилін).
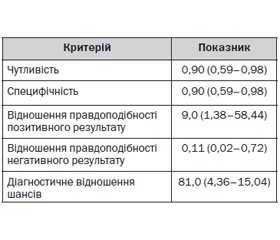
При порівнянні діагностичної значущості рівня НСЕ (табл. 2) і даних нейровізуалізації головного мозку (комп’ютерна томографія) у хворих другої підгрупи (IIb) основної групи були отримані цікаві результати.
Так, чутливість і специфічність визначення рівня НСЕ становили 90 %. Це свідчить, що цей діагностичний критерій постгіпоксичного набряку головного мозку достатньо збалансований. У дослідженні було встановлено, що в основній групі хворих (IIb) підвищення рівня НСЕ було вірогідним (χ2 = 16,36; Р = 0,0001) порівняно з нормою, що підтверджувало постгіпоксичне пошкодження головного мозку.
Відношення правдоподібності позитивного результату свідчить, що ймовірність підтвердження постгіпоксичного набряку головного мозку при наявності підвищення рівня НСЕ в 9 разів вища, ніж у пацієнтів, яким проводили комп’ютерну томографію головного мозку в першу добу. Це можна пояснити тим, що НСЕ є ефективним предиктором деструктивних порушень цитомембран головного мозку.
У хворих із постгіпоксичною енцефалопатією (IIb), які отримували з перших годин холіну альфосцерат (Гліатилін), нормалізація рівня НСЕ відбувалась також вірогідно (χ2 = 12,41; Р = 0,0004) швидше (3-тя — 4-та доба) порівняно з хворими контрольної групи (10–12-та доба). Слід зазначити, що нормалізація рівня НСЕ також збігалася з регресом неврологічного дефіциту й покращенням неврологічного статусу хворих. Хоча у двох пацієнтів другої підгрупи (IIb) інтенсивна терапія була неефективною внаслідок тяжкого постгіпоксичного пошкодження головного мозку. При цьому було зареєстровано підвищення рівня нейрон-специфічної енолази до 150–220 нг/мл в поєднанні з гіпернатріємією.
Таким чином, викладене вище дає підставу зробити такі висновки.
Висновки
1. Нейрон-специфічна енолаза є прогностичним маркером тяжкості нейродеструктивних процесів в ішемізованому головному мозку, а також ефективності церебропротекторної терапії.
2. Прогностично несприятливим у хворих із гострою церебральною недостатністю є підвищення рівня нейрон-специфічної енолази більше ніж у 3 рази. У пацієнтів із постгіпоксичною енцефалопатією підвищення рівня нейрон-специфічної енолази до 150–220 нг/мл в поєднанні з гіпернатріємією є предиктором летального кінця.
3. Холіну альфосцерат (Гліатилін) знижує нейродеструктивні процеси в ішемізованому головному мозку, що підтверджує вірогідне зниження в крові активності нейрон-специфічної енолази.
4. При підвищенні нейрон-специфічної енолази в 1,5–2 рази у хворих із постгіпоксичною енцефалопатією призначення холіну альфосцерату (Гліатилін) з першої доби вірогідно нормалізує рівень цього ферменту на 3-тю — 4-ту добу.
5. Отримані результати є підґрунтям для включення фосфатної форми холіну альфосцерату (Гліатилін) в програму інтенсивної терапії мозкового інсульту як ефективного церебропротектора.
Список литературы
1. Ваизова О.Е. Влияние нейропротекторных средств с холинопозитивным действием на уровень специфических маркеров нервной ткани при остром нарушении мозгового кровообращения / О.Е. Ваизова, Н.А. Заутнер, В.М. Алифирова, А.И. Венгеровский // Экспериментальная и клиническая фармакология. — 2012. — Т. 75, № 3. — С. 7-9.
2. Гришанова Т.Г. Клинико-патогенетическая и прогностическая значимость нейронспецифических белков при тяжелых травмах: Автореф. дис… канд. мед. наук: спец. 14.03.03 «Патологическая физиология» / Т.Г. Гришанова. — Кемерово, 2011. — 23 с.
3. Карякина Г.М. Нейронспецифическая енолаза как индикатор поражения мозговой ткани при ишемических инсультах / Г.М. Карякина, М.В. Надеждина, М.А. Хинко // Неврологический вестник. — 2007. — Т. XXXIX, вып. 1. — С. 41-44.
4. Маркеры повреждения головного мозга при тяжелой сочетанной травме / Е.В. Григорьев, Е.А. Каменева, Т.Г. Гришанова и др. // Общая реаниматология. — 2010. — № 2. — С. 71-74.
5. Стаднік С.М. Синдром гострої церебральної недостатності як концепція реаніматології / С.М. Стаднік // Ліки України. — 2011. — № 4 (150). — С. 77-80.
6. Ходаківська О.В. Церебротекторна активність нових похідних 3,2’-спіро-піроло-2-оксиндолу в умовах ішемічного інсульту (експериментальне дослідження): Автореф. дис… канд. фарм. наук: спец. 14.03.05 «Фармакологія» / О.В. Ходаківська. — Харків, 2015. — 23 с.
7. Черний В.И. Диагностика тяжести ишемического инсульта методом определения уровня маркеров повреждения центральной нервной системы / В.И. Черний, Г.А. Городник, С.Е. Куглер // Медицина неотложных состояний. — 2014. — № 3 (58). — С. 80-82.