Журнал «Актуальная инфектология» 2 (7) 2015
Вернуться к номеру
Патогенетичне обґрунтування застосування тівортіну у хворих на мультирезистентий туберкульоз легень
Авторы: Тодоріко Л.Д., Єременчук І.В. — Буковинський державний медичний університет, м. Чернівці
Рубрики: Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
У статті наведені дані щодо оптимізації патогенетичної терапії шляхом призначення тівортіну в інтенсивну фазу хіміотерапії хворим на мультирезистентний туберкульоз легень. Встановлено, що застосування тівортіну позитивно впливає на основний етіологічний процес, скорочує термін стаціонарного етапу лікування за рахунок швидкого припинення бактеріовиділення в середньому через 3,8 ± 0,7 міс. у 75 % осіб (р < 0,001).
В статье приведены данные по оптимизации патогенетической терапии путем назначения тивортина в интенсивную фазу химиотерапии больным мультирезистентным туберкулезом легких. Установлено, что применение тивортина положительно влияет на основной этиологический процесс, сокращает срок стационарного этапа лечения за счет быстрого прекращения бактериовыделения в среднем через 3,8 ± 0,7 мес. у 75 % лиц (р < 0,001).
The article presented the data on optimization of pathogenetic therapy by administration of tivortin in the intensive phase of chemotherapy in patients with multidrug-resistant tuberculosis of the lungs. It is found that the use of tivortin has a positive effect on the primary etiological process, shortens inpatient treatment by rapid cessation of bacterial excretion in an average of 3.8 ± 0.7 months in 75 % of persons (r < 0.001).
мультирезистентний туберкульоз, патогенетичне лікування, інтерлейкіни, монооксид нітрогену.
мультирезистентный туберкулез, патогенетическое лечение, интерлейкины, монооксид нитрогена.
multidrug-resistant tuberculosis, pathogenetic treatment, interleukins, nitrogen monoxide.
Статья опубликована на с. 58-62
Вступ
Ефективність призначеного етіотропного лікування у хворих на туберкульоз легень (ТБ) значною мірою залежить від вихідного стану функціонування органів і систем, які беруть участь у метаболізмі препаратів, що входять до програмної хіміотерапії (ХТ), зокрема від детоксикаційної спроможності печінки, оскільки у ній здійснюється пресистемний метаболізм та інактивація більшості антимікобактеріальних препаратів. Призначення стандартних гепатотропних засобів є обов’язковим у програмах лікування ТБ легень [6]. На сьогодні перспективним напрямком вважається використання як гепатопротекторних засобів таких препаратів, що безпосередньо беруть участь у процесах детоксикації в організмі людини і можуть виявляти комбіновані властивості гепатопротекторів-детоксикантів [2, 4, 5].
Матеріали та методи
Дизайн дослідження відповідав відкритому порівняльному рандомізованому спостереженню. У програму ХТ увійшли 34 пацієнти із мультирезистентним туберкульозом легень (МРТБ), які розподілені на дві групи: у групу 1 (контрольна) увійшли 18 пацієнтів, які лікувалися за запропонованим стандартом етіотропної ХТ із включенням гепатопротектора карсилу по 1–2 таблетки 3 рази на добу упродовж 2 місяців. До групи 2 (основна) увійшли 16 хворих на МРТБ, яким призначали донатор монооксиду нітрогену — тівортін (виробник ТОВ «Юрія-Фарм»), 4,2% розчин для інфузій по 100 мл щоденно внутрішньовенно упродовж 10 днів; після 10-денної перерви продовжили лікування ще 10 днів за попередньою схемою. Також були обстежені 20 практично здорових осіб (ПЗО).
Ефективність оптимізованої програми патогенетичної терапії із застосуванням тівортіну оцінювали в динаміці лікування за клінічною симптоматикою, окремими біохімічними показниками крові (функціональні проби печінки), цитокіновим балансом, рівнем монооксиду нітрогену, рентгенологічною картиною та терміном припинення бактеріовиділення. Моніторинг лікування хворих на МРТБ проводився відповідно до наказів МОЗ України № 1091 від 21.12.12 р., № 620 від 04.09.2014 р.
Результати та обговорення
Ефективність оптимізованої програми патогенетичної терапії в інтенсивну фазу хіміотерапії (ІФХТ) із застосуванням тівортіну оцінювали в динаміці лікування за клінічною симптоматикою. Так, синдром туберкульозної інтоксикації, що до лікування проявлявся блідістю шкірних покривів, загальною слабкістю, пітливістю, схудненням (у середньому –9,7 кг) та підвищенням температури тіла (37,4–38,9 °С), у хворих групи 2 після лікування був ліквідований у 81,8 % випадків за 1,2 ± 0,1 міс. (табл. 1), у групі 1 — у 55,6 % через 2,5 ± 0,3 міс.
Бронхолегеневий синдром, що до лікування характеризувався постійним кашлем із виділенням мокротиння, задишкою (у 53,2 %), болем у грудній клітці (у 12,8 %), підвищеною пітливістю верхньої половини тулуба (у 87,5 %), кровохарканням (у 8,2 %), був відсутній у групі 2 після лікування в 90,9 % осіб через 2,7 ± 0,3 міс., у групі 1 — у 44,4 % після більш тривалого лікування — 3,5 ± 0,5 міс. Отримані результати дослідження в основній групі вірогідно відрізняються від показників контрольної, р < 0,001.
Доведено, що застосування у схемах програмного лікування додатково тівортіну супроводжується вірогідно кращою позитивною динамікою окремих біохімічних показників крові, а саме тих, що характеризують функціональну активність печінки, зокрема рівня білірубіну, показника тимолової проби та активності сироваткових амінотрансфераз (АлАТ, АсАТ), порівняно з контрольною групою, що вказує на запобігання розвитку медикаментозного гепатиту при призначенні агресивної довготривалої ХТ у хворих на МРТБ (табл. 2).
Так, рівень загального білірубіну у групі 2 після лікування знизився на 64,1 % порівняно з таким до лікування, у групі 1 — на 52,2 % (р < 0,001 в обох випадках). Доведена вірогідна різниця показників після лікування між групами 1 та 2 (25,2 %, р1 < 0,001). Слід зазначити, що рівень білірубіну у групі 2 після лікування був практично наближений до показників ПЗО, різниця не вірогідна (р < 0,1). У групі контролю даний показник залишався підвищеним на 38,4 % порівняно з ПЗО (р2 < 0,001).
Спостерігається регресія показника тимолової проби у групі 2 після лікування на 39,5 % порівняно з таким до лікування (р < 0,001), у групі 1 — на 26,7 % (р < 0,1). Між групами 1 та 2 вірогідної різниці за цим показником після лікування не виявлено (р1 > 0,1). Проте рівень тимолової проби в основній групі практично наближений до показника ПЗО (р2 > 0,1), у групі контролю різниця за даним показником становила 36,5 % відносно норми (р2 < 0,1).
Аналіз результатів дослідження показав, що рівень АлАТ у групі 2 після лікування знижується на 34,3 % відносно такого до лікування, у групі 1 — на 29,5 % (р < 0,001 в обох випадках). Різниця між групами 1 та 2 була невірогідною (р1 > 0,1). Слід зазначити, що рівень АлАТ у групі 2 після лікування практично наближався до такого показника у ПЗО, у групі 1 рівень АлАТ залишався підвищеним на 20,9 % відносно ПЗО (р2 < 0,001 в обох випадках).
Рівень АсАТ у групі 2 після лікування знижується на 23,2 %, у групі 1 — на 12,8 % (р1 < 0,001 в обох випадках). Доведена вірогідна різниця між групами 1 та 2 у динаміці лікування, що становить 11,9 % (р1 < 0,05). Установлено, що показник рівня АсАТ в основній групі практично наближений до норми, різниця з групою контролю залишається вірогідною (на 21,4 %, р2 < 0,01).
Результати проведеного дослідження засвідчують, що включення до програми патогенетичного лікування в ІФХТ тівортіну сприяє нормалізації окремих біохімічних показників, відповідальних за функціональну активність печінки, зокрема невисока цитолітична активність ферментів АсАТ та АлАТ запобігає розвитку паренхіматозного медикаментозно-асоційованого гепатиту, що супроводжується відсутністю клінічних симптомів, характерних для гострого токсичного ураження печінки (асоційованого з вживанням піразинаміду та левофлоксацину).
Аналіз балансу системи окремих про- і протизапальних цитокінів у динаміці запропонованого лікування показав наявність тенденції до позитивного впливу тівортіну в ІФХТ на клітинну ланку імунної реактивності з обмеженням поширення специфічного запального процесу в легенях (рис. 1).
/60/60.jpg)
Так, рівень ІЛ-6 після лікування у групі 2 знизився на 55,1 % відносно такого показника до лікування (р < 0,01), однак у групі 1 зареєстрована невірогідна різниця (р1 > 0,1). При порівнянні значень основної групи із контрольною спостерігається зниження рівня ІЛ-6 на 50,5 % (р1 < 0,05). Рівень ІЛ-6 найбільш наближений до показників ПЗО у групі 2 (р2 < 0,001). Доведена відсутність різниці в рівні протизапального ІЛ-10 у групі 2 після лікування відносно такого показника до лікування, відповідно невірогідна міжгрупова різниця показника (р > 0,1, р1 > 0,1). Спостерігається приріст рівня протизапального ІЛ-10 відносно показника ПЗО у групах порівняння (р2 < 0,001). Аналіз вмісту ІЛ-18 показав, що у групі 2 відсутня різниця показників відносно такого до лікування (р > 0,1), однак у групі 1 після лікування рівень ІЛ-18 зріс на 28,5 % відносно такого показника до лікування (р < 0,01). Провівши порівняльний аналіз показників основної групи із контрольною, ми встановили, що у групах 1 і 2 після лікування наявна вірогідна різниця між досліджуваними показниками (14,8 %, р1 < 0,05). Слід зазначити, що при застосуванні у схемах патогенетичного лікування в ІФХТ тівортіну показник ІЛ-18 у групі 2 після лікування вірогідно не відрізнявся від показника ПЗО (в усіх випадках р2 > 0,1).
Результати проведеного нами дослідження показали, що баланс окремих про- та протизапальних цитокінів у хворих із МРТБ основної групи вказує на позитивний клінічний ефект застосування тівортіну в ІФХТ. Зокрема, зниження вмісту прозапального ІЛ-6 та приріст співвідношення рівнів ІЛ-10 та ІЛ-18 свідчить на користь активації імунної відповіді Тх1-типу, що направлена більшою мірою на обмеження специфічного запального процесу в рамках ураженої легені.
З огляду на те, що монооксид його нітрогену (NO) є нестабільною молекулою, вивчення здатності її продукування та забезпечення фізіологічних ефектів на організм людини проводилося за оцінкою вмісту у сироватці крові його кінцевих стабільних метаболітів (Метельская В.А. и соавт., 2005) за стандартною методикою [1, 3]. Аналіз вмісту кінцевих метаболітів NO при застосуванні тівортіну у схемі патогенетичного лікування показав, що рівень монооксиду нітрогену підвищився на 13,7 % відносно такого показника до лікування (24,76 ± 8,30 мкмоль/л), відсутня вірогідна міжгрупова різниця показників, р > 0,1. В основній групі показник NO (28,15 ± 4,70 мкмоль/л) на 38,7 % наближений до такого показника у ПЗО (45,9 ± 1,1 мкмоль/л).
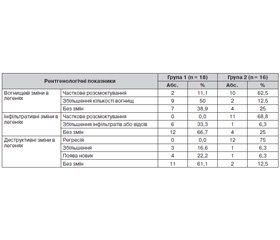
Оцінку ефективності запропонованої удосконаленої схеми патогенетичного лікування у хворих на МРТБ основної групи провели за результатами променевої діагностики через 4 міс. відповідно до уніфікованого протоколу (табл. 3). Зокрема, оцінювали динаміку вогнищевих та інфільтративних змін (розсмоктування, зменшення, збільшення, без змін) та активність динаміки деструкцій у легенях (регресія, збільшення, поява деструкцій, без змін).
Так, часткове розсмоктування вогнищевих змін у легенях у групі 2 після лікування спостерігалося у 62,5 % випадків, у групі 1 — у 11,1 %. Збільшення вогнищевих змін у групі 2 зареєстровано в 12,5 %, у групі 1 — у 50 % осіб, що в 4 рази вище за аналогічний показник основної групи. Відсутність динаміки вогнищевих змін в легенях у контрольній групі спостерігалася у 38,9 % осіб, у групі 2 — у 25 %.
Інфільтративні зміни при МРТБ характеризуються частими відсівами та схильністю до розпаду, тому часткове розсмоктування їх має вагоме клінічне значення. При застосуванні програми лікування із застосуванням тівортіну часткове розсмоктування інфільтративних змін спостерігалося у 68,8 % випадків (група 2), у контрольній групі не виявлено позитивної динаміки. Збільшення інфільтративних змін та їх відсів у інші відділи легень у групі 2 зареєстровані в 6,3 % випадків, однак у контрольній групі подальше прогресування специфічного процесу в легенях спостерігалося аж у 33,3 % осіб. У динаміці патогенетичного лікування із застосуванням тівортіну за результатами променевої діагностики через 4 міс. інфільтративні зміни у легенях залишалися без змін у контрольній групі — у 66,7 % осіб, в основній групі — у 25 % випадків.
Регресія деструктивних змін у групі 2 спостерігається у 75 %, проте в осіб контрольної групи не відмічено даної позитивної динаміки. Збільшення кількості та розмірів деструктивних змін у групі 1 відмічено у 16,6 % осіб, у групі 2 — у 6,3 % випадків. Високий відсоток появи нових деструктивних змін спостерігалося у контрольній групі — у 22,2 % випадків, у групі 2 — у 6,3 %. Відсутність рентгенологічної динаміки деструктивних змін зареєстрована в групі 1 у 61,1 % осіб, у групі 2 — у 12,5 %.
Отже, удосконалення патогенетичної терапії з включенням до програми лікування тівортіну сприяє підвищенню ефективності етіотропної хіміотерапії, що характеризується позитивною рентгенологічною динамікою: часткове розсмоктування вогнищевих змін в основній групі констатовано у 62,5 %; інфільтративних — у 68,8 %; регресія деструктивних змін — у 75 %, у контрольній групі (група 1) спостерігається незначна тенденція до позитивної динаміки рентгенологічних змін за відведений термін проведення рентгенконтролю, що регламентований уніфікованим протоколом № 620 від 04.09.14 р.
Безпосередній результат ефективності оптимізованого патогенетичного лікування з застосуванням тівортіну (в ІФХТ) оцінювали за терміном припинення бактеріовиділення, оскільки він є епідеміологічно найбільш важливим показником (табл. 4).
Результати нашого аналізу показали, що в пацієнтів групи 2 швидше припинилось бактеріовиділення — в середньому через 3,8 ± 0,7 міс. у 75 % осіб, даний показник найбільш наближений до встановленого критеріями ВООЗ — 85 %. У пацієнтів контрольної групи (група 1) припинення бактеріовиділення відбувається в середньому через 4,6 ± 1,1 міс. у 61,6 % осіб, тобто відбувається більш повільними темпами, ніж у хворих основної групи. Існує вірогідна різниця показників між термінами припинення бактеріовиділення в основній групі та групі контролю (р < 0,001).
При проведенні мікроскопічних та культуральних досліджень згідно з термінами уніфікованого протоколу в осіб контрольної групи спостерігалося стійке припинення бактеріовиділення лише у 27,8 % випадків, у 72,2 % осіб бактеріовиділення відновилося за рахунок тих, які перервали лікування, оскільки в даних осіб на фоні стандартної патогенетичної терапії спостерігався розвиток медикаментозно-індукованого ураження печінки — у 83,3 % осіб. Диспептичний синдром спостерігався у 13,3 % пацієнтів, астеновегетативний — у 20 %, гепатомегалія — у 26,7 %, комбінація синдромів спостерігалася у 40 % пацієнтів.
За результатами мікроскопічних та культуральних даних (протокол № 620 від 04.09.14 р.), в осіб основної групи в подальшому спостерігалося стійке припинення бактеріовиділення у 100 % випадків, отримані дані свідчать, що запропонована схема удосконаленого патогенетичного лікування хворих на МРТБ із застосуванням тівортіну має значний клінічний ефект. Відсоток розвитку побічних ефектів та токсичного ураження печінки під час призначення довготривалої та агресивної хіміотерапії на тлі оптимізованої програми патогенетичного лікування був суттєво меншим.
Висновки
1. Результати проведених досліджень довели, що у хворих на мультирезистентний туберкульоз легень за рахунок оптимізації патогенетичної терапії шляхом призначення тівортіну спостерігалася краща переносимість основної етіотропної терапії, відмічалися більш швидкі темпи зникнення інтоксикаційного (у 81,8 % осіб за 1,2 ± 0,1 міс.) та бронхолегеневого (у 90,9 % осіб за 2,7 ± 0,3 міс.) синдромів.
2. Установлена вірогідна позитивна динаміка окремих біохімічних показників, а саме: цитолітична активність ферментів АсАТ та АлАТ знаходилася у межах норми (43,15 ± 2,90 од/л та 37,97 ± 2,30 од/л відповідно).
3. Порівняльний аналіз вмісту окремих про- (ІЛ-6, ІЛ-18) та протизапальних (ІЛ-10) цитокінів у плазмі крові хворих на мультирезистентний туберкульоз легень із застосуванням тівортіну в ІФХТ свідчить на користь активації імунної відповіді Тх1-типу, що направлена на обмеження специфічного запального процесу в рамках ураженої легені.
4. Оптимізована патогенетична терапія з призначенням тівортіну позитивно впливає на основний етіологічний процес: часткове розсмоктування вогнищевих змін відбулося у 62,5 % осіб; інфільтративних — у 68,8 %; регресія деструктивних змін — у 75 % хворих. Спостерігалось більш швидке припинення бактеріовиділення — в середньому через 3,8 ± 0,7 міс. у 75 % осіб, що дозволило скоротити стаціонарний етап лікування.
1. Покровский В.И. Оксид азота, его физиологические и патофизиологические свойства / В.И. Покровский // Терап. арх. — 2005. — № 1. — С. 82–87.
2. Тодоріко Л.Д. Особливості еволюції імунопатогенезу лікарсько-стійкого туберкульозу / Л.Д. Тодоріко // Клінічна імунологія. Алергологія. Інфектологія. — 2014. — № 3 (cпецвипуск). — С. 16–20.
3. Ячник А.І. Фізіологічні аспекти оксиду азоту при порушеннях легеневого кровообігу та роль L-аргініну в корекції його синтезу / А.І. Ячник, М.І. Гуменюк, А.Д. Чопчик // Укр. пульмон. журн. — 2008. — № 1. — С. 40–44.
4. Elevated serum level of interleukin (IL)-18, interferon (IFN)-gamma and soluble Fas in patients with pulmonary complications in tuberculosis / S. El-Masry, M. Lotfy, W.A. Nasif et al. // Acta. Microbiol. Immunol. Hung. — 2007. — Vol. 54, № 1. — P. 65–77.
5. Sahiratmadja E. Dynamyc changes in pro- and anti-inflammatory cytokine profiles and gamma-interferon receptor signaling integrity cоrrelate with tuberculosis disease activity and response to curative treatment / E. Sahiratmadja // Infect. Immunol. — 2007. — Vol. 75, № 2. — P. 820–829.
6. Thomas A. Management of multidrug resistance tuberculosis in the field: tuberculosis research centre experience / A. Thomas // The Indian Journal of Tuberculosis. — 2007. — Vol. 54, № 3. — P. 117–124.

/59/59.jpg)
/61/61.jpg)