Журнал «Актуальная инфектология» 2 (3) 2014
Вернуться к номеру
Клінічні особливості перебігу антибіотикоасоційованої діареї при респіраторних інфекціях у дітей, значення Clostridium difficile
Авторы: Чернишова Л.І., Гільфанова А.М. — Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ
Рубрики: Инфекционные заболевания
Разделы: Клинические исследования
Версия для печати
У статті висвітлена залежність частоти розвитку антибіотикоасоційованої діареї у дітей від факторів ризику, віку, призначених антибіотиків і пробіотичних препаратів, показані клінічні особливості її перебігу у дітей при респіраторних інфекціях, з’ясовано значення Clostridium difficile в етіологічній структурі діареї, пов’язаної з прийомом антибіотиків.
В статье освещена зависимость частоты развития антибиотикоассоциированной диареи у детей от факторов риска, возраста, назначенных антибиотиков и пробиотических препаратов, показаны клинические особенности ее течения у детей при респираторных инфекциях, выяснено значение Clostridium difficile в этиологической структуре диареи, связанной с приемом антибиотиков.
The article highlighted the dependence of the incidence of antibiotic-associated diarrhea in children on risk factors, age, prescribed antibiotics and probiotic preparations; clinical features of its course in children with respiratory infections were shown, Clostridium difficile value was clarified in the etiological structure of diarrhea, associated with antibiotics intake.
антибіотикоасоційована діарея, Clostridium difficile, пробіотики, антибактеріальні препарати, діти.
антибиотикоассоциированная диарея, Clostridium difficile, пробиотики, антибактериальные препараты, дети.
antibiotic-associated diarrhea, Clostridium difficile, probiotics, antibacterial agents, children.
Статья опубликована на с. 7-11
На сьогодні практичну діяльність лікаря, особливо педіатра, неможливо уявити без щоденного призначення різних антибактеріальних препаратів. Проте при їх застосуванні часто розвиваються побічні ефекти, особливо з боку органів шлунково-кишкового тракту, серед яких найбільш серйозним і поширеним є антибіотикоасоційована діарея (ААД) [3, 6, 7, 9]. Вразливими щодо розвитку ААД є діти з гострими респіраторними інфекціями (ГРІ) з огляду на часте та не завжди обґрунтоване призначення їм антибактеріальних препаратів із метою профілактики можливих бактеріальних ускладнень.
У літературі можна знайти кілька визначень ААД (antibiotic-associated diarrhea):
— це комплекс симптомів на тлі патологічних змін складу кишкової мікрофлори, що виникає внаслідок застосування антибіотиків [6];
— випадки появи рідких випорожнень у період після початку антибактеріальної терапії, а також у 4-тижневий термін після відміни антибіотика (у тих випадках, коли виключаються інші причини розвитку діареї) [7, 9];
— три епізоди або більше неоформленого стулу протягом двох або більше днів, що виникли на тлі застосування антибактеріальних засобів [12].
ААД є поліетіологічним захворюванням, що обумовлене рядом інфекційних і неінфекційних причин. Вважається, що 10–20 % усіх випадків ААД і практично 100 % псевдомембранозного коліту викликаються C.difficile [7].
Важливо зазначити, що зміни шлунково-кишкового тракту на тлі прийому антибіотиків мають складний багатокомпонентний механізм і клінічно проявляються діареєю, больовим синдромом, здуттям живота, блюванням, а в разі етіологічної ролі C.difficile — кров’янистими випорожненнями, синдромом системної запальної відповіді, ексудативною ентеропатією, астенічними та позакишковими проявами, низкою серйозних ускладнень, що можуть призводити до летальних наслідків. Розвиток ААД погіршує перебіг основного захворювання, уповільнює реабілітацію хворих, знижує адаптаційні можливості й загальний рівень здоров’я дітей, створює додаткове економічне навантаження на сімейний бюджет хворого та систему охорони здоров’я.
Діарея залишається однією з провідних причин захворюваності та смертності. За даними Всесвітньої організації охорони здоров’я, щорічно у світі реєструється від 68,4 до 275 млн діарейних захворювань, в Україні — близько 54 тисяч [3]. У різних країнах кількість зареєстрованих випадків C.difficile-асоційованої діареї на рік становить від десятків тисяч до кількох мільйонів [5, 8]. Міжнародний клінічний досвід уже сьогодні свідчить, що ААД, викликана C.difficile, може набути характеру пандемії. Цьому сприяє циркуляція високовірулентних госпітальних токсигенних штамів C.difficile, зростання інвазивності медичних втручань, агресивна антибактеріальна терапія, особливо препаратами широкого спектра дії (цефалоспорини, фторхінолони), збільшення числа пацієнтів із факторами ризику розвитку ААД [10].
Досі залишаються недостатньо визначеними особливості епідеміології та етіологічної структури ААД у дитячій популяції, потребують подальшого вивчення клінічні аспекти ААД у дітей, внесок різних антибіотиків у виникнення цього ускладнення, ефективність профілактичного прийому пробіотичних препаратів.
Мета дослідження: встановити частоту розвитку антибіотикоасоційованої діареї у дітей із респіраторною інфекцією залежно від факторів ризику, віку, призначених антибіотиків та пробіотичних препаратів, з’ясувати значення C.difficile в етіологічній структурі ААД.
Матеріали і методи дослідження
Для досягнення поставленої мети обстежено 255 хворих дітей, які відповідали наступним критеріям включення:
— вік від 1 місяця до 18 років;
— встановлений діагноз ГРІ та її ускладнень;
— лікування в умовах стаціонару;
— призначення курсу антибіотикотерапії;
— поінформована згода на участь пацієнта в дослідженні.
Під спостереженням у різних стаціонарах Києва та Київської області знаходились 114 дівчаток (44,7 %) та 141 хлопчик (55,3 %). Середній вік становив 3 роки: найбільша кількість обстежених дітей знаходилась у вікових межах від 1 до 7 місяців (23 %) та від 12 місяців до 6 років (50,2 %). Найчастішим та найтяжчим ускладненням ГРІ у групі обстежених дітей була пневмонія (35 %).
Антибіотикотерапія курсом від 3 до 24 днів у 88,2 % випадків проводилась парентеральними формами цефалоспоринів ІІІ покоління (цефтріаксон, цефотаксим, цефтазидим), що застосовувались як монотерапія (55 %) або комбінувались з аміноглікозидами (16,9 %) чи макролідами (10,2 %). Як монотерапія амоксицилін/клавуланат призначався лише в 1,6 % випадків, азитроміцин (пероральна форма) — у 7,5 % дітей. У 4,3 % випадків хворі отримували 3 антибактеріальних препарати і більше, у тому числі і з групи резерву. За 8 тижнів до госпіталізації антибіотики отримувало 40,4 % хворих, ще 3,5 % мали масивну антибіотикотерапію в анамнезі. З першого дня перебування в стаціонарі більшість дітей (82,4 %) приймали один з пробіотичних препаратів, що містить живі активні бактерії Lactobacillus reuteri Protectis, або ліофілізовані бактерії Lactobacillus, або «живі» (неліофілізовані) форми в симбіотичній асоціації, або Bifidobacterium longum з Enterococcus faecium.
З метою виявлення клостридіальної інфекції визначали ДНК C.difficile (ген tcdB) у випорожненнях методом полімеразної ланцюгової реакції (ПЛР) та токсини А + В — методом імуноферментного аналізу (ІФА). Спостереження та забір біологічного матеріалу в цій групі хворих проводились переважно в осінньо-зимовий період (98 %) незалежно від розвитку діарейного синдрому на 4-ту — 8-му добу перебування в стаціонарі. Дослідження виконувались у лабораторії медичної мікробіології з музеєм патогенних для людини мікроорганізмів ДУ «Інститут епідеміології та інфекційних хвороб імені Л.В. Громашевського» АМН України.
За усіма хворими проводилось динамічне спостереження, результати якого фіксувались у спеціально розробленій карті, що містила паспортні дані, короткий опитувальник, клінічний діагноз, дані параклінічних досліджень і схему призначеного лікування.
Отримані в процесі дослідження клінічні та лабораторні дані були оброблені методом математичної статистики за допомогою стандартних пакетів програм Мicrosoft Excel. Визначались: середньоарифметичне (М), похибка середньоарифметичного (m), стандартне відхилення (δ). Оцінювання вірогідності розбіжностей між емпіричними частотами в окремих серіях спостережень проводилось методами, що ґрунтуються на розподілі різниці відносних частот та визначенні величини p: оцінювання значущості різниці d та критерій Пірсона χ2. Розбіжність між 2 сукупностями визначалась за допомогою критерію Стьюдента (t).
Протокол клінічного дослідження був схвалений етичним комітетом. Батьки залучених у дослідження дітей дали письмову згоду на участь дитини в дослідженні.
Результати та їх обговорення
У 34 дітей (21,6 %) розвинувся діарейний синдром. Негативні результати обстеження на бактеріальні та вірусні кишкові інфекції дозволили поставити діагноз ААД.
Частота розвитку ААД залежно від віку та статі графічно подана на рис. 1.
/tirag/8/8.jpg)
Нами була виявлена закономірність (рис. 1), згідно з якою з віком частота ААД суттєво зменшувалась як серед хлопчиків, так і серед дівчаток (р < 0,05). ААД у дівчаток розвивалась вірогідно значно рідше, ніж у хлопчиків, проте з віком ця різниця зменшувалась. Так, загальна частота ААД серед хлопчиків становила 26,2 %, у той час як серед дівчаток — 15,8 %.
Залежність частоти ААД від пори року, сезону (жовтень — березень, травень — вересень) була сумнівною (р ≈ 0,5).
Було вивчено залежність між частотою розвитку ААД та прийомом різних антибактеріальних препаратів, результати наведено в табл. 1.
До нашого дослідження увійшли діти, які переважно отримували парентеральні форми цефалоспоринів ІІІ покоління (88,2 %) у дозі 100 мг/кг/д, пероральні форми призначались у 1,6 % випадків. У дітей, які отримували терапію парентеральними формами антибіотиків (цефалоспорини ІІІ покоління як монотерапія або в комбінації з іншими препаратами), ААД розвивалась істотно частіше, ніж у дітей, які лікувались пероральними антибіотиками (макролідами, захищеними пеніцилінами, цефалоспоринами). Поєднане призначення цефалоспоринів ІІІ покоління та інших антибіотиків (азитроміцину, амікацину, метронідазолу, карбапенемів, захищених пеніцилінів) суттєво не вплинуло на розвиток діарейного синдрому порівняно з лікуванням лише цефалоспоринами. Додавання до терапії азитроміцином цефалоспоринів ІІІ покоління значно не впливало на частоту ААД.
Для профілактики ААД часто застосовують пробіотичні препарати [1, 2, 4, 11]. Для вивчення впливу прийому пробіотичних препаратів на частоту виникнення ААД проводились порівняльні дослідження в різних вікових групах дітей.
У групі дітей першого півріччя життя найчастіше призначались лебенін, ліофілізовані бактерії Lactobacillus, мультипробіотик у вигляді неліофілізованої форми та живі активні бактерії Lactobacillus reuteri Protectis (рис. 2). На рис. 3 графічно зображено частоту виникнення ААД залежно від прийому даних пробіотиків. Статистично значима різниця між частотами відсутня (р > 0,95), але деяка тенденція відмічається. Найменша частота ААД відзначалась у разі призначення ліофілізованих бактерій Lactobacillus.
/tirag/9/9.jpg)
Дітям другого півріччя життя найчастіше призначали лебенін і ліофілізовані бактерії Lactobacillus, при прийомі яких частота ААД становила відповідно 30 та 25 %. У групах дітей від 1 до 3 років та від 3 до 6 років переважно призначались йогурт, ліофілізовані бактерії Lactobacillus і лебенін. Не приймали пробіотики з профілактичною метою 19 та 29 % дітей відповідно. Прийом пробіотиків суттєво не вплинув на розвиток ААД у цих групах дітей (р ≈ 0,95).
/tirag/10/10.jpg)
Діти старше 6 років отримували ліофілізовані бактерії Lactobacillus та йогурт, 27 % дітей у комплексну терапію пробіотичні препарати не включались. Суттєвої різниці в частоті ААД залежно від факту призначення та виду пробіотика не відмічалось (р ≈ 0,95).
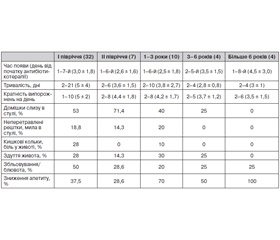
Нами було проаналізовано перебіг ААД у дітей залежно від віку (табл. 2).
Як показано в табл. 2, діарея найчастіше розвивалась у перші 3 доби антибіотикотерапії (66,7 %), час її появи не залежав від віку (t < 1; р > 0,3). Як правило (у 66,7 % випадків), діарея тривала від 2 до 4 діб у всіх вікових групах і проявлялась рясними рідкими випорожненнями від жовтого до темно-зеленого кольору, часто з домішками слизу та неперетравлених рештків. У 7 % дітей ААД мала інтермітуючий перебіг, що полягав у чергуванні рідкого й оформленого стулу. Кратність випорожнень переважно становила від 2 до 5 актів дефекації на добу, але ніколи не перевищувала 10. Її розбіжність у різних вікових групах імовірно пов’язана з випадковим характером вибірки (t = 1,43; р > 0,1). Часто супутніми симптомами при ААД були зниження апетиту, здуття живота, особливо у дітей першого півріччя життя, одно- або двократна блювота, біль в животі та кишкові кольки. У більшості дітей розвивалась гостра діарея легкого ступеня тяжкості, жодного разу не відмічався гемоколіт, а прояви ексикозу легкого та середнього ступеня тяжкості мали місце лише в 9 % дітей із діареєю.
Частота виявлення C.difficile, визначеного методом ПЛР, серед дітей із респіраторною інфекцією, які знаходились на стаціонарному лікуванні, становила 8,2 %, а у групі дітей раннього віку (від 1 місяця до 3 років) — 9,4 %. Частота виявлення C.difficile становила у хлопчиків та дівчаток відповідно 10,7 і 4,8 %, проте вона істотно не залежала від статі. Частота виявлення токсинів А + В у їх випорожненнях досягала 25 %.
Частота клінічно-маніфестних форм C.difficile серед дітей із ГРІ, які знаходились на лікуванні в стаціонарах, становила 3 %, це були хлопчики віком 1 рік і менше.
Використовуючи сучасні серологічні та молекулярно-генетичні методи для ідентифікації C.difficile, ми дослідили частоту носійства даного мікроорганізму, що становила 5,1 %, а у групі дітей раннього віку (з 1 місяця до 3 років) — 5,9 %.
Незважаючи на те, що за 8 тижнів до госпіталізації антибіотики отримували 34 % хворих, в усіх випадках мала місце гостра діарея, а C.difficile-інфекція підтверджувалась методом ПЛР лише у 4 % дітей з ААД.
Висновки
1. У кожної п’ятої дитини (21,6 %) з ГРІ та її ускладненнями, яка отримує антибіотики, спостерігається антибіотикоасоційована діарея, частота якої залежить від віку: у дітей І півріччя життя вона становила 52,5 %, ІІ півріччя життя — 19,2 %, від 1 до 3 років — 16,4 %, від 3 до 6 років — 6,6 %, у дітей старше 6 років — 9,5 %.
2. У дітей, які отримували терапію парентеральними формами антибіотиків, ААД розвивалась у 25,7 %, тоді як у дітей, які лікувались пероральними антибактеріальними препаратами (макролідами, захищеними пеніцилінами, цефалоспоринами), — 10,5 %.
3. Частота виявлення C.difficile, визначеного методом ПЛР, серед дітей із респіраторною інфекцією, які знаходились на стаціонарному лікуванні, становила 8,2 %, а у групі дітей раннього віку (від 1 місяця до 3 років) — 9,4 %, частота виявлення токсинів А + В, визначених методом ІФА, становила 2 %, токсигенних штамів C.difficile — 25 %.
4. Частота безсимптомного носійства C.difficile у дослідній групі становила 5,1 %, частота виявлення токсигенних штамів — 20 %, частота маніфестних форм C.difficile — 37,5 %.
5. У третини дітей із ГРІ, які знаходились на стаціонарному лікуванні, призначення антибіотиків можна було уникнути і таким чином зменшити ризик розвитку ААД.
Подяка співробітникам ДУ «Інститут епідеміології та інфекційних хвороб імені Л.В. Громашевського» АМН України О.І. Поліщук та Ж.Е. В’ялих за проведення лабораторних досліджень, завідувачам відділень дітей раннього віку КОДЛ № 2 П.П. Погорілому та КМДКЛ № 1 В.А. Корольовій за сприяння в проведенні клінічних досліджень.
1. Аряев Н.Л., Циунчик Ю.Г., Варбанец Д.А., Поплавская Л.Л., Кузьменко И.В. Клиническое значение пробиотиков в профилактике и лечении антибиотикоассоциированной диареи у детей // Здоровье ребенка. — 2007. — № 4(7). — С. 10–13.
2. Иванько О.Г., Пацера М.В., Радутная Е.А. Антибиотикоассоциированная диарея и Clostridium difficile-инфекция у детей Украины // Современная педиатрия. — 2008. — № 5. — С. 99–105.
3. Крамарєв С.О., Чернишова Л.І., Надрага Б.О. та ін. Сучасні підходи до лікування гострих кишкових інфекцій у дітей. Антибіотикоасоційовані діареї у дітей (Методичні рекомендації). — К., 2008. — 32 с.
4. Крамарев С.А., Янковский Д.С., Дымент Г.С. Антибиотикоассоциированные диареи у детей с инфекционными заболеваниями и возможности их профилактики // Современная педиатрия. — 2007. — № 4(17). — С. 157–161.
5. Лобзин Ю.В., Захаренко С.М., Иванов Г.А. Современные представления об инфекции Clostridium difficile // Клиническая микробиология и антимикробная химиотерапия. — 2002. — Т. 4, № 3. — С. 200–232.
6. Майданник В.Г., Хайтович М.В., Сосновська Т.Є., Кириченко І.В. Профілактика та лікування антибіотик-асоційованої діареї у дітей // Педіатрія, акушерство та гінекологія. — 2008. — № 1. — С. 63–65.
7. Марушко Ю.В., Яворовська О.П., Асонов А.О. Сучасні погляди на антибіотик-асоційовану діарею у дітей (огляд літератури) // Современная педиатрия. — 2008. — № 4(21). — С. 202–206.
8. Петрук М.Н., Нешитов С.П. Псевдомембранозный колит // Хирургия. Журнал имени Н.И. Пирогова. — 2009. — № 4. — С. 55–60.
9. Радутна О.А. Антибіотикоасоційована діарея у дітей, обумовлена Clostridium difficile // Перинатология и педиатрия. — 2008. — № 2(34). — С. 71–73.
10. Kuijper E.J., Barbut F., Brazier J.S. et al. Update of Clostridium difficile infection due to PCR ribotype 027 in Europe, 2008 // Eurosurveillance. — 2008. — Vol. 13. — P. 433–439.
11. Pramodini B. Kale-Pradhan, Harjot K. Jassal; Sheila M. Wilhelm. Role of Lactobacillus in the Prevention of Antibiotic-associated Diarrhea: A Meta-analysis // Pharmacotherapy Publications. — 2010. — № 30(2). — Р. 119–126.
12. Wistrom J., Norrby S.R., Myhre E.B., Eriksson S., Granstrom G., Lagergren L., Englund G., Nord C.E., Svenungsson B. Frequency of antibiotic–associated diarrhea in 2462 antibiotic-treated hospitalized patients: a prospective study // Journal of Antimicrobial Chemotherapy. — 2001. — Vol. 47. — 43–50.

/tirag/9/9_2.jpg)
/tirag/10/10_2.jpg)