Журнал "Гастроэнтерология" 4 (54) 2014
Вернуться к номеру
Можливості і проблеми застосування гепатопротекторів у хворих на хронічний гепатит С при супутньому автоімунному синдромі
Авторы: Господарський І.Я., Волинець К.В., Грушко В.В. - Тернопільський державний медичний університет ім. І.Я. Горбачевського
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
Проведене вивчення клініко-біохімічних показників ефективності гепатопротекторів у 32 хворих на хронічний гепатит С без ознак цирозу при супутньому автоімунному компоненті. Виявлена суттєва різниця терапевтичного впливу біофлавоноїдних гепатопротекторів та гепатопротекторів на основі орнітину на показники функції печінки та імунної системи, а також на перебіг гепатиту С.
Проведено изучение клинико-биохимических показателей эффективности гепатопротекторов у 32 больных хроническим гепатитом С без признаков цирроза при сопутствующем аутоиммунном компоненте. Выявлена существенная разница терапевтического влияния биофлавоноидных гепатопротекторов и гепатопротекторов на основе орнитина на показатели функции печени и иммунной системы, а также на течение гепатита С.
A study of clinical and biochemical parameters of hepatoprotectors efficiency in 32 patients with chronic hepatitis C without signs of cirrhosis and with concomitant autoimmune component has been carried out. A significant difference has been determined between therapeutic impact of bioflavonoid hepatoprotectors and hepatoprotectors with ornithine on indices of liver and immune system function, as well as on hepatitis C course.
хронічний гепатит С, автоімунний синдром, гепатопротектори.
хронический гепатит С, аутоиммунный синдром, гепатопротекторы.
chronic hepatitis C, autoimmune syndrome, hepatoprotectors.
Статья опубликована на с. 43-47
Вступ
За даними ВООЗ, понад 1 млрд людей у світі інфіковані вірусами гепатитів В і С [1]. Враховуючи значну поширеність і часті несприятливі наслідки цих інфекцій, проблема їх терапії є важливим завданням практичної охорони здоров’я [2, 3].
Основними засобами етіотропної терапії в таких пацієнтів залишаються препарати інтерферону [2]. Застосування загальноприйнятих схем лікування, які включають комплекс на основі пегільованого інтерферону, рибавірину і, за необхідністю, інгібітору протеази, сьогодні забезпечує феноменально високу частоту вилікування в пацієнтів із різними генотипами вірусу — до 90 % [4].
Але при підрахунку цих показників зазвичай беруться до уваги так звані ідеалізовані когорти пацієнтів, тобто такі хворі, які мають намір лікуватися (мотивованість, достатньо високий комплайєнс та рівень соціальності), а також відсутність протипоказань до лікування, передусім до терапії інтерферонами. Насправді на практиці достатньо часто трапляються пацієнти з такими протипоказаннями, насамперед з автоімунним синдромом. За даними літератури [5–7], від 20 до 40 % пацієнтів із тривалістю захворювання понад 2 роки мають лабораторні маркери автоімунізації, найчастіше — антитіла до щитоподібної залози, антинуклеарні антитіла, ревмофактор тощо. При цьому відсоток пацієнтів із лабораторними і/або клінічними проявами автоімунізації зростає пропорційно тривалості анамнезу гепатиту, досягаючи цифри 60–80 % при давності захворювання 10 років і більше. Одним із ключових патогенетичних механізмів формування автоімунізації стає змішана кріоглобулінемія. За даними різних авторів, кріоглобуліни виявляються в усіх чи практично в усіх пацієнтів із хронічним гепатитом С та автоімунним синдромом [6, 7].
Оскільки імунотропні ефекти інтерферонів суттєво підсилюють автоагресію, ряд автоімунних захворювань і станів є абсолютними або відносними протипоказаннями до противірусної терапії хронічного гепатиту С. На жаль, на сьогодні не існує єдиної стратегії ведення таких пацієнтів. Одним із варіантів є застосування глюкокортикоїдів. Проте їх призначення не забезпечує тривалого позитивного клінічного й лабораторного ефекту, має суттєві побічні ефекти (імуносупресія, підсилення реплікації вірусу С, пришвидшення прогресування патологічних змін у печінці тощо). А на тлі інтерферонотерапії глюкокортикоїди взагалі не працюють, що унеможливлює проведення чи продовження лікування інтерферонами [7].
Значні сподівання покладали на застосування інших засобів — нестероїдних протизапальних засобів, кетотифену тощо. На жаль, ці препарати не справляли достатнього лікувального впливу. Дещо перспективнішим виявилося застосування гормонів щитоподібної залози, але вони чинили певний лікувальний ефект лише на процеси автоімунізації до щитоподібної залози [6].
Часто лікарі вибирають вичікувальну тактику, але такий підхід не забезпечує зниження рівня автоімунізації й не впливає на процес прогресування фібротичних явищ у печінці. Саме тому в більшості таких випадків призначають найрізноманітніші схеми лікування на основі гепатопротекторів. Деякі з них (біофлавоноїдні препарати) доведено впливають на цитоліз, інші чинять ще й виражений ефект на фібротичні процеси й баланс цитокінів (амінокислотні гепатопротектори, урсодезоксихолева кислота). Натомість є дані про те, що застосування значної частини гепатопротекторів може опосередковано пришвидшити реплікацію вірусу, оскільки блокує цитоліз інфікованих гепатоцитів клітинами імунної системи. Є також обґрунтовані побоювання щодо можливості підсилення окремими гепатопротекторами автоімунних проявів [8, 9].
З метою вивчення тривалого впливу гепатопротекторів у хворих на хронічний гепатит С із супутніми автоімунними проявами ми вивчили ефективність застосування біофлавоноїдів й амінокислотних гепатопротекторів у таких пацієнтів.
Матеріали і методи
Нами були проліковані 32 пацієнти з хронічним гепатитом С без ознак цирозу та супутньої патології печінки та жовчовивідних шляхів віком від 26 до 67 років. Пацієнти за випадковим принципом були рандомізовані на дві групи, кожна з яких отримувала один із двох гепатопротекторів. Перша група (16 чоловік) приймала біофлавоноїд карсил (силімарин, «Софарма») по 1 таблетці 35 мг тричі на добу протягом 6 місяців, друга (16 пацієнтів) — Гепа-Мерц (оригінальний L-орнітин-L-аспартат, «Мерц») по 3 грами перорально тричі на добу протягом того ж часу.
Критерії включення пацієнтів у дослідження:
— наявність хронічного гепатиту С тривалістю не менше 2 років;
— реплікація вірусу від 100 тис. до 1 млн копій на 1 мл;
— позитивні результати обстеження на антинуклеарні антитіла.
Критерії виключення пацієнтів із дослідження:
— наявність цирозу печінки;
— терапія препаратами інтерферонів на час спостереження чи в минулому;
— коінфекція HBV і ВІЛ.
Пацієнтам проводили комплексне клінічне, лабораторне та інструментальне обстеження до початку лікування, через 3 і 6 місяців. Біохімічні показники функції печінки визначали загальноприйнятими методами, маркери HСV і автоантитіла (ревмофактор, анти-LKM-антитіла, антинуклеарні антитіла) — імуноферментним методом, HСV-РНК — за допомогою полімеразної ланцюгової реакції як у сироватці крові, так і в кріопреципітаті запропонованим нами методом [10].
Результати та обговорення
Відомо, що біофлавоноїди, що входять до препаратів чортополоху, можуть ефективно конкурувати з токсинами і прозапальними цитокінами за зв’язування з рецепторами гепатоцитів. За рахунок цього вони чинять суттєвий мембраностабілізуючий та антиоксидантний вплив на гепатоцити з вираженим протизапальним компонентом. Є дані літератури про вплив біофлавоноїдів на пригнічення 5-ліпоксигеназного шляху (особливо на лейкотрієн В4), а також їх зв’язування з вільними радикалами кисню. Вони також пришвидшують процеси синтезу структурних і функціональних білків і фосфоліпідів у гепатоцитах, відновлюють енергетичні процеси [8].
У свою чергу, орнітин бере участь у циклі сечовини на етапі синтезу цитруліну і є стимулятором карбамоїлфосфатсинтетази І. Утилізує амонійні групи в синтезі сечовини й активує процеси знешкодження аміаку. Знижує концентрацію аміаку в плазмі крові, сприяє нормалізації кислотно-основної рівноваги організму, сприяє продукції інсуліну й соматотропного гормона, покращує білковий обмін. Орнітин за участі орнітиндекарбоксилази перетворюється в путресцин, на основі якого потім синтезуються спермідин і спермін, що знаходяться в усіх клітинах органів і локалізовані в основному в ядрі. Вони входять до складу хроматину і беруть участь в реплікації ДНК, їх концентрація значно збільшується в період активного поділу клітин та росту тканин [11], саме завдяки цьому він чинить сильний регенераторний ефект, зокрема на гепатоцити.
Аспартат включається в цикл сечовини (на етапі синтезу аргінінсукцинату); є субстратом для синтезу глутаміну, бере участь у зв’язуванні аміаку в перивенозних гепатоцитах, мозку, інших тканинах; стимулює синтез глутаміну в м’язах, перивенозних гепатоцитах. Також справляє стимулюючу дію на неактивні чи уражені клітини печінки, стимулює регенерацію, покращує енергетичні процеси в ушкодженій тканині печінки. Відомо, що поєднання орнітину з аспартатом протягом багатьох років успішно застосовувалось при лікуванні захворювань печінки, зменшуючи прояви печінкової енцефалопатії [11, 12]. На фоні прийому цих амінокислот відмічається зниження печінкових ензимів, що вказують на запальну активність, збільшується синтез білків. Рядом клініцистів було відзначено, що при гострому токсичному ураженні печінки використання оригінального L-орнітин-L-аспартату сприяло швидкій нормалізації клініко-лабораторних показників, що не можна було пояснити тільки фармакологічною дією оригінального L-орнітин-L-аспартату. На думку вчених, цей ефект можливий тільки за рахунок нормалізації печінкової гемодинаміки. Зміни з боку судинної системи пов’язані з особливостями обміну орнітину в орнітиновому циклі, що в процесі біотрансформації аміаку в сечовину впливає на кількість аргініну і призводить до фізіологічного та сталого його збільшення. Це дає можливість змінювати рівень оксиду азоту та покращувати мікроциркуляцію, що є додатковим поясненням динаміки репаративних і гемодинамічних процесів.
Клінічними проявами хронічної печінкової енцефалопатії є характерні постійні зміни психічної сфери різного ступеня вираженості, що періодично можуть посилюватися (зміни характеру, емоцій, настрою, порушення уваги, пам’яті, інтелекту). Важливим в ефективній терапії хронічної печінкової енцефалопатії є використання препаратів, що напряму впливають на патогенез патологічного стану, що пов’язаний із порушенням механізмів детоксикації аміаку. Це дозволяє забезпечувати метаболічний захист печінки та головного мозку.
У даний час оригінальний L-орнітин-L-аспартат застосовується здебільшого при лікуванні захворювань печінки, що супроводжуються розвитком печінкової енцефалопатії. У численних дослідженнях було показано, що препарат сприяє зниженню концентрації аміаку завдяки посиленню синтезу сечовини (на 80 %) і посиленню синтезу глютаміну, зменшуючи прояви печінкової енцефалопатії.
Призначення препарату Гепа-Мерц супроводжується не тільки покращенням клінічного стану хворого, а й змінами біохімічних показників пошкодження печінки.
Тому останнім часом його все частіше почали застосовувати при інших типах ураження печінки, зокрема при механічній жовтяниці непухлинного генезу, неалкогольних стеатогепатитах, токсичних ураженнях печінки тощо.
При порівнянні лабораторних показників функції печінки у хворих до лікування (табл. 1) можна відзначити відсутність вірогідної різниці за всіма досліджуваними показниками (Р > 0,05).
Протягом усього часу проведення лікування гепатопротекторами концентрація білірубіну суттєво не змінювалася в обох групах. Що стосується активності сироваткових трансаміназ, то спостерігалося суттєве зниження цих показників в обох групах. У хворих 1-ї групи (біофлавоноїди) виявлене виражене зниження активності АлАТ (Р < 0,05) та АсАТ (Р < 0,05). У 2-й групі (орнітин) ці показники теж зменшувалися.
Паралельно з дослідженням біохімічної функції печінки проводили визначення показників імунної відповіді (табл. 2).
При аналізі показників клітинної ланки до лікування можна відмітити відсутність вірогідної різниці в концентрації основних популяцій і субпопуляцій лімфоцитів у двох групах пацієнтів (Р > 0,05). У хворих, лікованих біофлавоноїдами, за рахунок тенденції до наростання рівня CD4-лімфоцитів (Р < 0,05) і чіткої тенденції до зниження числа CD8-клітин спостерігали виражене зростання співвідношення CD4/CD8 (Р < 0,05), що може бути трактоване як несприятливий прогностичний фактор при позитивних маркерах автоімунізації. Натомість застосування орнітину виявилося практично нейтральним щодо впливу на роботу імунітету і не чинило несприятливого розгальмовуючого впливу на автоімунний процес.
Що стосується імуноферментних маркерів автоімунізації, то при 6-місячному лікуванні гепатопротекторами вірогідних змін у частоті їх виявлення не було (табл. 3), не виключено, що через недостатнє число спостережень.
Але при цьому чітко прослідковуються протилежні тенденції щодо наростання рівнів автоімунізації при застосуванні біофлавоноїдів і зниження названих показників при застосуванні препарату орнітину (Р > 0,05). Загалом це підтверджує виявлену нами тенденцію щодо розгальмування імунної відповіді.
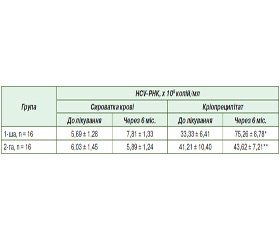
Привертає увагу різниця в частоті виявлення генетичних маркерів HC-вірусної інфекції в сироватці крові хворих та у кріопреципітаті. Так, концентрація HCV-РНК у кріопреципітаті практично на порядок вища, ніж у сироватці крові пацієнтів (табл. 4). Після 6-місячного курсу лікування біофлавоноїдами швидкість реплікації вірусу гепатиту С дещо наростає в сироватці крові й суттєво (більше ніж удвічі) — у кріопреципітаті (Р < 0,05).
Натомість при застосуванні орнітину протягом того ж часу концентрація генетичного матеріалу HCV практично не змінюється ні в сироватці крові, ні у кріопреципітаті (Р > 0,05).
Таким чином, мембраностабілізуючий та антиоксидантний вплив біофлавоноїдів на гепатоцити, очевидно, зумовив парадоксальний ефект, коли від імунного цитолізу захищалися у першу чергу інфіковані вірусом гепатоцити, які були трансформовані у своєрідні «фабрики вірусів». Не виключено, що саме цей ефект сприяв наростанню швидкості реплікації вірусу гепатиту С. Згаданий ефект супроводжувався активацією автоімунного компонента, що проявлялося наростанням імунорегуляторного індексу CD4/CD8 (Р < 0,05) і збільшенням відсотка хворих, у яких виявлялися антинуклеарні антитіла (Р > 0,05). Препарат орнітину (Гепа-Мерц) позбавлений перелічених вище недоліків, характерних для біофлавоноїдів.
Висновки
1. Застосування гепатопротекторів на основі біофлавоноїдів (карсил) і L-орнітину-L-аспартату (Гепа-Мерц) у хворих на гепатит С рівнозначно сприяє нормалізації показників печінкових ферментів.
2. Застосування біофлавоноїдів за умови супутнього автоімунного компонента супроводжується наростанням з боку імунної системи імунорегуляторного індексу CD4/CD8 (Р < 0,05) і збільшенням відсотка хворих, у яких виявлялися антинуклеарні антитіла (Р > 0,05). На відміну від карсилу Гепа-Мерц не підсилює автоімунний компонент, який супроводжує запальний процес.
3. При тривалому застосуванні біофлавоноїдів виявляється наростання реплікації вірусу гепатиту С, що супроводжується наростанням показників HCV-РНК у сироватці крові і кріопреципітаті. На відміну від біофлаваноїдів при призначенні препарату Гепа-Мерц швидкість реплікації вірусу гепатиту С не збільшується.
4. Таким чином, у випадку неможливості призначення противірусного лікування хворим на гепатит С за умови наявності супутнього автоімунного компоненту доцільно призначати оригінальний L-орнітин-L-аспартат (Гепа-Мерц). Застосування біофлавоноїдів у таких хворих невиправдане та призводить до змін в імунній системі.
5. Пошкодження клітин печінки на фоні розвитку гепатиту С може спричинювати розвиток печінкової енцефалопатії. Використання рослинних біофлавоноїдів може призвести до змін імунної системи та не впливає на розвиток печінкової недостатності. Необхідність використання препарату Гепа-Мерц обумовлена:
— позитивним впливом на білковосинтезуючу функцію печінки та гепатопротекторним ефектом без ризику розвитку змін з боку імунної системи;
— прямою детоксикуючою дією на патогенетичні механізми розвитку печінкової енцефалопатії.
1. Mangia A., Santoro R., Copetti M. Treatment optimization and prediction of HCV clearance in patients with acute HCV infection // J. Hepatol. — 2013 Aug. — V. 59(2). — P. 21–8.
2. Shepard C.W., Finelli L., Alter M.J. Global epidemilogy of hepatitic C virus infection // Lancet Infect. Dis. — 2005. — V. 5. — P. 558–567.
3. Lavanchy D. Evolving epidemiology of hepatitis C virus // Clin. Microbiol. Infec. — 2011. — V. 17(2). — P. 107–115.
4. Hsu Y.C., Lin J.T., Ho H.J. et al. Antiviral treatment for hepatitis C virus infection is associated with improved renal and cardiovascular outcomes in diabetic patients // Hepatology. — 2013 Oct 12. doi: 10.1002.
5. Armstrong G.L., Wasley A., Simard E.P. et al. The prevalence of hepatitis C virus infection in the United States, 1999 through 2002 // Ann. Intern. Med. — 2006. — V. 144. — P. 705–714.
6. Faustini A., Colais P., Fabrizi E. et al. Hepatic and extra-hepatic sequelae, and prevalence of viral hepatitis C infection estimated from routine data in at-risk groups // BMC Infect Dis. — 2010. — V. 10. — P. 97.
7. Ghinoi A., Mascia M.T., Puccini R. Manifestazioni autoimmuni e linfoproliferaive HCV-correlate: l’esempio della crioglobulinemia mista // G. Ital. Nefrol. — 2004. — V. 21, № 3. — P. 225–237.
8. Hawke R.L., Schrieber S.J., Soule T.A. Silymarin Ascending Multiple Oral Dosing Phase I Study in Noncirrhotic Patients With Chronic Hepatitis C // J. Clin. Pharmacol. — 2010. — V. 50(4). — P. 434–449.
9. Reddy K.R., Belle S.H. Rationale, challenges, and participants in a Phase II trial of a botanical product for chronic hepatitis C // Clin. Trials. — 2012. — V. 9(1). — P. 102–112.
10. Андрейчин М.А., Господарський І.Я., Луцук О.С. Спосіб діагностики гепатитів В і С. Деклараційний патент на винахід. — 2003. Бюл. № 11.
11. Paris A.J., Snapir Z., Christopherson C.D. A Polymorphism that Delays Fibrosis in Hepatitis C Promotes Alternative Splicing of AZIN1, Reducing Fibrogenesis // Hepatology. — 2011. — V. 54(6). — P. 2198–2207.
12. Ivanov A.V., Bartosch B., Smirnova O.A. HCV and Oxidative Stress in the Liver // Viruses. — 2013. — V. 5(2). — P. 439–469.

/45/45.jpg)
/45/45_2.jpg)
/46/46.jpg)