Журнал "Гастроэнтерология" 1 (51) 2014
Вернуться к номеру
Современные подходы к оптимизации диагностики и лечения экзокринной панкреатической недостаточности
Авторы: Ткач С.М., Швец О.В. - Национальный медицинский университет имени А.А. Богомольца, г. Киев
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
В статье рассмотрены этиология и современные диагностические методы исследования внешнесекреторной недостаточности поджелудочной железы, в частности неинвазивный 13С-смешанный триглицеридный тест, позволяющий не только косвенно определить активность панкреатической липазы в двенадцатиперстной кишке, но и оценить эффективность заместительной гормональной терапии. Приведено сравнительное клиническое исследование, основной целью которого стало уточнение возможностей применения 13С-триглицеридного дыхательного теста для оптимизации диагностики и коррекции внешнесекреторной недостаточности поджелудочной железы. Оценивалась эффективность пероральной заместительной ферментной терапии с использованием препарата Пангрол® 25000.
У статті розглянуті етіологія й сучасні діагностичні методи дослідження зовнішньосекреторної недостатності підшлункової залози, зокрема неінвазивний 13С-змішаний тригліцеридний тест, що дозволяє не тільки опосередковано визначити активність панкреатичної ліпази у дванадцятипалій кишці, але й оцінити ефективність замісної гормональної терапії. Наведено порівняльне клінічне дослідження, основною метою якого стало уточнення можливостей застосування 13С-тригліцеридного дихального тесту для оптимізації діагностики й корекції зовнішньосекреторної недостатності підшлункової залози. Оцінювалась ефективність пероральної замісної ферментної терапії з використанням препарату Пангрол® 25000.
The article describes the etiology and current diagnostic methods of investigation of exocrine pancreatic insufficiency, in particular non-invasive 13C-mixed triglyceride test, allowing not only to determine indirectly the activity of pancreatic lipase in the duodenum, but also to evaluate the effectiveness of hormone replacement therapy. Comparative clinical study has been carried out, its main objective was clarifying opportunities for application of 13C-triglyceride breath test to optimize the diagnosis and correction of exocrine pancreatic insufficiency. The efficacy of oral enzyme replacement therapy using drug Pangrol® 25000 was evaluated.
внешнесекреторная недостаточность поджелудочной железы, 13С-триглицеридный дыхательный тест, ферментный препарат, Пангрол® 25000.
зовнішньосекреторна недостатність підшлункової залози, 13С-тригліцеридний дихальний тест, ферментний препарат, Пангрол® 25000.
exocrine pancreatic insufficiency, 13C-triglyceride breath test, enzyme preparation, Pangrol® 25000.
Статья опубликована на с. 49-54
Благодаря своей экзокринной функции поджелудочная железа (ПЖ) играет важную физиологическую роль в поддержании нормального пищеварения, питания и здоровья в целом. Секретируемые ПЖ ферменты расщепляют пищу на микронутриенты, которые всасываются в систему кровообращения и поддерживают нормальное функционирование организма. Нарушение этого процесса вследствие разрушения паренхимы ПЖ, обструкции ее протоков или операций на ПЖ может стать причиной внешнесекреторной недостаточности ПЖ (ВНПЖ). У пациентов с потерей более 90 % функционирующей паренхимы ПЖ возникает стеаторея, которая резко повышает риск кратко- и долгосрочного дефицита питательных веществ и витаминов, а также осложнений, которые ухудшают клинический исход [6, 7]. Согласно современным представлениям, ВНПЖ рассматривается как угрожающее жизни состояние, сопровождающееся повышенной смертностью вследствие повышенного риска неблагоприятных кардиоваскулярных событий и осложнений, связанных с мальнутрицией и мальдигестией, таких как сердечная недостаточность, остеопороз и переломы костей, инфекции, анемия, гипопротеинемия, гиповитаминоз и др. [3, 10].
В настоящее время ВНПЖ определяется как нарушение экболической секреторной функции ПЖ, включающее снижение как ацинарной секреции ферментов (липаза, амилаза, протеаза), так и протоковой секреции бикарбоната [9]. Чаще всего ВНПЖ является следствием хронического панкреатита (ХП), возникающего вследствие хронического алкоголизма (70–80 % всех случаев). ВНПЖ постепенно развивается у 30 % больных с легкими ХП и 85 % больных с тяжелыми ХП, обычно через 10–15 лет хронического злоупотребления алкоголем. Среди других причин ВНПЖ — тяжелый острый некротический панкреатит (сопровождается развитием ВНПЖ у 86 % больных), острый рецидивирующий панкреатит и хроническая обструкция основного протока поджелудочной железы, включая рак ПЖ. Кроме того, к развитию ВНПЖ могут приводить хирургические вмешательства на ПЖ (резекции/панкреатэктомия), желудке (резекции/гастрэктомия) и тонкой кишке, экстрапанкреатические заболевания (целиакия, болезнь Крона, первичный билиарный цирроз, склерозирующий холангит) и метаболические расстройства, такие как гиперкальциемия и гиперлипопротеинемия [9, 10]. Считается, что 8–10 % всех гастроэнтерологических больных имеют в той или иной степени выраженную ВНПЖ [10]. У детей причиной ВНПЖ является муковисцидоз (ВНПЖ развивается у 90 % больных), наследственный панкреатит и, реже, дефицит отдельных ферментов.
Первичная диагностика ВНПЖ базируется на анамнестическом выявлении возможных причин и факторов риска ее развития, а также на клинических проявлениях и данных объективного исследования. В пользу ВНПЖ может свидетельствовать длительный анамнез подтвержденного ХП, перенесенный острый панкреатит (особенно панкреонекроз), злоупотребление алкоголем и курение, ожирение/метаболический синдром, операции на поджелудочной железе, желудке и тонкой кишке в анамнезе. Основным клиническим признаком ВНПЖ является стеаторея — жидкий, жирный, зловонный стул, появляющийся в результате нарушения усвоения жиров. Наличие капель жира в кале, которые приклеиваются к унитазу и которые трудно смыть водой, почти наверняка указывают на ВНПЖ. К сожалению, стеаторея рассматривается как позднее проявление ВНПЖ, обычно возникающее при потере 90 % экзокринной функции ПЖ [6, 7]. Другие клинические симптомы, которые могут указывать на ВНПЖ, включают диарею, вздутие живота и боли, нарушения питания, в частности снижение массы тела (оценивается за один и шесть предшествующих месяцев), уменьшение мышечной массы и снижение мышечной силы, задержку роста или созревания, гипопротеинемию с развитием отеков, признаки остеопороза, симптомы специфического дефицита нутриентов (выпадение волос, глоссит, дерматит, парестезии). У небольшого числа пациентов возникает дефицит жирорастворимых витаминов (A, D, E и K) [3, 10].
При подозрении на ВНПЖ после полного физикального обследования, выяснения семейного анамнеза и дифференциальной диагностики необходима точная оценка внешнесекреторной функции ПЖ с помощью прямых или косвенных тестов, что играет решающую роль для назначения заместительной ферментной терапии (ЗФТ).
Прямые (инвазивные) тесты для определения функции ПЖ предусматривают использование двухпросветных гастродуоденальных зондов для сбора панкреатического сока после стимуляции холецистокинином (ХЦК) или секретином. Полученный секрет анализируют на количество ферментов и бикарбонатов. В последние годы были разработаны прямые эндоскопические методы, которые упростили сбор панкреатического секрета и сделали прямое тестирование функции ПЖ более доступным. Полученные с помощью эндоскопа через 15, 30, 45 и 60 минут образцы дуоденального содержимого (после стимуляции ХЦК или секретином), содержащие выделившийся секрет ПЖ, хранят на льду и передают в лабораторию для анализа концентрации бикарбонатов и/или ферментов. Пиковые концентрации бикарбоната менее 80 мг-экв/л при секретиновом тесте и/или пиковые концентрации липазы менее 780 000 МЕ/л при ХЦК-стимулированном тесте указывают на ВНПЖ [9]. Прямые тесты могут диагностировать ВНПЖ на ранней стадии ХП, поскольку выявляют даже незначительные изменения функции ПЖ до развития явной стеатореи и изменений результатов визуализирующих исследований, таких как ультразвуковое исследование (УЗИ), компьютерная томография (КТ), магнитно-резонансная томография/магнитно-резонансная холангиопанкреатография (МРТ/МРХПГ) или эндосонография (ЭСГ). Следует отметить, однако, что прямые тесты для определения функции ПЖ в клинической практике в настоящее время используются редко. Основными ограничениями для проведения прямого тестирования являются его инвазивность, обременительная процедура и сложность забора секрета ПЖ с помощью гастродуоденального зонда или эндоскопа [10]. Поэтому прямые тесты проводятся лишь в отдельных высокоспециализированных исследовательских центрах. В настоящее время также изучается информативность альтернативного неинвазивного теста — МРХПГ с секретином, при котором после стимуляции секретином через 15, 30, 45 и 60 мин определяют объем выделенного в двенадцатиперстную кишку панкреатического сока [7].
Чтобы избежать сложностей, связанных с прямым забором панкреатического сока, на практике подавляющее большинство гастроэнтерологов отдают предпочтение непрямым (неинвазивным) методам, в первую очередь определению уровня фекальной эластазы-1 (ФЭ-1). Определение уровня ФЭ-1 обладает высокой специфичностью в отношении ВНПЖ и хорошим уровнем чувствительности у пациентов с умеренной или тяжелой ВНПЖ. Данный тест имеет хорошую общую диагностическую точность по сравнению с определением уровня фекального химотрипсина (92 против 82 %), а измерения могут быть воспроизведены приблизительно через 7 дней после забора материала. Диагностика ВНПЖ легкой и тяжелой степени основана на значении фекальной эластазы-1 менее 200 мкг/г кала и 100 мкг/г кала соответственно [10].
К сожалению, большинство непрямых тестов, в том числе и определение уровня ФЭ-1, чувствительны при среднетяжелой и тяжелой ВНПЖ, однако недостаточно эффективны для раннего ее обнаружения. Метод 72-часового сбора кала с расчетом коэффициента абсорбции жира (КАЖ), который ранее рассматривался как золотой стандарт косвенной диагностики мальабсорбции и ВНПЖ, в клинике сейчас практически не используется. Это связано с его недостаточной точностью, неудобством, обременительностью и неприятием многими пациентами. Альтернативой 72-часовому сбору фекального жира и вычислению КАЖ является неинвазивный 13С-смешанный триглицеридный тест (13С-ТДТ), позволяющий не только косвенно определять активность панкреатической липазы в двенадцатиперстной кишке, но и оценивать эффективность ЗФТ даже после одноразового приема ферментного препарата (ФП) [3, 4, 10]. Этот тест в настоящее время проводится в нескольких украинских гастроэнтерологических центрах, в которых имеется необходимая аппаратура (инфракрасный анализатор 13С-стабильных изотопов).
На кафедре внутренней медицины № 1 Национального медицинского университета имени А.А. Богомольца первые серии 13С-ТДТ были проведены более 12 лет назад. На сегодняшний день мы обладаем достаточно большим опытом проведения данного теста — обследованы более 400 пациентов с хроническим панкреатитом и другими гастроэнтерологическими заболеваниями. Если раньше 13С-ТДТ применялся нами с целью подтверждения наличия ВНПЖ, то в последнее время мы начали его использовать и для подтверждения эффективности ЗФТ. В частности, нами проведено сравнительное клиническое исследование, основной целью которого явилось уточнение возможностей применения 13С-ТДТ для оптимизации диагностики и коррекции ВНПЖ. В качестве основных задач исследования рассматривали: 1) определение точности 13C-ТДТ для оценки эффективности пероральной ЗФТ у больных с хроническим панкреатитом с ВНПЖ; 2) оценку влияния оптимизированной ЗФТ на индивидуальный нутритивный статус каждого пациента с ВНПЖ в соответствии с результатами 13С-ТДТ.
Материал и методы исследования
Для достижения поставленной цели обследовано 30 пациентов с хроническим панкреатитом с ВНПЖ (18 мужчин, 12 женщин в возрасте от 29 до 62 лет, средний возраст 42,2 ± 10,5 года) и 15 здоровых добровольцев. Диагноз хронического панкреатита и ВНПЖ у всех пациентов устанавливали на основании типичных клинико-анамнестических данных, результатов визуализирующих исследований (УЗИ, КТ, МРТ) и снижения уровня ФЭ-1 менее 100 мкг/г кала. Всем пациентам из опытной и контрольной группы для исходной оценки интрадуоденальной активности панкреатической липазы в соответствии с разработанной и описанной методикой [3] проводили 13С-ТДТ. Данный тест выполняли после проведения вышеописанных исследований и установления диагноза ХП и ВНПЖ, а также после первого приема ферментного препарата (1 капсула Пангрола® 25000). За 48–72 часа до проведения теста пациент не принимал ФП, в течение 8 часов перед тестом не курил; за два-три дня до исследования ограничивали продукты, содержащие много секретина. Перед началом теста для ускорения эвакуации тестового блюда из желудка пациент принимал 10 мг метоклопрамида, затем делал первый выдох в специальный герметично закрывающийся мешочек, после чего принимал тестовое блюдо – 20 г масла на двух кусочках хлеба, куда добавляли 250 мг 13С-смеси триглицеридов (Eurоisotop, Cedex, Франция). Следующие дыхательные пробы получали каждые 15 минут в течение 6 часов. Во всех дыхательных пробах методом инфракрасной спектрометрии (инфракрасный анализатор стабильных изотопов IRIS by WAGNER, Германия) определяли концентрацию 13СО2 и показатель 13CO2/12CO2. В качестве нормальных показателей панкреатической функции считали суммарную концентрацию 13СО2 на 360-й минуте более 23 ‰. С учетом данных предыдущих исследований, выполненных среди пациентов с хроническим панкреатитом со стеатореей и без нее, установлено, что суммарная концентрация 13CO2 менее 23 ‰ свидетельствует о мальдигестии жира (чувствительность и специфичность более 90 %) [3].
В качестве первичного курса ЗФТ всем пациентам с ХП перорально назначали 25000–50000 ЕД липазы в форме кишечнорастворимых мини-таблеток (1 капсула Пангрола® 25000) в течение 2 недель во время каждого из трех основных приемов пищи. Доза ФП (25000 или 50000 ЕД) зависела от показателей второго 13С-ТДТ, проводимого для оценки суммарной активности эндогенной и экзогенной панкреатической липазы; при этом пациент принимал капсулу ФП (Пангрол® 25000) с первым кусочком хлеба с маслом. При патологических результатах данного (второго) 13С-ТДТ дозу ФП увеличивали вдвое (2 капсулы Пангрола® 25000 три раза в день). Такую же дозу ФП назначали и при отсутствии клинического эффекта на прием Пангрола® 25000 3 раза в день в течение двух недель.
Распределение данных проанализировано с использованием теста Колмогорова – Смирнова. С учетом этого результаты 13С-ТДТ представлены как средние данные; результаты на рисунках показаны как индивидуальные значения, среднее и 25–75-й перцентили. Фермент-опосредованное улучшение абсорбции жира по результатам дыхательного теста представлено как медиана при 95% доверительном интервале (ДИ). Количественные и качественные переменные сравнивали статистически с помощью t-теста Стьюдента для зависимых образцов и точного теста Фишера соответственно.
Полученные результаты
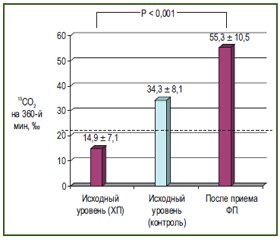
У всех пациентов опытной группы до начала терапии были аномальные показатели суммарной концентрации 13СО2 на 360-й минуте (14,9 ± 7,1 ‰), свидетельствующие о недостаточной активности интрадуоденальной липазы. У всех здоровых добровольцев активность панкреатической липазы была нормальной, о чем свидетельствовали нормальные показатели 13C-ТДТ (суммарная концентрация 13CO2 составила 34,3 ± 8,1 ‰). При проведении повторного 13C-ТДТ после приема одной капсулы Пангрола® 25000 в группе больных ХП средний показатель суммарной концентрации 13СО2 на 360-й минуте в среднем возрос до 55,3 ± 10,5 ‰ (P < 0,001), то есть средний прирост концентрации 13СО2 на 360-й минуте составил 40,4 ‰ (19,6–88,7 ‰) (рис. 1).
/51/51.jpg)
После приема 1 капсулы Пангрола® 25000 результаты 13C-TДТ сразу нормализовывались у 16 пациентов (53,3 %), в дальнейшем ЗФТ у этих пациентов (1-я подгруппа) продолжалась в указанной разовой дозировке. У остальных 14 больных (2-я подгруппа), несмотря на повышение суммарной концентарции 13CO2 (18,1 ± 4,8 ‰) на 360-й минуте, полной нормализации показателей не было, в связи с чем у этих пациентов дальнейшая разовая доза ФП была удвоена. Через 2 недели клиническое улучшение в 1-й подгруппе было отмечено у 14 из 16 пациентов (87,5 %), во 2-й подгруппе — у 12 из 14 пациентов (85,7 %). Таким образом, первичный курс ЗФТ в индивидуально подобранной дозе ФП в зависимости от показателей 13C-TДТ позволил добиться клинического улучшения у 26 из 30 больных ХП (86,6 %). Удвоение разовой дозы ФП (2 больным в первой подгруппе) или дополнительное назначение ингибитора протонной помпы (2 больным во второй подгруппе) сопровождалось клиническим улучшением еще у 2 пациентов (по 1 больному из первой и второй подгруппы). У 2 оставшихся пациентов с недостаточным эффектом вследствие ЗФТ впоследствии была диагностирована сопутствующая патология (целиакия и синдром избыточного бактериального роста), что потребовало принципиально другой коррекции лечения. Таким образом, проведение 13C-TДТ позволило индивидуализировать и оптимизировать проведение ЗФТ и добиться клинического улучшения и коррекции ВНПЖ в течение 2 недель у 86,6 %, а в течение 4 недель — у 93,3 % больных ХП с ВНПЖ.
Всем больным в дальнейшем продолжали проводить индивидуальную ЗФТ на эффективных дозах ФП, установленных при проведении 13C-TДТ. Через 6 месяцев такого лечения диарея и стеаторея у них отсутствовали, масса тела увеличилась (с 63,4 ± 10,4 кг до 68,8 ± 11,1 кг), признаки гиповитаминоза и мальнутриции не выявлялись.
Обсуждение
Согласно результатам большого североамериканского рандомизированного клинического исследования, закончившегося в 2011 г., на практике ЗФТ применяется в основном у взрослых пациентов с ХП (примерно у 70 %), главным у образом у тех, у кого имеется стеаторея и абдоминальная боль [1, 18]. По мнению многих ведущих гастроэнтерологов, не менее важным последствием ВНПЖ также является и мальнутриция, поскольку сниженный уровень циркулирующих микронутриентов, жирорастворимых витаминов и липопротеинов высокой плотности ассоциируется с увеличением смертности вследствие повышения кардиоваскулярного риска и риска осложнений.
Поэтому клинические цели ЗФТ включают оптимизацию качества жизни больных путем коррекции нарушения всасывания макро- и микроэлементов, нормализации микронутриентного статуса, а также снижения выраженности или устранения абдоминальных симптомов, связанных с нарушением пищеварения, таких как стеаторея, хронический диарейный синдром, боль, диспептические явления и потеря веса [3, 6, 9]. Фармакокинетические цели ЗФТ заключаются в оптимизации питательной ценности каждого приема пищи путем достижения адекватной и своевременной концентрации ферментов ПЖ в двенадцатиперстной кишке. Основным путем достижения целей ЗФТ является доставка необходимого количества активной липазы (25000–40000 ЕД) в нужное место и в нужное время, а именно в двенадцатиперстную кишку и начальные отделы тощей кишки параллельно с опорожнением желудка от нутриентов [10].
Современные принципы диагностики ВНПЖ и проведения ЗФТ, представленные с точки зрения доказательной медицины, изложены в рекомендациях, вышедших в 2010 году в Италии, Австралии и Южной Африке, а также в рекомендациях Испанского панкреатологического клуба по диагностике и лечению ХП (2013 г.) [2, 8, 16]. Согласно последним клиническим рекомендациям, лечение ВНПЖ строго показано больным с симптоматической стеатореей (диарея и/или снижение массы тела) или стеатореей более 15 г жира/день. Необходимость проведения ЗФТ при наличии менее выраженной стеатореи (7,5–15 г жира/день) пока дискутируется.
Пероральные ФП должны применяться в дозе, способной максимально улучшить переваривание и всасывание нутриентов. Согласно последним клиническим рекомендациям, при доказанной ВНПЖ для ЗФТ следует использовать ферменты ПЖ в рН-чувствительных мини-микросферах или мини-таблетках размером менее 1,8–2,0 мм, покрытых кишечнорастворимой оболочкой, содержащих высокие дозы липазы. Они смешиваются с пищей в желудке, защищают свое ферментное содержимое от кислотности желудочного сока, одновременно с химусом поступают в двенадцатиперстную кишку, где оболочка при уровне pH ≥ 5,5 быстро растворяется и высвобождает ферменты. Эффективность кишечнорастворимых форм ферментов в мини-микросферах или мини–таблетках при лечении ВНПЖ доказана в хорошо спланированных двойных слепых рандомизированных контролируемых испытаниях на достаточном количестве больных ХП [13, 14, 17, 18].
В Европе и других странах, в частности в Украине, в настоящее время для ЗФТ в качестве эффективного ФП, отвечающего современным требованиям, широко применяется немецкий препарат Пангрол® 25000, выпускаемый в капсулах с энтеросолюбильной оболочкой, содержащих мини-таблетки. Отличительными особенностями этого препарата являются высокое содержание панкреатических ферментов в оптимальном соотношении (липаза — 25000 ЕД, трипсин — 1250 ЕД), отсутствие в составе энтеросолюбильной оболочки токсичных фталатов, наличие дополнительных компонентов (симетикон, целлюлоза, макроголь 6000 и др.), уменьшающих метеоризм и другие диспептические проявления. Пангрол® 25000 зарекомендовал себя как современный ФП, высокоэффективный и удобный для проведения ЗФТ при ВНПЖ и болевых формах ХП.
Проведенное нами исследование показало, что Пангрол® 25000 в виде капсул с кишечнорастворимыми мини–таблетками, содержащими 25000 ЕД липазы, обладает высоким терапевтическим эффектом в отношении ВНПЖ. По нашим данным, согласно результатам 13С-ТДТ, даже однократный прием Пангрола® 25000 у большинства больных с ВНПЖ повышает содержание интрадуоденальной липазы до уровня, необходимого для эффективного переваривания и всасывания жиров и других микронутриентов.
Критериями эффективности ЗФТ является прекращение потери или увеличение массы тела, уменьшение (исчезновение) послабления стула или его нормализация, уменьшение диспепсии, улучшение нутритивных показателей, результатов копрограммы и функциональных панкреатических тестов, в частности 13С-ТДТ [3, 10]. На практике эффективность пероральных ФП обычно оценивается у пациентов индивидуально, путем простого клинического наблюдения за симптомами, связанными со стеатореей. К сожалению, при таком подходе очень часто могут быть неудачи или неполный эффект от лечения. Так, по данным одного из недавних исследований, адекватный симптоматический ответ на пероральную ЗФТ ассоциировался с повышением КАЖ до 80–85 % от нормальных показателей и нормализацией нутритивного статуса только у 33 % пациентов с ВНПЖ [11, 12].
Таким образом, на основании только простых клинических наблюдений (отсутствие потери массы тела, диареи и других симптомов, связанных со стеатореей) проводимая ЗФТ, как правило, не может быть точно оптимизирована. Поэтому в настоящее время намечается тенденция к использованию оптимальных индивидуальных дозировок ФП в зависимости от показателей функциональных панкреатических тестов. Поскольку количественное определение фекального жира путем вычисления КАЖ слишком обременительно и малоприятно, в настоящее время оно в клинической практике используется все реже, а альтернативу ему начали составлять различные 13С-дыхательные тесты, при помощи которых можно оценивать переваривание и всасывание жиров. Чаще всего в настоящее время применяется 13C-триглицеридный дыхательный тест [3, 7]. Этот неинвазивный тест достаточно прост и легко применим в повседневных клинических исследованиях, кроме того, по мере необходимости он может проводиться повторно.
Проведенное нами исследование подтвердило, что 13C-ТДТ является точным методом для прогнозирования и определения эффективности пероральной ЗФТ, и поэтому в повседневной клинической практике им можно заменить количественное определение фекального жира. Согласно полученным нами данным, повышение изначально сниженной суммарной концентрации 13CO2 на 360-й минуте до нормальных показателей можно рассматривать как информативный критерий, позволяющий индивидуально подбирать разовую дозу фермента для ЗФТ и прогнозировать ее эффективность.
Таким образом, полученные нами данные подтверждают результаты ранее проведенных исследований, свидетельствующих о том, что ВНПЖ можно успешно корректировать путем проведения ЗФТ и что 13C-ТДТ можно использовать для контроля эффективности и оптимизации заместительной ферментной терапии [3-6, 9, 10]. Согласно полученным нами результатам, 13C-ТДТ следует рассматривать не только как достаточно простой неинвазивный и высокоинформативный метод первичной диагностики ВНПЖ, но и как надежный метод первичной оценки эффективности назначаемой ЗФТ у больных ХП с ВНПЖ. Еще одним важным результатом проведенного исследования явилось подтверждение высокого терапевтического эффекта капсул ФП с кишечнорастворимыми мини-таблетками, содержащими 25000 ЕД липазы (Пангрол® 25000).
1. Burton F., Alkaade S., Collins D. et al. Use and perceived effectiveness of non-analgesic medical therapies for chronic pancreatitis in the United States // Aliment. Pharmacol. Ther. — 2011. — 33. — 149–159.
2. De–Madaria E., Abad-González A., Aparicio J.R. et al. Spanish Pancreatic Club recommendation on diagnostic and treatment of chronic pancreatitis // Pancreatology. — 2013. — 13. — 18–28.
3. Dominguez-Munoz J.E., Iglesias-Garcia J., Vilarino-Insua M., Iglesias-Rey M. 13C-mixed triglyceride breath test to assess oral enzyme substitution therapy in patients with chronic pancreatitis // Clin. Gastroenterol. Hepatol. — 2007. — 5. — 484–8.
4. Dominguez-Munoz J.E., Iglesias-Garcia J. Oral pancreatic enzyme substitution therapy in chronic pancreatitis: is clinical response an appropriate marker for evaluation of therapeutic efficacy? // JOP. — 2010. — 11. — 158–62.
5. Giuliano S.A., Dehoorne-Smith M.L., Kale-Pradhan P.B. Pancreatic enzyme products // Ann. Pharmaсother. — 2011. — 45. — 658–666.
6. Fieker A., Philpott J., Armand M. Enzyme replacement therapy for pancreatic insufficiency: present and future // Clin. Exp. Gastroenterol. — 2011. — 4. — 55–73.
7. Forsmark C. Management of Chronic Pancreatitis // Gastroenterology. — 2013. — 144. — 1282–1291.
8. Frulloni L., Falconi M., Gabbrielli A., Gaia E., Graziani R., Pezzilli R. et al. Italian consensus guidelines for chronic pancreatitis // Dig. Liver Dis. — 2010. — 42(Suppl. 6). — S381–406.
9. Kadiyala V., Suleiman S., Conwell D. Pancreatic exocrine insufficiency // Gastroentero&Endoscopy News. — June 2012. — 1–11.
10. Lohr J.-M. Exocrine Pancreatic Insufficiency. — Bremen: UNI–MED, 2010. — 91 p.
11. Maguiness K., Fulton J., Luder E. et al. Nutrition: Pancreatic Enzyme Replacement in Patients with Cystic Fibrosis. — Volume 2012. — 2006.
12. Safdi M., Bekal P.K., Martin S., Saeed Z.A., Burton F., Toskes P.P. The effects of oral pancreatic enzymes on steatorrhea: a multicenter, placebo-controlled, parallel group trial in subjects with chronic pancreatitis // Pancreas. — 2006. — 33. — 156–62.
13. Shafiq N., Rana S., Bhasin D., Pandhi P., Srivastava P., Sehmby S.S. et al. Pancreatic enzymes for chronic pancreatitis // Cochrane Database Syst. Rev. — 2009: CD006302.
14. Stallings V.A., Stark L.J., Robinson K.A. et al. Evidence–based practical recomendations for nutritionrelated management of children and adults with cystic fibrosis and pancreatic insufficiency: results of systematic review // J. Am. Diet. Assoc. — 2008. — 108. — 832–839.
15. Taylor J.R., Gardner T.B., Waljee А.K., DiMagno M.J., Schoenfeld P.S. Systematic review: efficacy and safety of pancreatic enzyme supplements for exocrine pancreatic insufficiency // Aliment. Pharmacol. Ther. — 2010. — 31. — 57–72.
16. Toouli J., Biankin A.V., Oliver M.R. et al. Management of pancreatic exocrine insufficiency: Austral-Asian Pancreatic Club recommendations // Med. J. Austr. — 2010. — 193. — 461–467.
17. Waljee A.K., Dimagno M.J., Wu B.U., Schoenfeld P.S., Conwell D.L. Systematic review: pancreatic enzyme treatment of malabsorption associated with chronic pancreatitis // Aliment. Pharmacol. Ther. — 2009. — 29. — 235–46.
18. Whitcomb D.C., Yadav D., Slivka A. et al. Multicenter approach to recurrent acute and chronic pancreatitis in the United States: the North American Pancreatitis Study 2 (NAPS2) // Pancreatology. — 2008. — 8. — 520–31.
19. Whitcomb D.C., Lehman G.A., Vasileva G., Malecka-Panas E., Gubergrits N., Shen Y. et al. Pancrelipase delayed-release capsules for exocrine pancreatic insufficiency due to chronic pancreatitis or pancreatic surgery: a double–blind randomized trial // Am. J. Gastroenterol. — 2010. — 105. — 2276–86.