Газета «Новости медицины и фармации» 18 (472) 2013
Вернуться к номеру
Лечение остеопороза: вопросы эффективности, безопасности и приверженности к лечению
Авторы: Головач И.Ю. - д.м.н., профессор Клиническая больница «Феофания» ГУД, г. Киев
Разделы: Справочник специалиста
Версия для печати
 Лечение остеопороза (ОП) представляет собой сложную задачу, с одной стороны, это обусловлено многофакторностью и многоликостью его патогенеза и прогрессирующим течением, с другой — скрытым началом и развертыванием полной клинической картины только при появлении осложнений — деформаций скелета, постоянного болевого синдрома, переломов.
Лечение остеопороза (ОП) представляет собой сложную задачу, с одной стороны, это обусловлено многофакторностью и многоликостью его патогенеза и прогрессирующим течением, с другой — скрытым началом и развертыванием полной клинической картины только при появлении осложнений — деформаций скелета, постоянного болевого синдрома, переломов.
Важнейшими целями при лечении остеопороза являются:
1. Профилактика переломов костей.
2. Стабилизация или увеличение костной массы.
3. Максимальное улучшение физических функций организма и качества жизни [2].
Однако основная цель лечения остеопороза — предотвращение переломов костей. В настоящее время главным критерием эффективности препарата, используемого для лечения любой формы остеопороза (первичного или вторичного), является снижение частоты новых переломов, причем как позвоночных, так и внепозвоночных, включая переломы проксимального отдела бедренной кости, при 5летнем наблюдении. Очевидно, что от антиостеопоротического препарата ожидают снижения риска прежде всего переломов тех локализаций, которые имеют наиболее драматические последствия, — позвонков и проксимального отдела бедра. Кроме того, при оценке эффективности лекарственного средства проводится изучение динамики минеральной плотности костной ткани (МПК) по данным двухэнергетической рентгеновской абсорбциометрии, а также его влияния на маркеры костного метаболизма, включая маркеры костного образования и резорбции.
Среди антиостеопоротических препаратов особое место занимают бисфосфонаты (БФ), относящиеся к первой линии в лечении остеопороза и обладающие мощным антирезорбтивным воздействием. Их основным фармакологическим эффектом является выраженное угнетение костной резорбции и снижение скорости костного метаболизма. Именно эти нарушения костного метаболизма лежат в основе большинства форм остеопороза. Молекулярная структура БФ (P–C–P) аналогична таковой встречающегося в природе пирофосфата (P–O–P). Замена центрального атома кислорода на углерод обеспечила, с одной стороны, устойчивость БФ к гидролизу, а с другой — благодаря наличию двух свободных валентностей углерода позволила обогатить молекулу боковыми цепями R1 и R2. Цепь R1 — это гидроксильная (ОН) группа, увеличивающая сродство БФ к гидроксиапатиту и непосредственно обеспечивающая способность молекулы БФ связываться с костной тканью. Цепь R2 определяет силу ингибирования фермента фарнезилпирофосфатсинтетазы (ФПС) и, таким образом, биологическую активность молекулы [36]. Все БФ последних поколений в составе R2 имеют NHгруппу и поэтому относятся к нитросодержащим БФ, или аминобисфосфонатам [5, 25]. Разнообразие в структуре боковых цепей определяет силу, с которой БФ связываются с гидроксиапатитом, распределяются в кости и остаются определенное время в ней после завершения лечения [36].
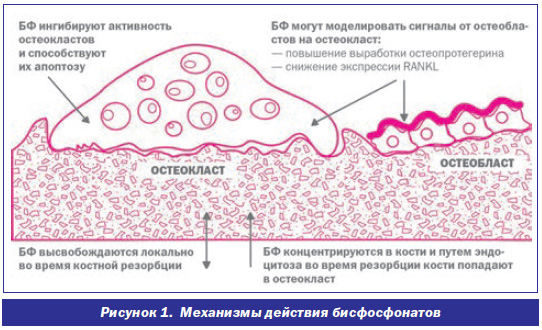
БФ способны избирательно связываться с костным минералом, что является значительным преимуществом при лечении заболеваний костной ткани. Ранние исследования продемонстрировали множественные эффекты БФ на гидроксиапатит: предупреждение выпадения кальция фосфата в осадок, замедление трансформации аморфного гидроксиапатита в кристаллический, подавление агрегации и растворения кристаллов [37]. БФ накапливаются в пластах гидроксиапатита, а в зонах костной резорбции их концентрация возрастает в несколько раз. Преимущественная аккумуляция БФ в костной ткани обеспечивает их тесный контакт с остеокластами. В период костной резорбции БФ, вероятно, подвергаются эндоцитозу наряду с другими продуктами костной резорбции. Азотосодержащие БФ подавляют активность фермента мевалонового пути — ФПС, нарушая таким образом обменные процессы остеокласта (пренеляцию белков и синтез малых молекул), разрывая сцепление клетки с костной поверхностью и ускоряя апоптоз [35, 37] (рис.1).
Поскольку зрелые многоядерные остеокласты формируются путем слияния мононуклеарных предшественников гемопоэтического происхождения, БФ могут блокировать резорбцию костной ткани, препятствуя созреванию и дифференциации остеокластов, в дополнение к их прямому воздействию на зрелые клетки [12, 23]. Целенаправленное воздействие на остеокласты обусловливает замедление костной резорбции, изменение баланса костного ремоделирования в пользу формирования костной ткани. Кроме того, имеются данные о способности БФ увеличивать выживаемость остеоцитов, что способствует уменьшению частоты активации и предупреждению потери костной ткани у женщин в постменопаузе [31]. Помимо антирезорбционного действия, БФ обладают рядом анаболических эффектов, поскольку блокируют апоптоз остеобластов и остеоцитов и стимулируют образование новой кости [35].
Современные аминобисфосфонаты рассматриваются как препараты первой линии в лечении прежде всего постменопаузального остеопороза, а также остеопороза у мужчин и глюкокортикоидиндуцированного. Постменопаузальный ОП связан с ускоренной потерей костной массы (костной резорбцией) у женщин после прекращения менструаций, в результате дефицита эстрогенов. Именно на процесс костной резорбции в большей мере оказывают влияние бисфосфонаты. Завершенные многочисленные многоцентровые двойные слепые рандомизированные исследования обеспечили достойную и надежную базу в отношении эффективности БФ при постменопаузальном ОП и в отношении профилактики остеопороза, основанную на замедлении резорбции костной ткани и остановке потери минеральной плотности костной ткани [13].
Одним из известных и широко используемых БФ является ибандроновая кислота (ибандронат, Бонвива®), которая с успехом используется для лечения и профилактики остеопороза более чем в 60 странах мира, в том числе в странах Европейского сообщества и США [7].
Наиболее известной формой препарата являются таблетки 150 мг с приемом 1 раз в месяц. Ибандронат является пока единственным БФ, который при ежемесячном приеме приводит к восстановлению адекватного костного обмена, увеличению минеральной плотности костной ткани и прочности кости, снижает риск позвоночных и внепозвоночных переломов в группе больных высокого риска. Совсем недавно в Украине появилась инъекционная форма ибандроновой кислоты — предварительно наполненный шприц, который содержит 3 мг ибандроновой кислоты, для введения 1 раз в 3 месяца.
Оценка безопасности и эффективности ибандроновой кислоты продемонстрирована в ряде исследований — BONE (oral iBandronate Osteoporosis vertebral fracture trial in North america and Europe), MOPS (Monthly Oral Pilot Study), MOBILE (the Monthly Oral iBandronate In LadiЕs), DIVA (Dosing IntraVenous Administration), BALTO (iBandronate versus ALendronate Trial in Osteoporosis), многочисленных экспериментальных и клинических исследованиях. Особый интерес представляют данные исследований на животных, показавшие, что терапевтическая эффективность ибандроновой кислоты определяется кумулятивной дозой за определенный период, а не частотой назначения [9, 11]. Затем был проведен целый ряд клинических исследований по изучению влияния различных доз ибандроновой кислоты на минеральную плотность кости, уровень биохимических маркеров, риск развития новых переломов и переносимость препарата, продемонстрировавших высокую эффективность и безопасность препарата у человека.
Целью рандомизированного исследования BONE была оценка антифрактурной эффективности ежедневного приема ибандроновой кислоты в дозе 2,5 мг внутрь и прерывистого режима терапии [14]. Так, уже первые одногодичные исследования показали положительный эффект от применения препарата в дозе 2,5 мг/сут на минеральную плотность кости как в позвоночнике, так и в проксимальном отделе бедра (прирост МПК составил 4,6–5 и 1,3–3 % соответственно). Через 3 года после начала лечения при ежедневном приеме ибандроновой кислоты значительно снижалась частота новых переломов позвонков по сравнению с плацебо (4,7 против 9,6 %; p = 0,0003). По сравнению с плацебо риск развития нового перелома позвонков в группе ежедневной терапии уменьшался на 62 % (p = 0,0006).
MOPS представляло собой рандомизированное двойное слепое плацебоконтролируемое исследование, при котором оценивался эффект различных доз (50, 100 и 150 мг) ибандроновой кислоты на показатели костной резорбции при приеме 1 раз в месяц у женщин в постменопаузе [32, 33]. При сопоставлении результатов исследований MOPS и BONE установлено, что дозы препарата 100 и 150 мг 1 раз в месяц приводят к такому же повышению уровня МПК, как и при ежедневном пероральном приеме 2,5 мг ибандроновой кислоты.
Демонстрация позитивного и значительного влияния месячной дозы 150 мг ибандроновой кислоты на показатели костной резорбции в исследовании MOPS инициировала следующее широкомасштабное исследование — MOBILE [26]. В исследовании MOBILE первичной конечной точкой при оценке эффективности были изменения показателей МПК поясничных позвонков через 1 год лечения по сравнению с исходными данными. Вторичные конечные точки включали динамику МПК поясничных позвонков через 2 года, МПК проксимального отдела бедренной кости через 1 и 2 года терапии, маркеры костного обмена (СТХ сыворотки крови) через 1 и 2 года. Через 1 год было отмечено повышение МПК поясничного отдела позвоночника относительно начального уровня на 4,3 % при приеме 50/50 мг ибандроновой кислоты, на 4,1 % — при приеме 100 мг и на 4,9 % — при ежемесячном приеме 150 мг ибандроновой кислоты, а также на 3,9 % — при ежедневном приеме 2,5 мг. Следовательно, наиболее эффективным оказался ежемесячный прием 150 мг ибандроновой кислоты. Показательно, что повышение МПК, установленное через 1 год терапии, было подтверждено и при анализе 2летних результатов. Таким образом, в исследовании были продемонстрированы преимущества дозы 150 мг ибандроновой кислоты 1 раз в месяц по сравнению с дозой 2,5 мг 1 раз в день.
Возможность использования ибандроновой кислоты для лечения постменопаузального остеопороза в виде внутривенных инъекций было исследовано в нескольких программах. Последним стало 2летнее исследование DIVA [16], которое продемонстрировало сопоставимость влияния ибандроновой кислоты на МПК и костные маркеры при различных способах введения: в/в 2 мг каждые 2 мес., в/в 3 мг каждые 3 мес. по сравнению с 2,5 мг ежедневно перорально. Через 1 год МПК поясничного отдела позвоночника возросла в группе ежедневного приема 2,5 мг ибандроновой кислоты на 3,8 %, при в/в введении 2 мг каждые 2 мес. — на 5,1 % и на 4,8 % при в/в введении ежеквартально 3 мг ибандроновой кислоты. В целом внутривенное введение ибандроновой кислоты 1 раз в 2 или 3 месяца продемонстрировало лучшее влияние на показатели МПК и маркеры резорбции, чем ежедневный прием препарата. Именно в исследовании DIVA показано, что внутривенное введение ибандроновой кислоты является эффективным, хорошо переносится и представляет собой альтернативу пероральной форме препарата [18].
Результаты метаанализа 2 рандомизированных клинических исследований (MOBILE и DIVA) [16, 32], представленные весной 2007 года на конгрессе Европейской противоревматической лиги, позволили независимым экспертам сформулировать концепцию годовой кумулятивной дозы ибандроновой кислоты: риск позвоночных и внепозвоночных переломов снижается при достижении определенной кумулятивной дозы, что для ибандроната составляет 5,5 мг в год с учетом его абсорбции. Итак, назначая ибандроновую кислоту 1 раз в месяц для лечения постменопаузального ОП, практикующий врач может быть уверен в эффективности терапии (годовая кумулятивная доза — 10,8 мг), поскольку у 9 из 10 пациенток, получавших данный препарат, отмечен прирост МПК поясничной области и бедренной кости [21]. На основании результатов исследования DIVA ибандроновая кислота внутривенно в дозе 3 мг ежеквартально была выбрана для лечения постменопаузального ОП в США и Европе [10].
Продемонстрированные преимущества БФ, в частности ибандроновой кислоты, их эффективность, к сожалению, не в полной мере реализуются в реальной клинической практике, что не позволяет существенно снизить количество переломов. Одна из основных проблем недостаточной эффективности терапии — низкая приверженность пациентов к назначенному лечению в связи с плохой их осведомленностью о заболевании и его последствиях. Проблема низкой приверженности больных к лечению актуальна и при других хронических заболеваниях. Так, до 50 % пациентов с артериальной гипертензией, бронхиальной астмой, атеросклерозом с гиперлипидемией, сахарным диабетом, эпилепсией самостоятельно прерывают лечение, назначенное врачом. Считается, что низкая приверженность является главной причиной снижения терапевтического эффекта, что существенно повышает вероятность развития осложнений основного заболевания, ведет к снижению качества жизни больных и увеличению затрат на лечение [41]. Под приверженностью к лечению понимают длительность и правильность соблюдения рекомендаций врача по приему лекарственных средств, диете и изменению стиля жизни в целях коррекции модифицируемых факторов риска болезни. Среди причин низкой приверженности к лечению традиционно первые места занимают такие факторы, как неудобство приема препаратов и побочные эффекты, а также высокая цена. Таким образом, возможность урежения приема препарата, удобство приема и низкая частота побочных эффектов являются важными составляющими приверженности пациентов к лечению, а значит, достижения оптимальных результатов лечения.
Лечебные стратегии остеопороза предполагают длительную, иногда до 5 лет, беспрерывную терапию антиостеопоротическими препаратами. Прерывание лечения, неполное соблюдение назначений, пропуск приема таблеток, т.е. низкая комплаентность, обусловливают недостаточный прирост МПК и сохранение высокого риска переломов. А это подрывает веру пациента в эффективность терапии остеопороза, в возможность предотвращения переломов, во врачебные назначения и ведет к дальнейшему снижению комплаентности.
При приеме БФ неудобства, связанные с соблюдением лечебных назначений, состоят в необходимости воздерживаться от завтрака до приема препарата (прием за 60 мин до первого приема пищи в случае таблетированной формы ибандроновой кислоты), необходимости находиться в вертикальном положении определенное время после приема БФ, а также в риске развития побочных эффектов со стороны верхних отделов желудочнокишечного тракта (ЖКТ). Поэтому уменьшение частоты приема БФ без снижения их эффективности, а также парентеральные формы являются чрезвычайно перспективными и важными стратегическими направлениями в лечении остеопороза, поскольку позволяют повысить приверженность пациентов к лечению при сохранении его эффективности. Для решения этой проблемы производители БФ пошли по пути уменьшения кратности приема пероральных форм препаратов. Например, применение БФ 1 раз в неделю и реже уменьшало частоту поражения ЖКТ по сравнению с ежедневным приемом, кроме того, увеличивался процент получавших лечение в течение 1го года [15]. Несмотря на то, что внедрение в клиническую практику режима еженедельного приема БФ привело к повышению показателей приверженности к терапии, они, тем не менее, оставались субоптимальными.
Оценка предпочтений пациенток по поводу режимов лечения БФ (1 раз в месяц или в неделю) была проведена в ходе двух открытых рандомизированных многоцентровых исследований — BALTO I и BALTO II [19, 22]. Сначала в течение 3 месяцев пациентки получали ибандроновую кислоту дозе 150 мг 1 раз в месяц, а в течение последующих 3 месяцев — по 70 мг алендроната 1 раз в неделю или наоборот. Первичная цель исследования BALTO I состояла в выяснении предпочтения режима приема препарата 1 раз в неделю или 1 раз в месяц и достигалась путем анкетирования пациенток в конце исследования. Кроме того, оценивалось удобство режимов терапии 1 раз в месяц или в неделю. Результаты анкетирования явственно продемонстрировали, что большинство женщин отдали предпочтение более редкому режиму дозирования (71 против 29 %, Р < 0,0001). Другое исследование — BALTO II, проводившееся по аналогичному плану в Америке и Европе, подтвердило результаты предыдущего исследования. Свои предпочтения выразили 93,1 % исследуемых женщин, причем большинство из них (70,6 %) предпочли ежемесячный прием ибандроновой кислоты еженедельному приему алендроната (Р < 0,0001).
Дальнейшее урежение приема препаратов при сохранении их антипереломной активности почти полностью решает проблему комплаентности и недисциплинированности пациентов. В этом плане особое место занимают препараты с парентеральным способом введения. Вопервых, введение препарата происходит под контролем врача, что создает уверенность в получении полной и адекватной дозы препарата пациентами, вовторых, отсутствие влияния на желудочнокишечный тракт создает возможность приема препарата у пациентов с эрозивноязвенной патологией его верхних отделов.
Таким образом, преимущества внутривенного введения ибандроновой кислоты — увеличение интервала между введениями до 3 мес., независимость от приема пищи и положения тела после приема препарата, возможность безопасного использования у пациентов с патологией желудочнокишечного тракта. Форма для внутривенного введения особенно предпочтительна у пациентов с низкой приверженностью к лечению и у тех, кто не может соблюдать требования к приему таблетированных форм, в том числе изза развития побочных эффектов [3]. Препарат вводится в виде короткой (15–30 с) болюсной инъекции. Внутривенная форма ибандроновой кислоты имеет 100% биодоступность в отличие от пероральной формы (0,6 %) и может назначаться реже для обеспечения такой же или большей общей годовой кумулятивной дозы [8].
Еще одной проблемой эффективного лечения остеопороза является использование безопасных препаратов с благоприятным профилем переносимости, особенно учитывая ту ситуацию, что остеопороз развивается у пациентов старших возрастных групп, имеющих, как правило, сопутствующую патологию, прежде всего сердечнососудистые заболевания (ССЗ) [6].
По данным зарубежных публикаций, у 70 % пациентов, перенесших остеопоротический перелом шейки бедра, имеется патология сердечнососудистой системы [17]. Следует подчеркнуть, что ряд авторов вообще относят потерю МПК к категории предикторов ССЗ, а именно атеросклеротического поражения коронарных артерий [24], указывая на многочисленные общие факторы риска. У пациентов со сниженной МПК чаще наблюдается повышение уровня липидов, развивается более тяжелый коронарный атеросклероз, существенно повышается риск инсульта и инфаркта миокарда [38–40]. По данным P. van der Recke и соавт. [39], у женщин в ранний период постменопаузы снижение МПК на 1 SD от пиковой костной массы ассоциируется с увеличением риска общей летальности на 43 % (относительный риск (ОР) = 1,4; Р < 0,05) и преждевременной смерти от сердечнососудистой патологии в течение 17 лет наблюдения (ОР = 2,3; Р < 0,05). У женщин старше 70 лет аналогичное снижение МПК также коррелирует с увеличением риска сердечнососудистой летальности (ОР = 1,8). Остеопоротические переломы позвоночника оказались независимым фактором риска летальности в связи с заболеваниями сердечнососудистой системы (ОР = 2,0). Поэтому кардиоваскулярной безопасности противоостеопоротических препаратов в данное время уделяется особое внимание, особенно в связи с выявленным риском нефатальных сердечнососудистых осложнений при применении стронция ранелата.
Согласно заключению Европейской комиссии по безопасности препаратов (ЕМА. Европейское Медицинское Агентство. Рекомендации по ограничению применения стронция ранелата. Прессрелиз 25.04.2013; EMA/258269/2013) противопоказаниями к назначению стронция ранелата являются:
- установленная (перенесенный инфаркт миокарда) ишемическая болезнь сердца (ИБС), имеющая место в настоящее время, или ИБС в анамнезе, заболевания периферических артерий и/или цереброваскулярная болезнь;
- неконтролированная артериальная гипертензия.
Лечение стронция ранелатом должно быть прекращено, если у пациента развивается ИБС, заболевания периферических артерий или заболевания сосудов головного мозга или же гипертония становится неконтролируемой [20].
Необходимо подчеркнуть, что терапия БФ является достаточно безопасной. При приеме БФ внутрь могут возникать желудочнокишечные расстройства, однако большинство аминобисфосфонатов лишены этих побочных эффектов и редко могут вызвать эзофагит. Частота гастроинтестинальных побочных эффектов значительно снижается с урежением приема таблетированных БФ. Инфузии аминобисфосфонатов способны индуцировать гриппоподобный синдром с повышением температуры тела, миалгией и оссалгиями, но выраженность этих реакций уменьшается при последующих введениях препаратов, а гриппоподобный синдром легко управляется соответствующей психологической подготовкой пациентов и применением нестероидных противовоспалительных препаратов или парацетамола.
У пациентов с онкологическими заболеваниями, которым вводили внутривенно большие дозы памидроната или золендроната, описано развитие остеонекроза нижней челюсти. Подчеркивается также, что данное осложнение более свойственно внутривенным формам БФ, назначаемым с целью лечения костных метастазов при онкопатологии. Частота развития данного осложнения является низкой (порядка 1 на 100 тыс. случаев), а при использовании невысоких доз БФ (как при остеопорозе) оно не возникает вообще [27, 30]. Низкие дозы БФ, используемых при остеопорозе, не демонстрируют причинноследственной связи с развитием остеонекроза челюсти. Анализ научных исследований позволил выделить факторы риска развития остеонекроза нижней челюсти при длительном применении БФ: пожилой возраст пациентов (старше 60 лет), женский пол, предыдущее инвазивное стоматологическое лечение, прием глюкокортикоидов, метастатическое поражение скелета. Однако четкой связи между пероральным приемом БФ и развитием остеонекроза челюсти не установлено [32].
Еще одним побочным явлением длительного применения БФ, описанным в последнее время, являются атипичные переломы бедра [1, 4, 29]. Однако данное осложнение развивается только при длительном (более 5 лет) приеме БФ, является чрезвычайно редким, а также не окончательно установлена связь длительной терапии БФ с развитием субтрохантерных переломов бедренной кости [1]. Последние рекомендации по рациональному использованию БФ указывают на возможность 5летнего приема БФ без риска развития атипичных переломов бедра; в последующем необходима оценка риска переломов и перерыв в лечении — «лекарственные каникулы» [34], но это не касается пациентов с высоким риском переломов, для которых рекомендуется дальнейший прием БФ под контролем маркеров резорбции костной ткани [28].
Таким образом, в результате последних исследований, в том числе продленных исследований MOBILE и DIVA, подтверждена эффективность двух лекарственных форм ибандроновой кислоты (1 таблетка ежемесячно и 1 внутривенная инъекция ежеквартально) в виде продолжающегося прироста МПК и сохраняющегося низкого уровня маркеров костной резорбции [3, 7]. Главными преимуществами ибандроновой кислоты являются возможность интермиттирующего перорального применения и парентерального введения, что рационально как с медицинских, так и с фармакоэкономических позиций. Терапия ибандроновой кислотой эффективна, имеет благоприятный профиль безопасности и удобна для пациентов, что повышает их приверженность к лечению.
Список литературы находится в редакции