Журнал «Травма» Том 14, №2, 2013
Вернуться к номеру
Вплив системного остеопорозу на репаративну регенерацію кісткової тканини
Авторы: Поворознюк В.В., Макогончук А.В., ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України», м. Київ, Національний медичний університет імені М.І. Пирогова, м. Вінниця
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Експериментальне дослідження проведене на 40 статевозрілих самицях щурів породи Vistar віком 6 місяців. Тварини були розподілені на дві групи по 20 осіб у кожній. Щурам 1-ї групи було зроблено двобічну оваріоектомію. Щурам 2-ї (контрольної) групи оваріоектомію не проводили. Після оваріоектомії за тваринами спостерігали впродовж 4 міс., необхідних для розвитку моделі постменопаузального остеопорозу у тварин основної (1-ї) групи. Потім тваринам обох груп здійснювали дірчастий перелом дистального метаепіфізу стегнової кістки. Застосовувалися такі методи дослідження: двохенергетична рентгенівська денситометрія, гістоморфологічне дослідження, біомеханічне дослідження регенерату. Встановлено, що наявність системного остеопорозу в експериментальних тварин не впливає на перебіг репаративного процесу на ранній та середній стадіях утворення мозолі, однак спричиняє вірогідне зниження якісних та кількісних показників регенерату на стадіях формування та мінералізації остеоїду порівняно з тваринами контрольної групи.
Экспериментальное исследование проведено на 40 половозрелых самках крыс породы Vistar в возрасте 6 месяцев. Животные были разделены на две группы по 20 особей в каждой. Крысам 1-й группы была сделана двусторонняя овариоэктомия. Крысам 2-й группы овариоэктомию не проводили. После овариоэктомии за животными наблюдали в течение 4 мес., необходимых для развития модели постменопаузального остеопороза у животных основной (1-й) группы. Затем животным обеих групп осуществляли дырчатый перелом дистального метаэпифиза бедренной кости. Применялись следующие методы исследования: двухэнергетическая рентгеновская денситометрия, гистоморфологическое исследование, биомеханическое исследование регенерата. Установлено, что наличие системного остеопороза у экспериментальных животных не влияет на течение репаративного процесса на ранней и средней стадиях образования мозоли, однако вызывает достоверное снижение качественных и количественных показателей регенерата на стадиях формирования и минерализации остеоида по сравнению с животными контрольной группы.
An experimental study was carried out on 40 sexually mature Vistar females rats aged 6 months. Animals were divided into two groups of 20 subjects each. Rats of 1st group underwent bilateral spaying. Rats from 2nd group hadn’t been spayed. After spaying the animals were observed for 4 months, required for the development of a model of postmenopausal osteoporosis in animals of main (1st) group. Then distal perforating metaepiphyseal fracture of the femur was done to both groups of animals. The following methods of investigation had been used: dual-energy X-ray densitometry, histomorphologic study, biomechanical studies of the regenerate. It is found that the presence of systemic osteoporosis in experimental animals has no effect on the clinical course of reparative process in the early and middle stages of callus formation, but likely causes reduction of qualitative and quantitative indicators of the regenerate in stages of formation and mineralization of osteoid compared with animals of the control group.
регенерація кісткової тканини, оваріоектомія, остеопороз.
регенерация костной ткани, овариоэктомия, остеопороз.
regeneration of bone tissue, spaying, osteoporosis.
Остеопороз — це системне захворювання скелета, що характеризується низькою кістковою масою, змінами мікроархітектоніки кістки, підвищеною її ламкістю та збільшенням ризику виникнення переломів [13]. Поширеність остеопорозу в США становить понад 10 млн чоловік, а вартість лікування остеопорозу та його наслідків — щорічно близько 13,5 млрд доларів [17]. У світі близько 200 млн чоловік отримують остеопоротичні переломи [3]. Остеопороз — переважно вікозалежне захворювання. Згідно з демографічними прогнозами, до 2025 року частка людей похилого віку зросте на 69 % серед жінок та на 89 % серед чоловіків, що спричинить зростання кількості переломів шийки стегнової кістки до 1,8 млн на рік [7]. Остеопороз не тільки спричиняє виникнення низькоенергетичних переломів, але й може впливати на перебіг загоєння переломів у випадку високоенергетичної травми. Лікування переломів і в одному, і в другому випадках є досить складною справою, враховуючи низьку кісткову масу в зоні перелому та ризик нестабільності фіксаторів. Так, кількість випадків незрощення та нестабільності металоконструкцій при метаепіфізарних переломах довгих трубчастих кісток на тлі системного остеопорозу становить 10 %, а частота пов’язаних із цим повторних оперативних втручань сягає 23 % [15, 16]. Зниження інтенсивності регенераторних процесів деякі дослідники пов’язують лише з віком [14]. Порушення формування повноцінної кісткової мозолі в похилому віці продемонстровані в поодиноких експериментальних дослідженнях [5], проте дані про вплив безпосередньо остеопорозу на регенерацію переломів кісток нечисленні та суперечливі [2, 8]. З огляду на це проблема репаративної регенерації переломів кісток на тлі системного остеопорозу набуває надзвичайної актуальності. А відтак метою нашого дослідження стало вивчення репаративної регенерації кісткової тканини на моделі перелому стегнової кістки в експерименті залежно від структурнофункціонального стану скелета.
Матеріал та методи дослідження
Експериментальне дослідження проведено на 40 статевозрілих самицях щурів породи Vistar віком 6 місяців. Дослідження проводилося на базі відділу клінічної фізіології та патології опорнорухового апарату ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України». Щурі утримувались у стандартних умовах віварію при природному освітленні, на стандартному раціоні харчування при вільному доступі до їжі (стандартний гранульований комбікормконцентрат) та води. Експеримент на щурах проводили відповідно до правил Європейської конвенції щодо гуманного ставлення до тварин. Оперативні втручання проводили під інгаляційним ефірним наркозом [4].
Тварини були розподілені на дві групи по 20 осіб у кожній. Щурам 1ї групи було зроблено двобічну оваріоектомію. Щурам 2ї групи оваріоектомію не проводили. Після оваріоектомії за тваринами спостерігали впродовж 4 місяців, необхідних для розвитку моделі постменопаузального остеопорозу у тварин основної (1ї) групи. Потім у тварин обох груп проводили моделювання дірчастого перелому дистального метаепіфізу стегнової кістки задньої кінцівки шляхом перфорації шилом. Додаткової зовнішньої фіксації травмованої кінцівки не виконували.
З метою дослідження зміни щільності кісткової тканини та верифікації розвитку остеопорозу в усіх групах досліджуваних тварин до початку експерименту та через 4 місяці з моменту проведення оваріоектомії визначали мінеральну щільність кісткової тканини (МЩКТ) із використанням програми «Експериментальні тварини» на двохенергетичному рентгенівському денситометрі Prodigy (GE Medical systems, Lunar, model 8743, 2005).
Динаміку МЩКТ обчислювали за формулою:
DМЩКТ (%) = (DМЩКТ/МЩКТпочатк.)*100 %,
де DМЩКТ — різниця абсолютних показників мінеральної щільності кісткової тканини до та через 4 міс. після оваріоектомії.
Тварин виводили з експерименту на 10ту та 30ту добу після перелому шляхом передозування ефіру.
Патоморфологічне дослідження здійснювали комплексом гістологічних, гістохімічних, а також морфомеричних методик, адекватних меті дослідження.
Мікроморфометричне дослідження діафіза і проксимального епіфіза великогомілкових кісток проводили за допомогою мікрометра окулярного гвинтового МОГ115х (ДСТ 786556) і окулярної вимірювальної сітки мікроскопа біологічного дослідницького МБД3. Калібрування вимірювальних приладів виконували за допомогою міліметрового відрізка (ДСТ2 07513552).
При гістоморфометрії оцінювали ширину трабекул, а також об’ємне співвідношення клітинних елементів і міжклітинної речовини в губчастій, компактній кістковій тканині та в зоні регенерату.
Визначення біомеханічних властивостей регенерату проводилося за допомогою мікротвердомера ПМТ3 [1].
Гістоморфометричні та біомеханічні дослідження проводилися на кафедрі нормальної анатомії Луганського державного медичного університету під керівництвом професора В.І. Лузіна.
Статистичний аналіз проводили з визначенням параметричних (критерій Стьюдента, однофакторний дисперсійний аналіз ANOVA) та непараметричних критеріїв (кореляційний аналіз за Спірменом). При аналізі використовували пакети програм Microsoft Excel та Statistiсa 6.0.
Результати та обговорення
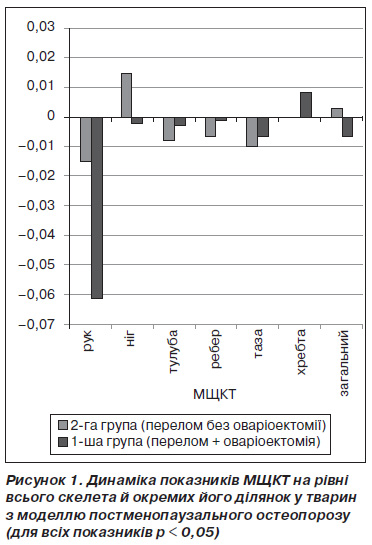
Згідно з даними двохенергетичної рентгенівської денситометрії, через 4 місяці після двобічної оваріоектомії у тварин основної групи спостерігалося вірогідне зниження мінеральної щільності кісткової тканини практично в усіх ділянках скелета порівняно з представниками контрольної групи (рис. 1), що дозволило нам вивчати репаративні процеси на тлі вірогідно встановленого остеопорозу.
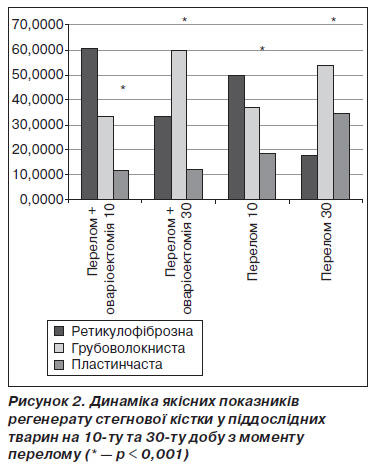
На 10ту добу після перелому в регенераті переважала ретикулофіброзна тканина з помірним вмістом грубоволокнистої кістки та невеликою кількістю пластинчастої. При цьому суттєвих відмінностей в якості регенерату між тваринами основної та контрольної груп не спостерігалося (рис. 2). Біомеханічне дослідження регенерату в дані строки також не виявило вірогідної відмінності між тваринами з оваріоектомією та без такої. У цьому плані отримані нами результати не збігаються із даними Wang et al. та Qiaoetal, які показали зниження мінеральної щільності кісткової мозолі в середньому періоді регенерації переломів у оваріоектомованих щурів [12, 18].
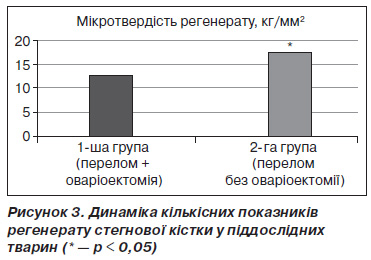
Ключову роль у формуванні повноцінного регенерату відіграє пластинчаста кісткова тканина, з якої складається кісткова мозоль у довгих трубчастих кістках, аж до перебудови її у компактну кістку. Якщо ця пластинчаста кістка є естрогенчутливою, то логічно припустити, що оваріоектомія погіршить процеси репарації кістки після перелому. Однак прямі експериментальні докази даного припущення нечисленні та суперечливі [10, 11]. На 30ту добу після перелому ми спостерігали вірогідне зростання частки пластинчастої кістки в регенераті у представників контрольної групи та вірогідно кращі біомеханічні властивості кісткової мозолі у тварин без оваріоектомії (рис. 3).
Отримані нами дані суперечать працям деяких дослідників, в яких заперечується вплив остеопорозу, спричиненого оваріоектомією [9] та тривалою іммобілізацією [6], на перебіг процесів репаративної регенерації довгих трубчастих кісток нижніх кінцівок.
Висновки
Таким чином, наявність системного остеопорозу у експериментальних тварин не впливає на перебіг репаративного процесу на ранній та середній стадіях утворення мозолі, проте спричиняє вірогідне зниження показників мікротвердості регенерату, а також погіршенні його якості, що виражалося у переважанні в його складі ретикулофіброзної та грубоволокнистої кісткової тканини на стадіях формування та мінералізації остеоїду порівняно з тваринами контрольної групи.
- Лузин В.И., Астраханцев Д.А. Методика определения микротвердости минерализованных тканей зубочелюстного сегмента нижней челюсти в эксперименте // Український морфологічний альманах. — 2005. — Т. 3, № 3. — С. 4244.
- Giannoudis P., Tzioupis C., Almalki T., Buckley R. Fracture healing in osteoporotic fractures:Is it really different? A basic science perspective // Injury, Int. J. Care Injured. — 2007. — 38S1. — P. 9099.
- Dreinhofer K.E. Multinational survey of osteoporotic fracture management // Osteoporos Int. — 2005 — 16, Suppl. 2. — P. 4453.
- Egermann M.J., Schneider G.E. Animal models for fracture treatment in osteoporosis // Osteoporos Int. — 2005 — 16. — P. 129138.
- Ekeland A., Engesoeter L.B., Langeland N. Influence of age on mechanical properties of healing fractures and intact bones in rats // Acta Orthop. Scand. — 1982. — 53. — P. 527534.
- Garland D. Clinical observations on fractures and heterotopic ossification in the spinal cord and traumatic brain injured populations // Clin. Orthop. — 1988. — 233. — P. 86101.
- Gullberg B., Johnell O., Kanis J.A. Worldwide projections for hip fracture // Osteoporos Int. — 1997. — P. 407413.
- Lill C.A., Fluegel A.K., Schneider E. Sheep model for fracture treatment in osteoporotic bone: a pilot study about different induction regimens // J. Orthop. Trauma. — 2000. — 14. — P. 559566.
- Melhus G., Solberg L.B., Dimmen S., Madsen J.E. et al. Experimental osteoporosis induced by ovariectomy andvitamin D deficiency does not markedly affect fracture healing in rats // Acta Orthopaedica. — 2007. — 78. — 3. — P. 393403.
- Meyer R.A. Jr., Tsahakis P.J., Martin D.F. Age and ovariectomy impair both the normalization of mechanical properties and the accretion of mineral by the fracture callus in rats // J. Orthop. Res. — 2001. — 19. — P. 42835.
- Pape H.C., Hildebrand F., Krettek C., Green J., Giannoudis P.V. Experimental background — review of animal studies // Injury, Int. J. Care Injured. — 2006. — 37S. — P. 2538.
- Qiao L., Xu K.H., Liu H.W., Liu H.Q. Effects of ovariectomy on fracture healing in female rats // Sichuan Da Xue Xue Bao Yi Xue Ban. — 2005. — 36. — P. 108111.
- Richard D.,Wasnich M.D. Epidemiology of osteoporosis // Primer on the Metabolic Bone Diseases and Disorders of Mineral Metabolism. NewYork: LippincottRaven, 1996. — P. 249251.
- Silver J.J., Einhorn T.A. Osteoporosis and aging: Current update // Clin. Orthop. — 1995. — 316. — P. 1020.
- Sterck J.G., KleinNulend J., Lips P., Burger E.H. Response of normal and osteoporotic human bone cells to mechanical stress in vitro // Am. J. Physiol. — 1998. — 274. — P. 11131120.
- Syed A.A., Agarwal M., Giannoudis P.V. et al. Distal femoral fractures: longterm outcome following stabilisation with the LISS // Injury. — 2004. — 35. — P. 599607.
- U.S. Department of Health and Human Services. Bone Health and Osteoporosis. A report of the US Surgeon General, Rockville MD. — 2004.
- Wang J.W., Li W., Xu S.W. et al. Osteoporosis influences the middle and late periods of fracture healing in a rat osteoporotic model // Chin. J. Traumatol. — 2005. — 8. — P. 111116.