Журнал «Болезни и антибиотики» 2 (05) 2011
Вернуться к номеру
Беседы с микробиологом
Авторы: Демиховская Е.В., Росток, Германия
Рубрики: Семейная медицина/Терапия, Терапия
Версия для печати
Antibiotic-stewardship — одно из актуальных направлений сотрудничества клиницистов и микробиологов с целью внедрения в повседневную клиническую практику принципов рационального использования антибиотиков. То, что постоянно обсуждается на различных научных конгрессах, где собираются вместе клиницисты, озабоченные эффективным лечением различных клинических инфекций, и микробиологи, предупреждающие клиницистов о возрастающей множественной резистентности возбудителей инфекций к антибиотикам, должно найти свое применение в каждом лечебном заведении. Для этого в Германии под патронатом самых высоких федеральных ведомств и научных обществ организованы 5-недельные курсы для врачей, микробиологов, аптекарей и других специалистов (www.antibiotic-stewardship.de).
В дословном переводе stewardship означает «сопровождение», «управление». Но если задуматься о том, что «стюардесса» происходит от того же слова и продолжить сравнение, то лечащих врачей можно представить пилотами, принимающими решение и отвечающими за жизнь пассажиров-пациентов. Микробиологи, эпидемиологи, фирмы-производители антибиотиков и аптекари — те самые «стюарды», которые организуют порядок в самолете. Конечно, любое сравнение — несовершенно, и в данном случае лечащий врач в отличие от пилота имеет более непосредственный контакт с больным, чем специалисты «сопровождающих» профессий. И все же пилоту в одиночку, без штурманов и стюардов, было бы непросто проложить правильный путь в безграничном многообразии возбудителей-микроорганизмов и антимикробных средств. Так давайте пристегнемся — и в путь, к здоровью и благополучию наших пациентов.
ESKAPE
Американское общество инфекционных болезней (Infectious Diseases Society of America — IDSA [1]) опубликовало отчет, в котором констатировалась стагнация в поисках новых антимикробных средств и назывались микроорганизмы (Bad Bugs), доставляющие клиницистам больше всего проблем, связанных с резистентностью к антибиотикам (No Drugs). Эти микроорганизмы в процессе селекции приобрели свойство ускользать — escape — от действия современных антибиотиков. Аббревиатура из первых букв названия проблемных микробов — ESKAPE — вполне соответствует их поведению в отношении антибиотиков. Наиболее активно ведется поиск эффективных антимикробных средств именно против этих микроорганизмов [2]. Огласим же весь список:
— Enterococcus faecium (VRE) — энтерококки, резистентные к ванкомицину;
— Staphylococcus aureus (MRSA) — золотистые стафилококки, резистентные к метициллину;
— Klebsiella spp. и Escherichia coli — продуценты b-лактамаз расширенного спектра действия (ESBL, extended spectrum beta-lactamases);
— Acinetobacter baumanii;
— Pseudomonas aeruginosa;
— Enterobacter spp.
Две группы возбудителей из этого списка относятся к грамположительным микроорганизмам (энтеро- и стафилококки) и пять — к грамотрицательным, из которых две (ацинетобактер и синегнойная палочка) классифицируются как неферментирующие бактерии, а остальные (клебсиеллы, кишечная палочка и энтеробактер) принадлежат к семейству Enterobacteriaceae. Кроме общего семейства, три последних упомянутых микроорганизма объединяет механизм резистентности, а именно способность синтезировать b-лактамазы расширенного спектра (ESBL). Читателям предлагаются краткий обзор литературы и практические рекомендации в отношении клинически значимых микроорганизмов — продуцентов ESBL.
ESBL-продуценты — актуальная проблема клинической инфектологии
Бета-лактамазы — b(beta)-lactamase — это ферменты, способные расщеплять b-лактамное кольцо антибиотиков, содержащих эту химическую структуру, а именно пенициллины, аминопенициллины, монобактамы, цефалоспорины, карбапенемы и др.
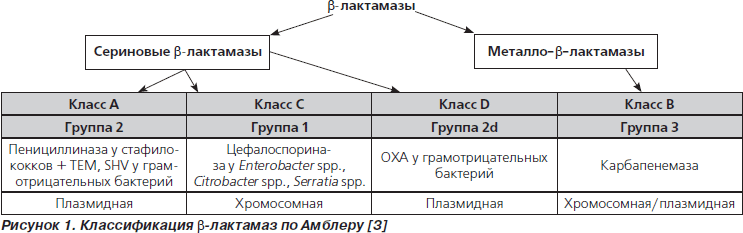
Первая b-лактамаза — пенициллиназа — была описана в 1948 г., т.е. уже через 8 лет после открытия первого антибиотика — пенициллина. b-Лактамазы широко распространены как среди грамотрицательных, так и грамположительных бактерий и обусловливают их природную резистентность в отношении b-лактамных антибиотиков. В настоящее время насчитывается свыше 500 вариантов этого фермента. Первая, но все еще актуальная классификация b-лактамаз по функциональным критериям представлена на рис. 1.
Первоначально были подробно описаны хромосомные b-лактамазы (АmpC, согласно схеме, сериновые b-лактамазы первой группы или класса С), которые обусловливали резистентность к цефалоспоринам третьего поколения. Мутантный ген, кодирующий гиперпродукцию AmpC-b-лактамаз, находится в бактериальной хромосоме и передается вертикально, то есть каждой дочерней генерации. Стабильность этого свойства, закодированного в хромосоме, привела к тому, что для борьбы с Entetrobacter spp., Citrobacter freundii, Serratia marcescens, Рseudomonas aeruginosa пришлось практически отказаться от цефалоспоринов третьего поколения, а также антибиотиков группы цефокситина и монобактамов.
В начале 80-х годов XX века появились сообщения об участившейся резистентности к цефалоспоринам III и IV поколений у клебсиелл (K.pneumoniae, K.oxytoca) [4], кишечной палочки (E.coli) и протея (Proteus mirabilis). Эта резистентность была обусловлена не хромосомным геном, а плазмидами. Плазмиды представляют собой внехромосомные кольцевые ДНК, которые реплицируются и передаются автономно, независимо от репродукции бактериальной клетки. Бактерия может иметь до нескольких десятков плазмид, которые придают ей дополнительные свойства. Передача плазмид происходит чаще всего горизонтально, то есть не дочерним клеткам, а уже существующим взрослым особям в процессе конъюгации (аналог полового акта у одноклеточных организмов). Конъюгация может осуществляться не только в пределах одного вида, но и в пределах рода и семейства. Это значит, что, например, кишечная палочка может передать свои плазмиды клебсиеллам и наоборот. Именно этот тип b-лактамаз был обозначен как ESBL.
ESBL, или b-лактамазы расширенного спектра, относятся к сериновым b-лактамазам. В настоящее время различные по структуре варианты ESBL подразделяются на 9 семейств, наиболее частыми из которых у грамотрицательных бактерий являются TEM, SHV, CTX-M и OXA.
В отличие от хромосомной AmpC плазмидные b-лактамазы (ESBL) были не способны инактивировать цефокситин и нейтрализовывались ингибиторами (клавулановой кислотой и сульбактамом). Позднее ингибитор-устойчивая плазмид-ассоциированная AmpC-b-лактамаза была найдена у клебсиеллы [5] и кишечной палочки [6].
Следующим этапом развития ESBL стала карбапенемаза — фермент, гидролизующий карбапенемы. В отличие от «классических» (класс В, группа 3), вновь описанные металло-b-лактамазы могут передаваться плазмидами, следовательно, способны к быстрому распространению [7]. Особенно громкий резонанс был вызван New-Delhi-металло-b-лактамазой (NDM), найденной у Klebsiella pneumoniae и E.coli [8]. Таким образом, пал последний оплот b-лактамных антибиотиков — карбапенемы — и исследователи заговорили о закате эры антибиотиков [9].
ESBL-продуценты — название группы грамотрицательных бактерий из разных видов и семейств, которые объединены свойством продуцировать эти ферменты. Чаще всего ESBL-продуценты встречаются среди E.coli, Klebsiella pneumoniae и Klebsiella oxytoca, но могут встречаться и у других представителей семейства Enterobacteriaceae, в частности среди Enterobacter spp., Proteus spp., Citrobacter spp., Salmonella enterica и Morganella spp.
Фенотипическое проявление действия b-лактамаз очень разнообразно, поэтому клиническая интерпретация тестирования антибиотикорезистентности ESBL-продуцентов in vitro затруднена и зачастую неоднозначна. При инвазивных инфекциях, вызванных E.coli или Klebsiella spp., вырабатывающими ESBL, описаны случаи неэффективности цефалоспоринов, к которым при лабораторном тестировании возбудитель был чувствителен или умеренно чувствителен [10].
В настоящее время под аббревиатурой ESBL подразумевается скорее не какой-либо конкретный вид b-лактамаз, а свойство множественной резистентности к антибиотикам у грамотрицательных микроорганизмов. В процессе публикации находится новая, клинически функциональная классификация различных типов резистентности энтеробактерий, которая учитывает не столько механизм и генетическую подоплеку, сколько фенотипическое проявление резистентности с указанием групп антибиотиков, потерявших свое действие в отношении соответствующих изолятов.
Лабораторная диагностика ESBL-продуцентов
По признанию специалистов, в настоящее время не существует лабораторной методики, которая бы обеспечила 100-процентную чувствительность определения ESBL-продуцентов. Любой метод определения антибиотикорезистентности требует подтверждающего теста, если на первом этапе возникло подозрение на наличие ESBL. Таким образом, речь идет о ступенчатой диагностике ESBL-продуцентов.
Первый этап представляет собой стандартный метод определения чувствительности к антибиотикам, принятый на вооружение в данной клинической микробиологической лаборатории. Чаще всего это агар-диффузионный метод (с помощью дисков или Е-тест), либо определение минимальных подавляющих концентраций (МПК) в жидкой среде.
Подозрение возникает, если тестируемый микроорганизм оказывается устойчивым или умеренно чувствительным к цефалоспоринам третьего поколения и к монобактаму (азтреонам).
В табл. 1 представлены особенности антибиотикограммы, позволяющие предположить продукцию ESBL и требующие подтверждающего теста.
Из табл. 1 видно, что, несмотря на формальные признаки чувствительности in vitro, штамм должен рассматриваться как подозрительный на наличие b-лактамаз, если зона подавления роста или МПК хотя бы одного из соответствующих антибиотиков не превышает указанных значений.
Подтверждающий тест использует способность ингибиторов b-лактамаз восстанавливать чувствительность штамма к антибиотику. Наиболее простой и доступный метод определения ESBL-продуцентов — это параллельное определение резистентности к цефотаксиму и цефтазидиму по сравнению с теми же антибиотиками, но с добавлением клавулановой кислоты (ингибитора b-лактамаз). Если обнаружена существенная разница в выраженности чувствительности хотя бы к одному из антибиотиков без добавок и с добавлением ингибитора b-лактамаз, наличие последних у бактерии можно считать доказанным. Существенной считается разница в диаметре зон подавления роста на чашках (в плотной среде) не менее 5 мм или не менее трех разведений при определении минимальной подавляющей концентрации в жидкой среде. Подтверждающий тест на чашках, называемый методом двойных дисков (Doppeldisk-Synergy-Test) благодаря наличию коммерческих дисков цефотаксима и цефтазидима с клавулановой кислотой(30/10 мкг), доступен любой бактериологической лаборатории. В основе определения чувствительности к антибиотикам с помощью современных автоматизированных систем, таких как VITEK-2 (BioMerieux) или PHOENIX (BD), лежит метод определения МПК. При этом определение b-лактамаз проводится для E.coli и Klebsiella spp. уже на первом этапе путем сравнения МПК. Проблема определения b-лактамаз у других родов микроорганизмов, а именно Enterоbacter spp., Serratia spp. и Citrobacter freundii, заключается в том, что их AmpC-b-лактамазы не чувствительны к клавулановой кислоте. Доказательством продукции AmpC-b-лактамаз является резистентность к цефокситину, к которому E.coli и Klebsiella spp. обычно чувствительны.
Резистентность к карбапенемам все еще достаточно редкое явление и сама по себе является доказательством наличия металло-b-лактамаз.
Инфекции, вызываемые ESBL-продуцентами из семейства Enterobacteriaceae
Escherichia coli
Escherichia coli — типичный представитель семейства Enterobacteriaceae, грамотрицательная палочка средних размеров, факультативный анаэроб, спор и капсул не образует. Кишечная палочка — представитель нормальной кишечной микрофлоры человека и в здоровом организме выполняет функции комменсала, то есть постоянного спутника с определенными полезными свойствами (например, синтез витамина К, колонизационная резистентность против возбудителей кишечных инфекций). Попадая в другие полости и среды организма в результате травм, а чаще всего в процессе каких-либо инвазивных медицинских процедур (операция, катетеризация и т.д.), кишечная палочка вызывает воспаление (цистит, перитонит, раневая инфекция, сепсис, менингит). При этом кишечная палочка не обязательно изначально имеет какие-либо особые факторы вирулентности. В условиях активного обмена плазмидами очень быстро происходит селекция полезных свойств, позволяющих кишечной палочке выжить в необычных условиях, включая присутствие антибиотиков.
Кишечная палочка — самый изученный и все же самый непредсказуемый и убиквитарный микроорганизм в инфекционной и неинфекционной патологии. Именно кишечная палочка является наиболее частым клиническим изолятом у пациентов амбулаторных и стационарных отделений согласно интегральным данным 9 крупных клинических лабораторий Германии (Нижняя Саксония, АРМИН) (www.nlga.niedersachsen.de). Второе и третье места делят коагулазонегативный и золотистый стафилококки.
Кроме безобидной кишечной палочки-комменсала, которая становится возбудителем «поневоле», существуют патогенные типы кишечной палочки, которые, подобно возбудителям классических кишечных инфекций (сальмонеллы, шигеллы и т.д.) изначально обладают факторами вирулентности, передаются фекально-оральным путем и вызывают чаще всего гастроэнтероколиты. Самая печально известная патогенная кишечная палочка — это энтерогеморрагическая E.coli (EHEC), вызвавшая крупнейшую за всю историю Германии эпидемию гемолитико-уремического синдрома (ГУС) как осложнения ЕНЕС-инфекции. В течение двух месяцев (май — июнь 2011 г.) в Германии заболели около 4 тысяч человек, у 720 из них гастроэнтерит осложнился гемолитико-уремическим синдромом, 30 человек скончались*. Особенностью энтерогеморрагической E.coli в Германии был экзотический серотип (О104: Н4), не входивший в наборы диагностических сывороток для рутинной диагностики, и большое количество плазмид, придававших E.coli дополнительные факторы патогенности. Одна из таких плазмид кодировала b-лактамазу расширенного спектра (ESBL), что обусловливало резистентность к цефалоспоринам III поколения. Несмотря на титанические усилия специалистов общественного здравоохранения Германии и Европы, удалось установить лишь фактор передачи инфекции, но не ее источник.
Но об этом на страницах других журналов…
Klebsiella spp. (K.pneumoniae, K.oxytoca)
Патогенные свойства клебсиелл (в отличие от комменсала кишечной палочки) с момента их открытия в XIX веке не вызывали сомнения, так как они были выделены из тканей больных, погибших от деструктивной пневмонии. Клебсиеллезные пневмонии (по старой терминологии — пневмонии, вызванные палочкой Фридлендера) чаще возникают у пожилых ослабленных больных. Широко известна клебсиеллезная инфекция новорожденных (чаще всего тяжелый гастроэнтерит). Клебсиеллы могут встречаться при любых заболеваниях ЛОР-органов, включая отиты и синуситы. Они бывают причиной тяжелейших септических состояний у реанимационных больных [12], выделяются у больных с пиелонефритами. Поскольку клебсиеллы часто входят в состав кишечной микрофлоры, их обнаруживают в брюшной полости при перитонитах. Подобно кишечной палочке Klebsiella pneumoniae, как типичный представитель рода клебсиелл, не всегда априори обладает антибиотикорезистентностью, но легко приобретает это свойство посредством плазмид. Большой резонанс в исследовательских кругах вызвало обнаружение плазмидо-ассоциированной карбапенемазы у Klebsiella pneumoniae [5, 8]. Особого внимания заслуживает еще один представитель рода клебсиелл — К.oxytoca — который, хотя и уступает K.pneumonie по патогенному действию, но, выступая в роли оппортуниста, может вызывать госпитальные пневмонии, инфекции мочевыводящих путей и даже смертельные септические состояния. Главной причиной является почти постоянная множественная антибиотикорезистентность К.oxytoca, включающая карбапенемы, амикацин и фторхинолоны.
Enterobacter spp. (E.cloacae, E.aerogenes)
Возбудители из рода энтеробактер встречаются гораздо реже, чем патогены из рода кишечной палочки, но сопоставимы по частоте с клебсиеллами. Они широко распространены в природе и входят в состав кишечной микрофлоры человека и животных. Вопрос их патогенности для человека долго оставался открытым. В настоящее время признано, что энтеробактеры выступают как оппортунисты на фоне длительной антибиотикотерапии и встречаются при тяжелых госпитальных инфекциях (сепсис, пневмония, в реанимации, перитониты, тяжелая уроинфекция). Кроме природных хромосомных b-лактамаз, они нередко имеют плазмидные ESBL и карбапенемазы [13].
Распространенность продуцентов b-лактамаз
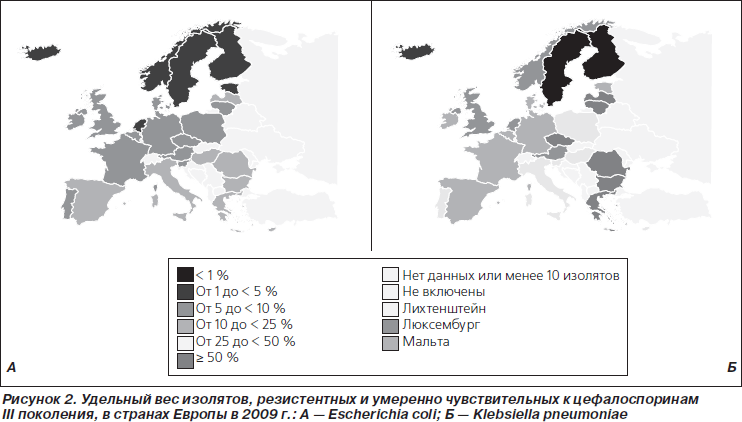
Достоверные данные о географическом распространении клинически значимых микроорганизмов с определенным типом антибиотикорезистентности можно получить на сайте Европейского центра по контролю за инфекциями (ECDC). Организованная на базе ECDC система слежения за антибиотикорезистентностью (EARS-Net) собирает и анализирует статистически релевантное количество данных из клинических лабораторий большинства европейских стран. Некоторые из карт с этой страницы представлены на рис. 1 (А и Б), по ним можно оценить частоту выделения E.coli (А) и K.pneumoniae (Б), которые устойчивы или умеренно чувствительны к цефалоспоринам III поколения, то есть являются подозрительными на продукцию b-лактамаз (подлежат подтверждающему тесту). Можно убедиться в том, что частота встречаемости ESBL-продуцентов среди клинических изолятов в различных странах очень неоднородна. Так, в Южной и Западной Европе частота ESBL-продуцентов среди изолятов K.pneumoniae составляет от 20 до 50 %, в то время как в странах Северной Европы, таких как Финляндия, Швеция и Германия, а также в Испании ESBL-продуценты составляют всего от 1 до 10 %. Удельный вес изолятов E.coli, резистентных к цефалоспоринам III поколения в 9 из 28 стран, предоставляющих сведения об антибиотикорезистентности, составляет более 10 %.
В Германии в 2010 г. удельный вес ESBL-продуцентов среди более 10 тысяч клинических изолятов E. coli составил 8,8 % (ARMIN 2010). При этом очевидна тенденция к росту. Так, в 2006 г. этот показатель составлял всего около 3 %.
Факторы риска приобретения пациентами ESBL-продуцентов
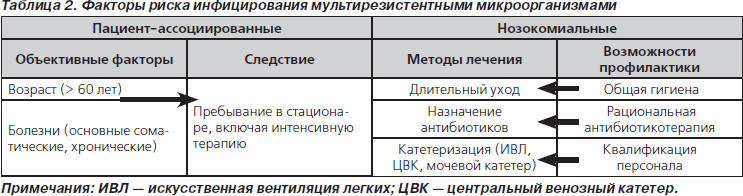
Ни Украина, ни Россия не посылают данные об антибиотикорезистентности клинических изолятов в ECDC. Данные отдельных исследователей, к сожалению, не могут быть использованы для сравнения с международными показателями. Поэтому будет целесообразно назвать факторы риска инфицирования пациентов мультирезистентными возбудителями (в том числе продуцентов b-лактамаз). Факторы риска можно разделить на объективные (пациент-ассоциированные) и те, которые связаны с пребыванием в стационаре, назначаемым лечением (нозокомиальные), то есть зависят от врача и, следовательно, могут рассматриваться как пункт приложения профилактических мероприятий (табл. 2).
Пожилой возраст и тяжелые основные или сопутствующие соматические заболевания, требующие стационарного лечения, включая интенсивную терапию, являются объективными факторами риска приобретения мультирезистентных возбудителей. При этом наиболее часто поражаются больные, нуждающиеся в длительном уходе, а также амбулаторные пациенты с хроническими заболеваниями, например с длительно незаживающими ранами. Именно у таких больных чаще всего в схему лечения включены антибиотики. В литературе описаны крупные вспышки нозокомиальных инфекций, вызванных резистентной к цефалоспоринам III поколения Klebsiella pneumoniae, в отделениях по оказанию неотложной помощи [12, 14]. Но и в стационарах общего профиля проблема ESBL-продуцентов приобретает все большее значение [15, 16].
Методы и длительность лечения таких пациентов относятся к тем факторам риска, которые можно и нужно регулировать. Речь идет о необходимости, правильности постановки и длительности применения катетеров (венозных, мочевых путей, для искусственной вентиляции легких). То же самое относится к антибиотикотерапии.
Хотелось бы особо остановиться на правилах больничной гигиены в отношении мультирезистентных энтеробактерий.
ESBL-продуценты в аспекте больничной гигиены
Приобретая множественную резистентность к антибиотикам, энтеробактерии не становятся более устойчивыми во внешней среде, чем другие их «собратья», чувствительные к антибиотикам. Все грамотрицательные микроорганизмы, не образующие спор, погибают при температуре выше 60 оС, неустойчивы к высыханию и обычным дезинфекционным средствам. Поэтому по сравнению с другими мультирезистентными микроорганизмами, такими как грамположительные стафилококки (в том числе MRSA), энтерококки (в том числе VRE) или спорообразующая C.difficile, ESBL-продуценты из семейства Enterobacteriaceae не требуют каких-либо специальных дезинфекционных средств или дополнительных мероприятий для профилактики внутрибольничной инфекции. В кругах специалистов по больничной гигиене в Германии периодически возникает дискуссия о необходимости скрининга на наличие ESBL-продуцентов при поступлении в стационар или изоляции пациента с обнаруженным ESBL-продуцентом в отдельной палате [17]. Но кроме исключительных случаев, таких как выделение ESBL-продуцента из дыхательных путей больного, целесообразность изоляции сомнительна. Наиболее действенное и универсальное профилактическое и противоэпидемическое мероприятие при нозокомиальных инфекциях любого генеза — это строгое соблюдение стандартов гигиены, включая дезинфекцию рук персонала, методов асептики и антисептики.
В конце октября 2011 г. в немецких средствах массовой информации прокатилась волна обвинений в несоблюдении правил гигиены в Бременской университетской клинике. Поводом стала смерть трех младенцев в отделении недоношенных от инфекции ESBL-продуцентами, предположительно клебсиеллами. Расследованием занялись специалисты из Института Роберта Коха. Подробности появятся позже...
1. IDSA Report. Bad Bugs, No Drugs: No ESKAPE! An Update from the Infectious Diseases Society of America // Clin. Infect. Dis. — 2009. — 48. — 1-12.
2. Rice L.B. Federal funding for the study of antimicrobial resistance in nosocomial pathogens: no ESKAPE // J. Infect. Dis. — 2009. — 197. — 1079-81.
3. Bush K., Jacoby G.A., Medeiros A.A.: A functional classification scheme for b-lactamases and its correlation with molecular structure // Antimicrob. Agents Chemother. — 1995. — 39. — 1211-33.
4. Knothe H., Shah P., Krcmery V. et al. Transferable resistance to cefotaxime, cefoxitin, cefamandole und cefuroxime in clinical isolates of Klebsiella pneumoniae and Serratia marcescens // Infection. — 1983. — 11. — P. 315-317.
5. Bradford P.A., Bratu S., Urban C. et al. Emergence of carbapenemresistant Klebsiella species possessing the class A carbapenem-hydrolyzing KPC-2 and inhibitor-resistant TEM-30 b-lactamases in New York City // Clin. Infect. Dis. — 2004. — 39. — 55-60.
6. Urban C., Bradford P.A., Tuckman M. et al. Carbapenem-resistant Escherichia coli harboring Klebsiella pneumoniae carbapenemase b-lactamases associated with long-term care facilities // Clin. Infect. Dis. — 2008. — 46. — e127-30.
7. Bratu S., Landman D., Haag R. et al. Rapid spread of carbapenemresistant Klebsiella pneumoniae in New York City: a new threat to our antibiotic armamentarium // Arch. Intern. Med. — 2005. — 165. — 1430-35.
8. Struelens M.J., Monnet D.L., Magiorakos A.P., Santos O., Connor F., Giesecke J.European NDM-1 Survey Participants: New Delhi metallo-beta-lactamase 1-producing Enterobacteriaceae: emergence and response in Europe // Euro Surveill. — 2010. — 15 (46). pii: 19716.
9. Falagas M.E., Bliziotis I.A. Pandrug-resistant gram-negative bacteria: the dawn of the post-antibiotic era? // Int. J. Antimicrob. Agents. — 2007. — 29. — 630-36.
10. Stuerenburg E., Mack D. Expenden-spectrum beta-lactamases: Implification for the clinical microbiology laboratory, therapy and infection control // J. Infect. — 2003. — 47. — 273-95.
11. National Committee for Clinical Laboratory Standards (NCCLS). Performance standards for antimicrobial susceptibility testing // Wayne, PA. — 2003. — M100-S13.
12. Burak S., Engelhart S., Exner M. et al. Nosokomiale Ausbrьche multiresistenter Klebsiella pneumoniae-Stдmme auf Intensivstationen // Chemotherapie Journal. — 2006. — 15. — 112-18.
13. Deshpande L.M., Jones R.N., Fritsche T.R., Sader H.S. Occurrence and characterization of carbapenemase-producing Enterobacteriaceae: report from the SENTRY Antimicrobial Surveillance Program (2000–2004) // Microb. Drug. Resist. — 2006. — 12. — 223-30.
14. Pena C., Pujol M., Ardanuy C.. et al. An outbreak of hospital-acquired Klebsiella pneumoniae bacteraemia, including strains producing extended spectrum beta-lactamase // J. Hosp. Infect. — 2001. — 47. — 53-59.
15. Paterson D.L., Bonorno R.A., Extended-spectrum beta-lactamases: a clinical update // Clin. Microb. Rev. — 2005. — 18. — 657-686.
16. Pitout J.D., Laupland K.B. Extended-spectrum beta-lactamase-producing Enterobacteriaceae: an emerging public-health concern // Lancet Infec. Dis. — 2008. — 8. — 159-166.
17. Baum H., Dettenkofer M., Heeg P. Schrцppel K., Wendt C. Konsensusempfehlung Baden-Wьrttemberg: Umgang mit Patienten mit hochresistenten Enterobakterien inklusive ESBL-Bildnern // Hyg. Med. — 2010. — 35 (1/2).

2012/94/94_.jpg)