Журнал «Травма» Том 12, №3, 2011
Вернуться к номеру
Проспективное обсервационное исследование по эффективности и безопасности бемипарина при введении первой дозы через шесть часов после эндопротезирования коленного или тазобедренного сустава
Авторы: J. Ignacio Abad, Antonio Gómez-Outes, Javier Martínez-González, Eduardo Rocha on behalf of the Bemiparin 6 Hours After Surgery Study Group
Рубрики: Травматология и ортопедия
Версия для печати
Введение. По результатам клинических исследований, бемипарин (bemiparin) — эффективный и безопасный препарат для лечения пациентов после эндопротезирования коленного или тазобедренного сустава.
Материалы и методы. Мы провели проспективное открытое многоцентровое неконтролируемое исследование для изучения действия бемипарина в дозе 3500 МЕ/день. Введение первой дозы осуществлялось через шесть часов после операции. В исследовании приняли участие 1009 пациентов, которым выполнено тотальное эндопротезирование тазобедренного или коленного сустава в условиях обычной клинической практики. Нами проанализированы зарегистрированные случаи развития венозного тромбоэмболизма и тромбоэмболии легочной артерии, подтвержденные объективными методами исследования, серьезных кровотечений, летальных исходов, тромбоцитопении и других побочных эффектов, развившихся в течение 6 недель после начала тромбопрофилактики.
Результаты. Частота зарегистрированных симптоматических тромбозов глубоких вен составила 0,3 % (ДИ 95% 0,1–0,9 %). Не отмечено ни одного случая подтвержденной легочной эмболии. Уровень серьезных кровотечений составил 1,4 % (14 случаев) (ДИ 95% 0,8–2,3 %). Нейроаксиальная блокада была использована у 937 человек, что составило 92,2 %. Не отмечено ни одного случая развития спинальной гематомы, фатальных кровотечений или кровоизлияния в жизненно важные органы. Было зафиксировано 6 случаев умеренной тромбоцитопении (0,6 %), которые не требовали прекращения лечения. Не отмечено ни одного случая гепарин-индуцированной тромбоцитопении II типа тяжелой степени. Не было ни одного летального исхода за период проведения профилактики. Средняя длительность госпитализации составила 9 дней. Профилактическое введение бемипарина после выписки из больницы получили 92,5 % пациентов в среднем на протяжении 38 дней. За этот период не было зарегистрировано ни одного случая тромбоэмболии и кровотечения. Начало тромбопрофилактики в послеоперационном периоде позволило проводить госпитализацию в день операции 29,3 % пациентов.
Заключение. Тромбопрофилактика бемипарином, начатая через шесть часов после операции и продолжающаяся в течение 5–6 недель после тотального эндопротезирования коленного или тазобедренного сустава, характеризуется низким уровнем венозных тромбоэмболий, серьезных кровотечений и других побочных эффектов в рутинной клинической практике. Тромбопрофилактика бемипарином через 6 часов после операции облегчает проведение нейроаксиальной анестезии, не понижая ее эффективность.
Бемипарин, гепарин, эндопротезирование коленного сустава, эндопротезирование тазобедренного сустава, тромбопрофилактика, венозный тромбоэмболизм, тромбоз глубоких вен, тромбоэмболия легочной артерии.
Введение
Пациенты, которым выполняются большие ортопедические вмешательства, например тотальное эндопротезирование коленного (ТЭПКС) или тотальное эндопротезирование тазобедренного сустава (ТЭПТС), относятся к группе высокого риска венозного тромбоэмболизма (ВТЭ) [9, 15]. Этот риск сохраняется в течение нескольких недель после операции [9]. Таким пациентам назначается лекарственная профилактика тромбоза как рутинная мера, уже в течение более 20 лет позволяющая снизить уровень смертности и легочной эмболии с летальным исходом [5]. С целью предотвращения тромбоза глубоких вен (ТГВ) низкомолекулярный гепарин действует гораздо эффективнее, чем варфарин или аспирин [23]. Применение механических способов профилактики позволяет повысить эффективность профилактики тромбоэмболических осложнений [9, 19]. Также обоснованы преимущества проведения нейроаксиальной анестезии (т.е. спинальной или эпидуральной) у подобных пациентов [1, 18].
Тромбопрофилактика в сочетании с нейроаксиальной анестезией для обезболивания при проведении серьезных ортопедических оперативных вмешательств применяется в 60–95 % случаев после ТЭПКС и ТЭПТС [8, 14], что ставит нас перед необходимостью развития новых стратегий лечения данной группы пациентов, стратегий с более высоким уровнем безопасности. В связи с повышенным риском развития спинальной гематомы [11, 21] рекомендуется избегать проведения нейроаксиальной анестезии пациентам, принимающим антитромботические средства [9]. С другой стороны, тромбопрофилактику желательно начинать через несколько часов после завершения операции во избежание предоперационного нарушения гемостаза и, следовательно, для снижения риска развития спинальной гематомы и кровотечения в ходе операции, то есть тогда, когда действие низкомолекулярного гепарина является безопасным [20, 24].
Бемипарин — это новый низкомолекулярный гепарин второго поколения [16], являющийся более эффективным, чем стандартный гепарин, что было показано в ходе сравнительного исследования, проведенного Kakkar et al. Для профилактики ВТЭ бемипарин можно назначать как до, так и после операции эндопротезирования тазобедренного сустава [12], в то время как инструкции по применению других препаратов низкомолекулярного гепарина в Европе, как правило, рекомендуют назначать их до операции [4].
В ходе сравнительного клинического исследования о применении эноксапарина при ТЭПКС были получены данные о том, что при введении бемипарина в дозе 3500 МЕ/сут через 6 часов после операции в сравнении со стартом эноксапарина в дозе 4000 МЕ/сут за 12 часов до операции отмечалась более низкая частота симптоматических проявлений ВТЭ. Частота развития симптоматических глубоких венозных тромбозов также оказалась несколько ниже при введении бемипарина, однако уровень статистической достоверности не был достаточным. У обоих препаратов отмечается практически одинаковый профиль безопасности [14].
Настоящее исследование по данным наблюдения было разработано с целью получения большего количества информации о постоперационном применении бемипарина с профилактической целью у ортопедических больных, основанной на клиническом опыте в ежедневной клинической практике
Материалы и методы
Дизайн исследования — многоцентровое проспективное обсервационное открытое исследование оценки бемипарина при старте тромбопрофилактики через 6 часов после ТЭПКС или ТЭПТС в реальной клинической практике. Исследование проводилось согласно Испанским требованиям для обсервационных исследований (Circular 4/2000 of the Spanish Medicines Agency) и Европейскому руководству (CPMP/PhVWP/109/99/corr).
Участником исследования мог стать любой пациент, имеющий показания для ТЭПКС или ТЭПТС. В протоколе исследования отсутствовали критерии исключения.
Все пациенты получали бемипарин в дозе 3500 МЕ/сутки (старт первой дозы через 6 часов после операции) в течение периода повышенного риска развития ВТЭ. Длительность применения бемипарина представлена медианой дней (первый и третий квартиль) профилактики. Нефармакологические методы лечения, например активная или пассивная иммобилизация, эластический бандаж и/или прерывистая компрессионная терапия, применялись в соответствии с рутинной практикой медицинских центров, и об этом указывалось в истории болезни.
Первичная точка для оценки эффективности — подтвержденный симптоматический эпизод ВТЭ, включая ТГВ, ТЭЛА или оба осложнения. При любом клинически заподозренном эпизоде ВТЭ пациенту проводились объективные методы обследования с целью подтверждения или опровержения наличия ВТЭ (допплеровское УЗИ или восходящая контрастная венография, вентиляционно-перфузионное сканирование легких, легочная ангиография, спиральная компьютерная томография при нефатальной ТЭЛА или данные аутопсии при подозрении на летальный исход вследствие ТЭЛА). Решение о проведении объективных исследований принималось лечащим врачом.
В качестве первичной конечной точки безопасности была принята частота развития «большого» кровотечения, т.е. наличие клинически выраженного кровотечения, проявляющегося снижением уровня гемоглобина как минимум на 2 г/дл или потребовавшего проведения гемотрансфузии в объеме 2 и более доз крови; кровоизлияние в жизненно важные органы (внутричерепное, спинальное, ретроперитонеальное, внутриглазное); фатальное кровотечение; кровотечение, потребовавшее хирургического вмешательства для его остановки; любое кровотечение, требующее прекращения лечения. За незначительное кровотечение было принято любое кровотечение, не подходящее под критерии «большого» кровотечения.
Были исследованы следующие параметры: уровень гематокрита, гемоглобина, тромбоцитов, уровни АЛТ (аланинаминотрансферазы), АСТ (аспар- татаминотрансферазы), ГГТП (гамма-глутамилтранспептидазы). Тромбоцитопению диагностировали при снижении количества тромбоцитов в крови ниже 150 000 мм3, а постоперационную анемию — при уровне гемоглобина < 12 г/дл на момент выписки из стационара. Проводилась оценка летальности, аллергических реакций, раневых гематом и реакций в месте введения препарата.
Было запланировано 3 осмотра: первый — в день операции (исходный), второй — во время выписки из больницы (оценка исходов лечения), третий — во время последующих визитов пациента в поликлинику (после выписки из стационара).
Для оценки частоты развития тромбоза глубоких вен, значительных и незначительных кровотечений, тромбоцитопении, смертей и аллергических реакций мы рассчитывали 95% доверительный интервал (ДИ) с использованием программного обеспечения SPSS, версия 7.5.
Результаты
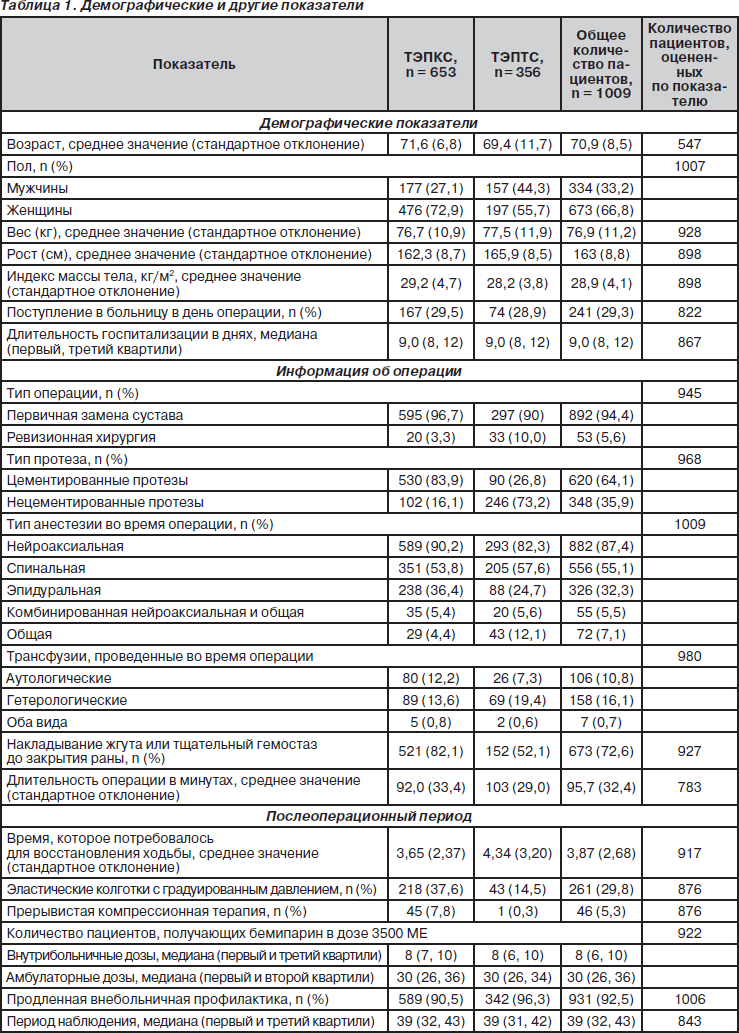
За период с ноября 2001 года по март 2003 года в исследование было включено 1009 пациентов в 23 медицинских центрах Испании. Исходные характеристики пациентов, включенных в исследование, указаны в табл. 1.
Среди 1009 пациентов, включенных в исследование, 653 (64,7 %) было проведено ТЭПКС, 356 (35,3 %) — ТЭПТС. Средний возраст пациен- тов — 70,9 года. Большинство пациентов — женщины (66,8 %). Средний вес тела пациентов — 76,9 кг. Нейроаксиальная анестезия была проведена 882 пациентам (87,4 %), нейроаксиальная анестезия в комбинации с общей была проведена 55 пациентам (5,5 %). Общее количество операций, проведенных с применением нейроаксиальной анестезии, — 937 (92,9 %). В период госпитализации пациенты получали бемипарин с профилактической целью в среднем в течение 8 дней. Более 90 % пациентов продолжали получать бемипарин в дозе 3500 МЕ/сутки на протяжении 30 дней после выписки из стационара. В день операции в больницу поступило 29 % пациентов.
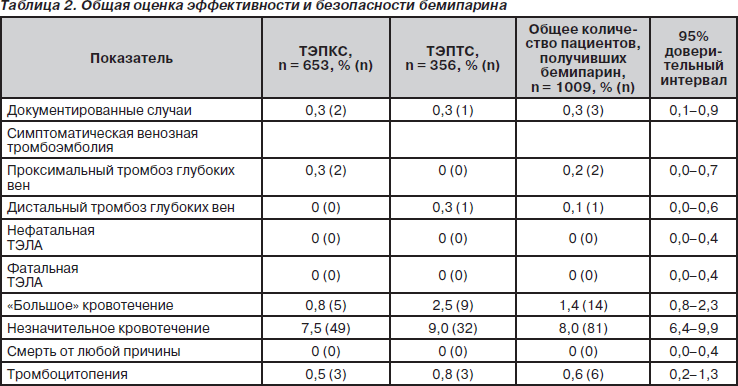
У всех пациентов была проведена оценка конечных точек при выписке из больницы. У 3 пациентов из 1009 (0,3 %, ДИ 95% 0,1–0,9 %) развились симптомы ТГВ (табл. 2). Все случаи произошли в больнице на 6–9-й день после операции. При проведении допплеровского УЗИ было подтверждено 2 проксимальных ТГВ после ТЭПКС и 1 дистальный ТГВ после ТЭПТС. У одного пациента после ТЭПКС развились симптомы легочной эмболии на 4-й день, однако при сканировании легких диагноз не подтвердился. Не было отмечено ни одного случая ВТЭ после выписки из стационара.
«Большие» кровотечения развились у 14 пациентов (1,4 %, ДИ 95% 0,8–2,3 %) из 1009 (табл. 2). Все случаи произошли во время госпитализации: 10 случаев кровотечения из раны, 3 — кровоизлияния в протезированный сустав, 1 — желудочно-кишечное кровотечение (рвота «кофейной гущей»). Ни одно из кровотечений не закончилось летально. У одного из пациентов кровотечение развилось до введения первой дозы бемипарина, при этом потребовалось проведение повторной ревизионной операции для контроля гемостаза. Выраженное желудочно-кишечное кровотечение развилось у пациента с гастроэзофагеальным рефлюксом третьей степени в анамнезе и грыжей пищеводного отверстия, который параллельно получал нестероидные противовоспалительные препараты (НПВП) внутривенно. Оба препарата (НПВП и бемипарин) были отменены. Бемипарин был назначен снова спустя два дня после стабилизации состояния пациента. В дальнейшем кровотечение у данного пациента не повторилось. Ни у одного из пациентов, которым была проведена операция с применением нейроаксиальной анестезии (937 человек, что составило 92,9 % от общего количества пациентов), не развилась спинальная гематома.
За время приема бемипарина не было ни одного летального исхода. Тромбоцитопения развилась у 6 пациентов (0,6 %, ДИ 95% 0,2–1,3 %) из 1009 (табл. 2). При этом уровень тромбоцитов находился в пределах от 80 000 до 135 000 мм3, что не требовало прекращения приема бемипарина. Не было ни одного случая гепарин-индуцированной тромбоцитопении II типа тяжелой степени. Постоперационная анемия легкой и умеренной степени (Hb 8–12 г/дл) была отмечена у 484 больных (48,0 %). Только у 3 пациентов (0,3 %) уровень гемоглобина был ниже 8 г/дл на протяжении всего исследования. Было отмечено незначительное транзиторное повышение уровня ферментов менее чем в три раза по сравнению с нормой: повышение АСТ — у 2,1 % пациентов, повышение АЛТ — у 4,0 % и повышение ГГТП — у 3,2 % пациентов. Ни один из этих случаев не являлся клинически значимым и не требовал отмены бемипарина. Незначительная аллергическая реакция — уртикарная сыпь умеренной степени выраженности в месте введения препарата — была отмечена у 1 пациента (0,1 %, ДИ 95% 0,0–0,6 %), не требовала отмены лечения. Случаев системных или общих аллергических реакций не было. Среди всех включенных в исследование пациентов у 16,1 % развилась гематома в области послеоперационной раны (ДИ 95% 13,8–18,5 %), но никому из них не потребовалось местного повторного вмешательства или продления госпитализации. В 6 центрах из 23 у 1,5 % пациентов были отмечены случаи послеоперационного инфицирования раны. Реакции в месте введения препарата развились у 20 % пациентов, большинство из реакций — умеренно выраженный экхимоз. Не было отмечено ни одного случая гематомы объемом более 5 см в диаметре в месте инъекции препарата, требовавшей отмены препарата. В ходе исследования не было зарегистрировано ни одной редкой или неожиданной побочной реакции на бемипарин.
Амбулаторное наблюдение
После выписки из стационара 931 пациенту (92,5 %) была проведена пролонгированная тромбопрофилактика. Не отмечено ни одного тромбоэмболического или геморрагического осложнения за период амбулаторного наблюдения. Пациент, 72 лет, с ишемической болезнью сердца в анамнезе скончался в результате острого инфаркта миокарда через 2 месяца после ТЭПКС и спустя 20 дней после последней дозы бемипарина.
Обсуждение
В нормальной клинической практике при применении бемипарина через 6 часов после операции была отмечена низкая частота развития ВТЭ. Частота документированного симптоматического ВТЭ в период госпитализации в ходе нашего обсервационного исследования составила 0,3 % (два проксимальных ТГВ, один дистальный ТГВ, ни одного случая документированной симптоматической ТЭЛА), что полностью сопоставимо и даже ниже уровня развития данного осложнения, чем при использовании других антитромботических средств с целью кратковременной тромбопрофилактики после серьезных ортопедических хирургических вмешательств [22]. Однако необходимо подчеркнуть, что результаты сопоставления обсервационных и клинических исследований необходимо интерпретировать с осторожностью, учитывая разную методологическую основу этих двух исследований.
В нашем исследовании более 90 % пациентов получали расширенную профилактику бемипарином в среднем в течение 38 дней. При этом не было отмечено ни одного случая ВТЭ после их выписки. Частота симптоматической ВТЭ в нашем исследовании оказалась ниже частоты симптоматической ВТЭ, отмеченной в ходе недавно проведенного метаанализа с применением других низкомолекулярных гепаринов для проведения продленной тромбопрофилактики после ТЭПКС или ТЭПТС (1,3 % (разброс 0–3,5 %)) [6], или ниже, чем в группе плацебо из того же метаанализа (3,3 %) [6], и ниже уровня встречаемости симптоматической ВТЭ при продленной тромбопрофилактике с фондапаринуксом (0,3 %) [7]. Длительность профилактического приема препарата в нашем исследовании соответствовала текущим рекомендациям [9], включая срок продленной профилакти- ки — 4–5 недель у пациентов после ТЭПТС. Необходимость в удлинении сроков тромбопрофилактики после эндопротезирования коленного сустава все еще находится на обсуждении [9]. Несмотря на это, упомянутый выше метаанализ показал, что среди пациентов, которым выполнены ТЭПКС или ТЭПТС, увеличение сроков профилактики значительно снижает частоту развития симптоматических венозных тромбоэмболий [6]. Снижение риска развития симптоматического ВТЭ значительно более выражено после ТЭПТС, чем после ТЭПКС [6].
Мы обнаружили низкий уровень развития такого осложнения, как значительные кровотечения (1,4 %), что соответствует результатам клинических исследований [12, 14]. Этот показатель ниже, чем при приеме фондапаринукса (2,7 %), и подобен эноксапарину (1,7 %) по результатам клинических исследований, проведенных с участием выбранных групп населения после больших ортопедических вмешательств [3]. Более того, не было отмечено ни одного случая значительного кровотечения как осложнения тромбопрофилактики бемипарином после выписки больного, что соответствует данным упомянутого выше метаанализа, по результатам которого этот показатель составил 0,1 % [6], и ниже частоты этого осложнения при назначении фондапаринукса, равной 2,4 % [7].
В ходе нашего обсервационного исследования не было зарегистрировано ни одного летального исхода. Все случаи тромбоцитопении варьировали от легких до умеренных и не требовали прекращения лечения. Не было ни одного случая тромбоцитопении II типа тяжелой степени. Частота развития гематом в области постоперационной раны и реакций в месте введения совпадает с предыдущими результатами исследования бемипарина и ниже, чем при применении эноксапарина по результатам сравнимого клинического исследования, проведенного на пациентах после эндопротезирования коленного сустава [14]. Не было зафиксировано ни одного редкого или неожиданного побочного эффекта при применении бемипарина в ходе исследования.
Почти треть пациентов, включенных в наше исследование, поступили в больницу в день операции, а не вечером накануне, что позволило значительно снизить стоимость их пребывания в больнице. В недавно проведенном фармакоэкономическом исследовании было показано, что при доминирующей стратегии назначения бемипарина после операции по сравнению с введением эноксапарина до операции исход более положительный при меньших материальных затратах [10].
В нашем исследовании оперативные вмешательства проводились с применением нейроаксиальной анестезии либо при ее сочетании с общей анестезией у более чем 90 % пациентов. При этом не было зафиксировано ни одного случая спинальной гематомы. Несмотря на то что время начала профилактики тромбоза является спорным вопросом [17], признается тот факт, что введение бемипарина через шесть часов после хирургической операции не понижает уровень ее эффективности [14] и хорошо сочетается с техникой проведения нейроаксиальной анестезии [11] в противоположность тактике введения низкомолекулярных гепаринов до операции, нарушающей гемокоагуляционные процессы. Пациентам, которым тромбопрофилактика была начата до операции, нейроаксиальную анестезию следует проводить не ранее чем через 10–12 часов после введения последней дозы низкомолекулярного гепарина [11]. Тромбопрофилактика, начатая ранее 6 часов после операции, может увеличить вероятность кровотечения без повышения эффективности предотвращения тромботических осложнений [17], профилактика тромбоза, начатая позже 12–24 часов после операции, может оказаться менее эффективной. Оптимальное начало тромбопрофилактики — через шесть часов после окончания операции [17].
Данное исследование имеет несколько методологических исключений, его результаты можно интерпретировать в условиях нормальной клинической практики. Исследования данного типа добавляют необходимую информацию, которую невозможно получить при проведении рандомизированных контролируемых исследований [2], когда критерии исключения сужают объем выборки, а наличие специфической клинической ситуации приводит к значительной потере полезной прагматической информации. Таким образом, мы сумели оценить эффект бемипарина в реальной жизни, на большом количестве ортопедических пациентов. Клинические конечные точки исследования — основные значения, необходимые для оценки эффектов нового препарата в клинических исследованиях по предотвращению развития венозного тромбоза [13].
Таким образом, профилактика с применением бемипарина, начатая через шесть часов после операции и продолжающаяся в течение 5–6 недель после ТЭПТС или ТЭПКС, характеризуется низким уровнем развития венозной тромбоэмболии, серьезных кровотечений и других побочных явлений в нормальной клинической работе. Более того, тромбопрофилактика бемипарином, начатая послеоперационно, позволяет снизить вероятность развития спинальной гематомы и облегчает проведение нейроаксиальной анестезии/аналгезии, не снижая эффективности тромбопрофилактики.
Beattie W.S., Badner N.H., Choi P. Epidural analgesia reduces postoperative myocardial infarction: a meta-analy- sis // Anesth. Analg. — 2001. — 93. — 853-858.
Black N. Why we need observational studies to evaluate the effectiveness of health care // BMJ. — 2001. — 312. — 1215-1218.
Bounameaux H., Perneger T. Fondaparinux: a new pentasaccharide for thrombosis prevention // Lancet. — 2002. — 359. — 1710-1711.
Chapman T.M., Goa K.L. Bemiparin: a review of its use in the prevention of venous thromboembolism and treatment of deep vein thrombosis // Drugs. — 2003. — 63. — 2357-2377.
Dahl O.E., Caprini J.A., Colwell C.W. Jr, Frostick S.P., Haas S., Hull R.D., Laporte S., Stein P.D. Fatal vascular outcomes following major orthopedic surgery // Thromb. Haemost. — 2005. — 93. — 860-866.
Eikelboom J.W., Quinlan D.J., Douketis J.D. Extendedduration prophylaxis against venous thromboembolism after total hip or knee replacement: a meta-analysis of the randomised trials // Lancet. — 2001. — 358. — 9-15.
Eriksson B.I., Lassen M.R.; PENTasaccharide in HIp-FRActure Surgery Plus Investigators. Duration of prophylaxis against venous thromboembolism with fondaparinux after hip fracture surgery: a multicenter, randomized, placebo-controlled, double-blind study // Arch. Intern. Med. — 2003. — 163. — 1337-1342.
Fenollosa J., Seminario P. Effcacia y seguridad de bemiparina en la proffilaxis del tromboembolismo venoso en cirugia ortopedica // Rev. Ortop. Traumatol. — 2001. — 6. — 460-465.
Geerts W.H., Pineo G.F., Heit J.A., Bergqvist D., Las- sen M.R., Colwell C.W., Ray J.G. Prevention of venous thromboembolism: the 7th ACCP conference on antithrombotic and thrombolytic therapy // Chest. — 2004. — 126. — 338S-400S.
Honorato J., Gomez-Outes A., Navarro-Quilis A., Martinez-Gonzalez J., Rocha E., Planes A. Pharmacoeconomic analysis of bemiparin and enoxaparin as prophylaxis for venous thromboembolism in total knee replacement surgery // Pharmacoeconomics. — 2004. — 22. — 885-894.
Horlocker T.T., Wedel D.J., Benzon H., Brown D.L., Enneking F.K., Heit J.A., Mulroy M.F., Rosenquist R.W., Rowlingson J., Tryba M., Yuan C.S. Regional anesthesia in the anticoagulated patient: defining the risks (the second ASRA consensus conference on neuraxial anesthesia and anticoagulation) // Reg. Anesth. Pain Med. — 2003. — 28. — 172-197.
Kakkar V.V., Howes J., Sharma V., Kadziola Z. A comparative, double-blind, randomized trial of a new second generation LMWH (Bemiparin) and UFH in the prevention of post-operative venous thromboembolism. The Bemiparin Assessment Group // Thromb. Haemost. — 2000. — 83. — 523-529.
Lowe G.D., Sandercock P.A., Rosendaal F.R. Prevention of venous thromboembolism after major orthopaedic surgery: is fondaparinux an advance? // Lancet. — 2003. — 362. — 504-505.
Navarro-Quilis A., Castellet E., Rocha E., Paz-Jimenez J., Planes A. Efficacy and safety of Bemiparin compared with Enoxaparin in the prevention of venous thromboembolism after total knee arthroplasty. A randomized double-blind clinical trial // J. Thromb. Haemost. — 2003. — 1. — 425-432.
Nicolaides A.N., Breddin H.K., Fareed J., Gold- haber S., Haas S., Hull R., Kalodiki E., Myers K., Samama M., Sasahara A.; Cardiovascular Disease Educational, Research Trust, the International Union of Angiology. Prevention of venous thromboembolism international consensus statement. Guidelines compiled in accordance with the scientific evidence // Int. Angiol. — 2001. — 20. — 1–37.
Planes A. Review on bemiparin sodium — a new second generation low-molecular-weight heparin — and its applications in venous thromboembolism // Expert Opin. Pharmacother. — 2003. — 4. — 1551-1561.
Raskob G.E., Hirsh J. Controversies in timing of the first dose of anticoagulant prophylaxis against venous thromboembolism after major orthopaedic surgery // Chest. — 2003. — 124. — 379S-385S.
Rodgers A., Walker N., Schug S., McKee A., Kehlet H., van Zundert A., Sage D., Futter M., Saville G., Clark T., MacMahon S. Reduction of postoperative mortality and morbidity with epidural or spinal anaesthesia: results from overview of randomised trials // BMJ. — 2000. — 321. — 1493-1497.
Silbersack Y., Taute B.M., Hein W., Podhaisky H. Prevention of deep-vein thrombosis after total hip and knee replacement. Low-molecular-weight heparin in combination with intermittent pneumatic compression // J. Bone Joint. Surg. Br. — 2004. — 86. — 809-812.
Strebel N., Prins M., Agnelli G., Buller H.R. Preoperative or postoperative start of prophylaxis for venous thromboembolism with low-molecular-weight heparin in elective hip surgery? // Arch. Intern. Med. — 2002. — 162. — 1451-1456.
Tryba M. European practice guidelines: thromboembolism prophylaxis and regional anesthesia // Reg. Anesth. Pain Med. — 1998. — 23 (2 Suppl.). — 178-182.
Turpie A.G., Bauer K.A., Eriksson B.I., Lassen M.R. Fondaparinux vs enoxaparin for the prevention of venous thromboembolism in major orthopedic surgery: a meta-analysis of 4 randomized double-blind studies // Arch. Intern. Med. — 2002. — 162. — 1833-1840.
Westrich G.H., Haas S.B., Mosca P., Peterson M. Metaanalysis of thromboembolic prophylaxis after total knee arthroplasty // J. Bone Surg. Br. — 2000. — 82-B. — 795-800.
ZuVerey P., Laporte S., Quenet S., Molliex S., Auboyer C., Decousus H., Mismetti P. Optimal low-molecular-weight heparin regimen in major orthopaedic surgery. A meta-analysis of randomised trials // Thromb. Haemost. — 2003. — 90. — 654-661.